西瓜细菌性果斑病菌基因Aave—3192和Aave—2108的功能研究
周迎辉 胡方平 蔡学清
摘 要 从本实验室构建的西瓜细菌性果斑病菌菌株A13的Mini-Tn5转座子突变体库中筛选出2株致病性丧失的突变菌株166和167,亚克隆及测序结果表明,突变株166和167 的Tn5插入位点基因编号分别为Aave-3192和Aave-2108。为了进一步明确这2个基因的功能,分别对这2个基因进行互补。生物学试验结果表明,互补菌株恢复对西瓜果实的致病性,且在游动性、群体感应、胞外多糖、生物膜等性状上部分恢复至野生菌株A13的水平,表明这2个基因与该病菌在西瓜上的致病性相关。
关键词 西瓜细菌性果斑病菌;基因突变;基因互补;生物学测定
中图分类号 S432.1 文献标识码 A
Abstract Two mutants(166 and 167) lacked of pathogenicity from the mutant library of wild strain A13 (Acidovorax citrulli)of bacterial fruit blotch of watermelon constructed by insertion of transposon Mini-Tn5was screened. The Tn5 inserted genes of mutant166 and mutant167 were Aave-3192 and Aave-2108 respectively by subcloning and sequence blasting. To identify the functions of the two genes, the complementary strains 166hb and 167hb were constructed, and the pathogenicity and some other biological characters were tested. The results showed that the characters of the two strains were recovered on pathogenicity, motility, quorum sensing, exo-polysaccharides, the colonial morphology and biofilm inordinately. Overall, the results indicated that the two genes were related to the pathogenicity of BFB on watermelon.
Key words Acidovorax citrulli;Gene mutation;Gene complement;Biological determination
doi 10.3969/j.issn.1000-2561.2016.07.014
西瓜细菌性果斑病(Bacteria Fruit Blotch of Watermelon)是西瓜上重要的病害之一,由西瓜噬酸菌(Acidovorax citrulli, Ac)[1]侵染引起。作为世界性检疫病害,由于缺少有效的管控措施,近年来已经给多个国家的瓜类产业带来巨大的损失。该病菌的致病机制研究结果表明,Ⅱ型[2]、Ⅲ型[3-6]、Ⅳ型[7-10]、Ⅵ型[11]分泌系统均参与了该病菌的致病,如Johnson等[2]报道了Ⅱ型分泌系统有助于西瓜噬酸菌在西瓜种子到苗期的传播和定殖,还证实Ⅲ型分泌系统基因hrcC(编码Ⅲ型菌毛蛋白)是重要的致病因子。本研究小组构建了野生菌A13的Tn5插入突变体文库,通过筛选获得2株致病性丧失的突变菌株166和167,在此基础上,通过亚克隆技术确定Tn5插入基因为Aave-3192(Hypothetical protein)和Aave-2108(Methyl-accepting chemotaxis sensory transducer)。已有研究报道伪茄拉尔氏菌(Ralstonia pseudosolanacearum)强致病性菌株MAFF106611的甲基受体趋化性蛋白基因mcpM的突变体较野生菌株的侵染能力显著降低[12],而在果斑病菌中尚未见这2个基因功能的相关研究报道,本研究拟通过基因互补的方法,进一步探讨其功能。
1 材料与方法
1.1 材料
1.1.1 供试菌株和质粒 西瓜细菌性果斑病菌株A13(RifR)、突变株166和突变株167(RifR,KmR)、大肠杆菌DH5α、质粒pBluescriptⅡks(+)(AmpR)、pBBR1MCS-5(GmR)为本实验室保存,助手菌DH5α(pRK 600)(CmR)、 Agrobacterium tumefaciensNTL4由中国农业大学张力群教授惠赠,Erwinia carotovora subsp.carotovora(Ecc-1)由中国农业科学院赵廷昌研究员惠赠,pMD19-T购自TaKaRa。
1.1.2 供试西瓜和甜瓜品种 西瓜种子(特大西红宝)购于市场,甜瓜种子由中国农业科学院赵廷昌研究员惠赠。
1.1.3 培养基 LB、KB培养基配制参照方中达《植病研究法》第三版[13],ABM培养基参照刘鹏等[14]的方法。
1.1.4 实验使用的抗生素及工作浓度 利福平Rif 100 μg/mL,氨苄青霉素Amp 50 μg/mL,卡那霉素Km 50 μg/mL,氯霉素Cm 20 μg/mL,庆大霉素Gm 25 μg/mL。
1.1.5 试剂 质粒小量提取试剂盒、核酸染料Gelstain、高保真酶HiFi Taq、2×EasytaqPCRMix和基因组DNA提取试剂盒购自全式金生物技术有限公司,DNA纯化试剂盒购自TIANGEN,限制性内切酶PstⅠ、 KpnⅠ、 XbaⅠ、 T4 ligase等购自TaKaRa。
1.1.6 引物 本研究使用的引物见表1。
1.2 方法
1.2.1 菌株的培养 将野生菌株A13、突变菌株和互补菌株转到KB平板上,于28 ℃恒温培养24~48 h或接种到KB液体培养基(28 ℃,180 r/min)培养,备用。其中突变菌株和互补菌株在培养基中添加相对应的抗生素。
1.2.2 亚克隆定位突变株中Tn5的插入位点 分别提取突变株166和167的基因组DNA及pBluescriptⅡks(+)质粒DNA(参照提取试剂盒说明书),用限制性内切酶PstⅠ分别酶切突变株166和167的基因组DNA和pBluescriptⅡks(+)的质粒DNA(37℃,3~4 h),并对酶切质粒pBluescriptⅡks(+)去磷酸化处理(37 ℃,1 h)。回收酶切产物,将基因组酶切产物和质粒DNA的酶切产物通过T4 ligase连接,转化DH5α感受态细胞,具体步骤参照《分子克隆实验指南》[16],将转化产物涂布含有50 μg/mL Amp、50 μg/mL Km的LB抗性平板进行筛选,37 ℃倒置培养约16 h,挑取克隆子,提取质粒DNA,通过PstⅠ酶切验证。将验证正确的克隆子菌液送上海生物工程有限公司测序,获得Tn5侧翼序列,测序结果在NCBI上与西瓜噬酸菌基因组AAC00-1序列(GenBank登录号NC-008752)比对,确定Tn5转座子插入位点。
1.2.3 互补菌株构建及验证 互补载体的构建:根据西瓜噬酸菌AAC00-1基因组中Aave-3192和Aave-2108基因的序列,设计2对引物166F/R和167F/R,以A13基因组为模板分别扩增相应的基因片段,将扩增得到的基因片段回收纯化,对纯化产物和pBBR1MCS-5质粒DNA分别进行双酶切(KpnⅠ和XbaⅠ),再回收纯化,16 ℃连接,转化,涂布含有Gm抗性的LB平板,培养约16 h,挑取阳性克隆子进行PCR验证(引物分别为166F/R、167F/R)和KpnⅠ/XbaⅠ酶切验证,测序结果与西瓜噬酸菌基因组AAC00-1序列比对一致后即获得互补载体pBBR1MCS-5-166和pBBR1MCS-5-167。
互补菌株的获得:参照Kessler等[17]的方法,分别在含有相应抗生素的培养基中接种受体菌166和167,28 ℃培养24 h;助手菌DH5α(pRK 600)和供体菌DH5α(分别含互补载体pBBR1MCS-5-166和pBBR1MCS-5-167),37 ℃培养16 h;吸取300 μL,12 000 r/min分别离心,去净上清,加入300 μL的无菌水重悬浮,12 000 r/min分别离心,去净上清,再加入300 μL的无菌水重悬浮,将三亲本混合均匀,12 000 r/min离心,去净上清,加入100 μL的无菌水重悬浮,将悬浮液点接于KB平板上,28 ℃培养6~8 h,用无菌水洗下菌苔,将原液和10-1稀释液涂布至含有Rif、Gm和Km的抗性平板上,28 ℃培养4~5 d,挑取克隆子进行西瓜果斑病菌特异性引物SEQID4m/5和互补基因引物166F/R、167F/R的PCR验证。
1.2.4 生物学测定 (1)烟草过敏反应:将待测定的野生菌株、突变株及互补菌株菌液调至OD600=0.6,以清水作阴性对照,用医用无菌注射器接种到烟草叶片内,每个处理重复3次,12~24 h观察记录实验结果。
(2)致病性测定:果实针刺接种参照蔡学清等[18]的方法;甜瓜种子接种参照李明明等[19]的方法,稍作改进,将带菌种子散播在灭菌的0.8%的水琼脂中,于28 ℃的光照培养箱中培养1周,观察记录发病情况。
(3)游动性测定:参照Chesnokova等[20]的方法,取2 μL OD600=1.5的菌液点接于0.3%的半固体KB培养基上,于28 ℃恒温箱内培养2 d或以上,比较观察细菌的运动痕迹。
(4)群体感应:参照孙蕾[21]的实验方法,28 ℃避光培养24 h后,观察记录实验结果。
(5)培养基上的生长情况测定:将A13、突变株、互补菌株分别在NA平板上划线,28 ℃培养72 h后,观察NA平板上菌落形态[22]。
(6)生物膜测定:参照严婉荣等[23]的方法测定生物膜形成能力,并用无水乙醇将结晶紫染色的生物膜洗脱下来,测量OD540的值[24]。
(7)胞外多糖:参照He等[25]的方法,从25 mL菌液中收集产生的胞外多糖,置于37 ℃烘干2 d后称重。
(8)生长曲线:将A13、突变株和互补菌株在KB上活化后,参照严婉荣[23]的方法进行生长曲线的测定。
2 结果与分析
2.1 亚克隆测序分析转座子插入位点
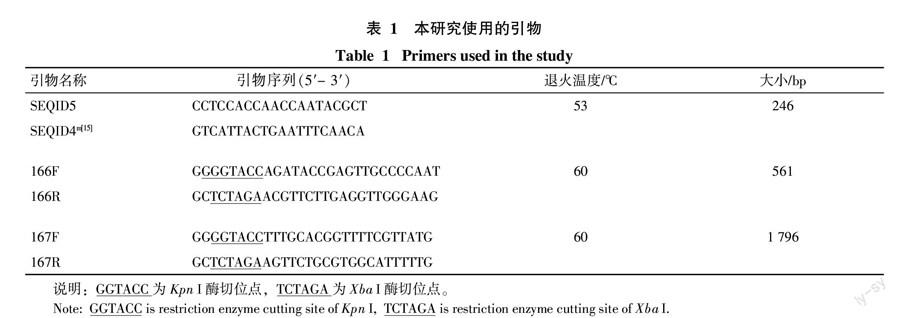
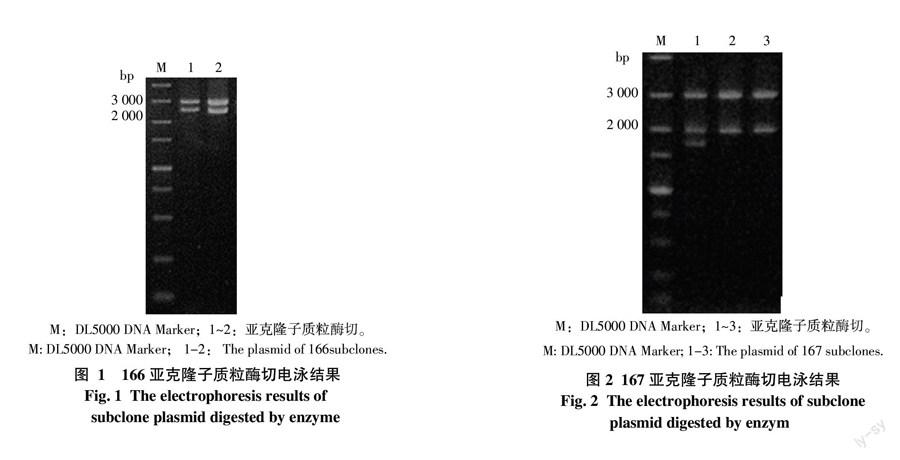
亚克隆子质粒酶切验证结果见图1和图2,电泳结果显示共2条条带,一条为质粒pBluescriptⅡks(+)片段(约3 000 bp),另一条为Tn5(约1 500 bp)插入突变的DNA片段(约2 000~2 500 bp)。测序结果通过NCBI的Blast比对分析,结果表明,这2个突变株的Tn5转座子的插入位置分别位于3 523 353~3 523 372和2 314 449~2 314 456,插入基因分别为Aave-3192和Aave-2108,其中Aave-3192基因NCBI上的注释为Hypothetical protein,Aave-2108基因在NCBI上的注释为Methyl-accepting chemotaxis sensory transducer。
2.2 互补菌株的构建
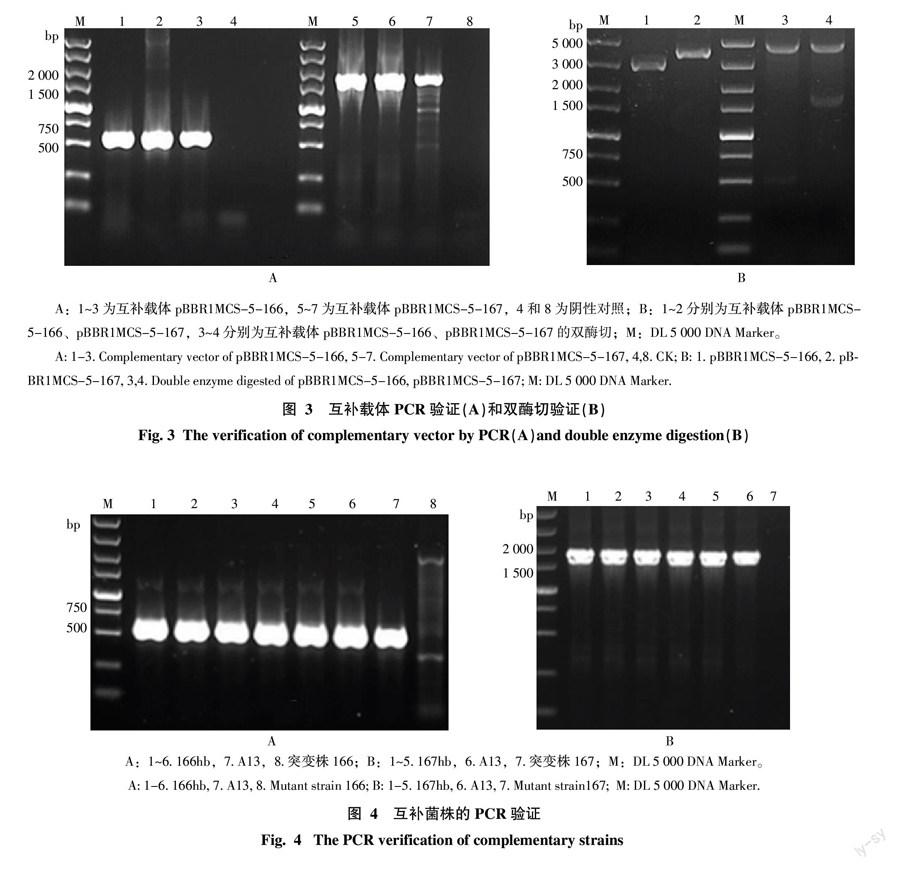
互补载体pBBR1MCS-5-166和pBBR1MCS-5-167克隆子PCR验证(图3-A)分别能够扩增得到与目的基因条带大小一致的片段,分别约为561、1 796 bp;且质粒双酶切验证结果均可获得一条质粒大条带和一条与目的基因片段大小一致的小条带(图3-B,泳道3和4),即获得互补载体pBBR1MCS-5-166和pBBR1MCS-5-167。
三亲杂交转化克隆子互补基因的PCR验证,结果表明所获得的克隆子均可扩增到相应的条带,大小分别为561、1 796 bp(图4)。果斑病菌特异性PCR验证,均得到大小约250 bp的条带(图5),即获得互补菌株166hb和167hb。
2.3 生物学测定
2.3.1 烟草过敏反应 突变菌株166和167在烟草上不能引起过敏反应,互补菌株166hb、167hb和野生菌株A13均能产生烟草过敏反应。
2.3.2 致病性测定 由图6可知,野生菌株和互补菌株均能使西瓜果实致病,突变株无致病性,表明基因互补后菌株的致病性恢复。但甜瓜浸种结果表明互补菌株和突变菌株均无致病性(图7)。
2.3.3 游动性 突变菌株在0.3%的KB培养基上的菌落直径较野生菌株小,而互补后的菌株(166hb和167hb)的菌落直径增大,但均略小于野生菌株A13。
2.3.4 在NA平板上菌落的生长情况 从图8可看出,野生菌A13菌落边缘形成薄而透明的菌裙,突变株166和167菌落无此形态特征,互补菌株166hb和167hb菌落边缘也形成薄而透明的菌裙,但比野生菌株窄。
2.3.5 生物膜 从图9可看出,突变株166和167的生物膜形成能力均强于A13,互补菌株166hb和167hb的生物膜形成能力较突变株下降,其中互补菌株166hb的生物膜形成能力接近于野生菌株。
2.3.6 群体感应 互补菌株166hb和167hb群体感应信号强度较突变体下降,166hb菌株与A13信号强度基本一致。
2.3.7 胞外多糖 由图10可知,每25 mL菌液中A13的胞外多糖产量为0.011 5 g,166为0.007 8 g,167为0.007 9 g,166hb为0.009 2 g,167hb为0.009 0 g。互补菌株的胞外多糖产量均较突变株高,但低于野生菌株。
2.3.8 生长曲线 由图11和图12可看出,突变菌株和互补菌株的生长趋势与野生菌株一致,但生长速度均较野生菌株慢,而突变菌株和互补菌株的生长速度一致。
3 讨论与结论
上述实验结果表明,突变株166和167丧失对西瓜、甜瓜的致病性,不能激发烟草过敏反应,通过亚克隆技术确定插入基因为Aave-3192和Aave-2108,分别编码Hypothetical protein和Methyl-accepting chemotaxis sensory transducer。通过基因互补,获得了突变株的互补菌株166hb和167hb。生物学测定结果表明,互补菌株恢复对西瓜的致病性烟草过敏性反应,表明这2个基因与该病菌的致病性相关;另外,两互补菌株的游动性、生物膜形成能力、群体感应、胞外多糖也部分恢复,说明这2个基因与该病菌的游动性、生物膜、群体感应等生物学有关。现已报道瓜类细菌性果斑病菌存在种内遗传多样性,分属亚群Ⅰ和亚群Ⅱ,亚群Ⅰ的菌株主要分离自甜瓜、南瓜等,亚群Ⅱ的菌株主要分离自西瓜,且亚群Ⅱ的菌株对西瓜幼苗的侵染力明显强于亚群Ⅰ,对甜瓜、南瓜的侵染力弱于亚群Ⅰ[26]。而本研究结果表明,野生菌株对西瓜、甜瓜均有致病性,当基因Aave-3192和Aave-2108的插入突变后使其丧失对西瓜、甜瓜的致病性;但互补实验结果表明,恢复对西瓜的致病性,而不能恢复对甜瓜的致病性。通过PCR扩增实验结果表明,在亚群Ⅰ和亚群Ⅱ菌株中均可扩增到基因Aave-3192,但基因Aave-2108只能在亚群Ⅱ菌株中扩增到而未在亚群Ⅰ菌株中扩增到(实验室数据),由此可推测果斑病菌的这2个基因可能与该病菌的寄主的选择性有关,这有待于进一步验证。
NCBI中基因Aave-3192注释的编码产物为Hypothetical protein,目前尚未发现有关该基因功能的研究报道,本研究结果表明该基因与西瓜噬酸菌的致病性相关,而关于该基因所编码的蛋白性质及其功能有待于进一步研究;而NCBI中基因Aave-2108编码产物为甲基受体趋化感应传感(Methyl-accepting chemotaxis sensory transducer),现已研究表明,铜绿假单胞菌的类甲基受体趋化化学传感器蛋白pilJ直接与菌毛蛋白亚基pilA作用,改变伸展状态下的Ⅳ型菌毛的构象,从而改变铜绿假单胞菌的颤动性、调控表面诱导基因的表达和致病性[27]。本研究结果表明,突变株167是由于Tn5插入果斑病菌的Aave-2108基因(编码产物为甲基受体趋化感应传感器)而导致其丧失对西瓜、甜瓜的致病性,但其具体是通过什么途径使其丧失致病性,是否与上述报道一致等均有待于进一步研究。
参考文献
[1] Schaad N W, Postnikova E, Sechler A, et al. Reclassification of subspecies of Acidovorax avenae as A. avenae(Manns 1905)emend., A. cattleyae(Pavarino, 1911) comb. nov. A. citrulli(Schaad et al. 1978) comb. nov. and proposal of A. oryzae sp. nov.[J]. Systematic and Applied Microbiology, 2008, 31(6-8): 434-446.
[2] Johnson K L, Minsavage G V, Walcott R R. Effect of typeⅢ and typeⅡ secretion on Acidovorax avenae subsp. citrulli colonization of watermelon seed and seedling tissue[J]. Phytopathology, 2009, 99(6): S59.
[3] 宋治国. 甜瓜细菌性果斑病菌Ha17A致病相关基因的克隆[D]. 北京: 中国农业大学, 2007.
[4] 任争光, 侯 磊, 宋治国,等. 甜瓜细菌性果斑病菌致病性突变体筛选与hrcR基因的克隆[J]. 植物病理学报, 2009, 39(5):501-506.
[5] 严婉荣, 王铁霖, 杨玉文,等. 瓜类细菌性果斑病菌hrcN基因的生物学功能分析[J]. 植物病理学报, 2015, 45(1): 33-40.
[6] 汪 新, 王 卫, 钱国良,等. 瓜类细菌性果斑病菌过敏性反应和致病性(hrp)基因簇部分基因的克隆及功能分析[J]. 农业生物技术学报, 2011, 19(1): 36-44.
[7] Bahar O, Goffer T, Burdman S. Type IV pili are required for virulence, twitching motility, and biofilm formation of Acidovorax avenae subsp. citrulli[J]. The American Phytopathological society,2009, 22(8): 909-920.
[8] 王敏鑫,武 珍,邱晓静,等. 西瓜嗜酸菌Ⅳ型菌毛相关基因pilO及pilQ的功能分析[J]. 农业生物技术学报, 2013, 21(6):716-724.
[9] 王健超, 王敏鑫, 代园凤, 等. 西瓜噬酸菌pilN基因功能分析[J]. 南京农业大学学报, 2013, 36(2): 51-57.
[10] Liu H, Tian W, Ibrahim M, et al. Characterization of pilP, a gene required for twitching motility, pathogenicity, and biofilm formation of Acidovorax avenae subsp. avenae RS-1[J]. European Journal of Plant Pathology, 2012, 134(3): 551-560.
[11] Tian Y, Zhao Y, Wu X, et al. The type VI protein secretion system contributes to biofilm formation and seed-to-seedling transmission of Acidovorax citrulli on melon[J]. Molecular Plant Pathology, 2015, 16(1): 38-47.
[12] Hida A, Oku S, Kawasaki T, et al. Identification of the mcpA and mcpM genes, encoding Methyl-Accepting proteins involved in amino acid and l-Malate chemotaxis,and involvement of McpM-mediated chemotaxis in plant infection by Ralstonia pseudosolanacearum(formerly Ralstonia solanacearum phylotypes Ⅰand Ⅲ)[J]. Applied and Environmental Microbiology,2015, 81(21): 7 420-7 430.
[13] 方中达. 植病研究方法(3版)[M]. 北京: 中国农业出版社,1998: 63-65.
[14] 刘 鹏,赵廷昌. 哈密瓜细菌性果斑病菌群体感应系统的检测[J]. 植物保护, 2009, 35(6): 43-46.
[15] Song W Y, Kim H M, Schaad N W. PCR primers for detection and indentification of plant pathogenic species、subspecies and strains of Acidovorax[P]. US Patent:6423499B1, 2000.
[16] 萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 北京: 科学出版社, 2005.
[17] Kessler B, de Lorenzo V, Timmis K N. A general system to integrate lacZ fusions into the chromosomes of gram-negative eubacteria: regulation of the Pm promoter of the TOL plasmid studied with all controlling elements in monocopy[J]. Molecular & General Genetics, 1992, 233(1-2): 293-301.
[18] 蔡学清, 鄢凤娇, 林 玉,等. 西瓜细菌性果斑病拮抗内生细菌的分离和筛选[J]. 福建农林大学学报(自然科学版), 2009, 38(5): 465-470.
[19] 李明明, 申初成, 雷庆斌,等. 细菌性果斑病菌源与接菌方法对西瓜致病力的影响[J]. 湖南农业科学, 2010, 40(15): 80-82.
[20] Chesnokova O, Coutinho J B, Khan I H, et al. Characterization of flagella genes of Agrobacterium tumefaciens, and the effect of a bald strain on virulence[J]. Molecular Microbiology, 1997, 23(3): 579-590.
[21] 孙 蕾. 水稻白叶枯病菌群体感应信号DSF和c-di-GMP系统中重要基因的鉴定和功能分析[D]. 北京: 中国农业科学院, 2009.
[22] 任欣正. 植物病原细菌的分类和鉴定[M]. 北京:农业出版社,1992: 29-39.
[23] 严婉荣. 瓜类细菌性果斑病菌hrcN基因的克隆及功能分析[D]. 长沙:湖南农业大学,2012.
[24] George A, O'Toole, Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple,convergent signalling pathways: a genetic analysis[J]. Molecular Microbiology,1998,28(3):449-461.
[25]He Y, Ng A Y, Xu M, et al. Xanthomonas campestris cell-cell communication involves a putative nucleotide receptor protein Clp and a hierarchical signalling network[J]. Molecular Microbiology, 2007, 64(2): 281-292.
[26] Yan S, Yang Y, Wang T, et al. Genetic diversity analysis of Acidovorax citrulli in China[J]. European Journal of Plant Pathology, 2013, 136(1): 171-181.
[27] Persat A, Inclan Y F, Engel J N, et al. Type IV pili mechanochemically regulate virulence factors in Pseudomonas aeruginosa[J]. Proceedings of the National Academy of Sciences, 2015, 112(24): 7 563-7 568.

