我国耐喹诺酮类嗜水气单胞菌毒力基因及耐药基因检出情况的系统评价
牛志伟 吕小丽 范华龙 梁静真 蒙兰丽 韩书煜 黄钧


摘要:【目的】了解我國耐喹诺酮类致病性嗜水气单胞菌主要毒力基因及引起耐药基因的突变情况,为致病性嗜水气单胞菌的防治及毒力基因和耐喹诺酮类药物机制的研究提供参考依据。【方法】通过计算机检索中国知网(CNKI)数据库、万方数据库、维普(VIP)中文科技期刊数据库、读秀知识库等,检索时限均从建库至2016年4月,查找收集有关嗜水气单胞菌对喹诺酮类药物耐药机制研究及其毒力基因、致病机理的相关文献,采用Cochrane协作网发布的RevMan 5.3进行常规Meta分析,以加拿大卫生药品技术总署编写的ITC软件进行间接比较Meta分析。【结果】最终纳入31篇文献,其中有19篇检测了致病菌株的毒力基因,含457株菌株;11篇检测了致病菌株的耐药基因,共101株菌株;8篇检测了耐药菌株的耐药基因突变位点,共88株菌株。我国致病性嗜水气单胞菌毒力基因的检出率为:astA基因91.30%、altA基因80.42%、aerA基因72.77%、hlyA基因66.85%、actA基因62.13%、ahpA基因56.18%、ahaI基因53.04%。淮河以北地区主要以hlyA基因为主,检出率(67.31%)显著高于淮河以南地区(P<0.05,下同),且高于全国平均检出率;淮河以南地区主要以actA基因为主,检出率(93.59%)显著高于淮河以北地区,也高于全国平均检出率。质粒介导的耐药基因检出率为:qnrB基因50.00%、qepA基因32.00%、qnrS基因27.91%、qnrA基因6.98%、qnrC和qnrD基因未检出。gyrA83位点单突变检出率显著高于gyrA83、parC87双位点突变检出率[OR=0.49,95% CI(0.08, 3.09),P=0.008]。【结论】我国致病性嗜水气单胞菌的分子检测方法为:淮河以南地区以毒力基因actA和aerA为致病性强的判断标准,淮河以北地区以毒力基因hlyA和aerA为致病性强的判断标准。目前我国耐喹诺酮类嗜水气单胞菌的基因突变位点主要是gyrA83单位点突变和gyrA83、parC87双位点突变。
关键词: 嗜水气单胞菌;毒力基因;耐药基因;Meta分析
中图分类号: S941.42 文献标志码:A 文章编号:2095-1191(2016)09-1587-09
Abstract:【Objective】The detection situation of main virulence genes in quinolones-resistant pathogenic Aeromonas hydrophila and resulting mutation of drug-resistant gene and in China, in order to provide reference for study on control of A. hydrophila and its virulence genes and quinolone-resistant molecular mechanisms. 【Method】The reports on quinolones-resistant molecular mechanisms, virulence genes and pathogenesis of A. hydrophila was collected by computer-based online search of CNKI, WANFANG DATA, VIP in Chinese science and technology periodical database and Duxiu Knowledge Base(from setting-up database to April 2016). Then Meta analysis was performed by Review Manager 5.3 published by Cochrane Collaboration network, and indirect comparative Meta analysis was performed by ITC published by Canadian Health Pharmaceutical Technology Agency. 【Result】A total of 31 literatures were included, 19 of which detected virulence genes of pathogenic strains(457 strains), 11 of which detected drug-resistant genes of pathogenic strains(101 strains), 811 of which detected mutational site of drug-resistant gene in drug-resistant strains(88 strains). The detection rates of virulence genes of pathogenic A. hydrophila in China were as follows: astA 91.30%, altA 80.42%, aerA 72.77%, hlyA 66.85%, actA 62.13%, ahpA 56.18%, ahaI 53.04%. North of the Huaihe River was dominated by hlyA gene, with detection rates of 67.31%, and significantly higher than the south of Huaihe River(P<0.05, the same below), and higher than the national average detection rate. South of the Huaihe River was dominated by actA gene, with detection rate of 93.59%, and significantly higher than north of the Huaihe River area, and higher than the national average detection rate too. The detection rates of plasmid-mediated drug-resistant genes of pathogenic A. hydrophila in China were as follows: qnrB 50.00%, qepA 32.00%, qnrS 27.91%, qnrA 6.98%, but qnrC and qnrD were undetected. The detection rate of single site mutation of gyrA83 site was significantly higher than that of double sites mutations of gyrA83 and parC87[OR=0.49, 95% CI(0.08, 3.09), P=0.008]. 【Conclusion】The detection method of pathogenic A. hydrophila in China: actA and aerA are taken as judgment standard of strong pathogenicity in south of the Huaihe River; hlyA and aerA are taken as judgment standard of strong pathogenicity in north of the Huaihe River. At present, mutational site of gene is mainly gyrA83 single site mutation and gyrA83, parC87 double sites mutations in quinolones-resistant A. hydrophila in China.
Key words: Aeromonas hydrophila; virulence gene; drug-resistant gene; Meta analysis
0 引言
【研究意义】嗜水气单胞菌(Aeromonas hydrophila)隶属于气单胞菌科(Aermonadaceae)气单胞菌属(Aeromonas),广泛存在于各种水体中,是严重危害水产养殖动物健康的致病菌之一,每年给水产养殖业造成巨大的经济损失。因此,从分子水平上系统评价嗜水气单胞菌毒力基因分布及相关耐药机制的研究情况,对全面系统地掌握该菌的致病和耐药特点及降低其对水产养殖造成的经济损失均具有重要意义。【前人研究进展】至今,国内外学者已对嗜水气单胞菌的致病机理和耐药机制进行了大量研究,主要包括毒力基因检测及其与致病力的关系、耐药基因及其突变位点的研究,并证实嗜水气单胞菌的致病力与毒力基因密切相关。方兵(2005)应用多重PCR确定毒力基因altA、ahai、hlyA是15株气单胞菌的主要毒力基因型;胡靖(2006)研究发现,不同来源嗜水气单胞菌毒力基因的分布和致病性的差别可能是受菌体多种条件综合作用所致;朱大玲等(2006)通过比较基因检测的结果与嗜水气单胞菌对鲫鱼的致病性,发现ahpA阳性嗜水气单胞菌皆为毒力菌株,且aerA与ahpA基因存在相关性;付乔芳(2011)通过比较嗜水气单胞菌毒力基因的分布情况及其对异育银鲫的致病性,发现aerA、ahpA基因为嗜水气单胞菌致病的主要毒力因子,与致病性存在相关性,astA基因与其致病力也存在一定相关性,但不是主要毒力因子。嗜水气单胞菌的耐药机制主要在于耐药基因的存在及质粒介导耐药喹诺酮类药物作用靶位的改变。Giraud等(2004)、Alcaide等(2010)、Han等(2012)研究发现,耐喹诺酮类不同种的气单胞菌主要是gyrA基因编码的第83位氨基酸发生Ser→Ile突变,也有部分是第83位氨基酸发生Ser→Arg、Val或Asn突变,同时存在第92、174、202和203位氨基酸位点突变。王晓丰等(2010)研究表明,大多数耐喹诺酮菌株的靶位基因QRDR区域有突变发生,但药物靶位的变化并非氟喹诺酮类耐药菌株唯一的抗性机制。薛慧娟等(2012)以PCR扩增耐喹诺酮嗜水气单胞菌的靶基因gyrA和parC,发现耐药嗜水气单胞菌QRDR区域的突变具有随机性,但靶位点gyrA的83Ser→Ile及parC的87Ser→Ile是最主要的突变方式;此外,喹诺酮类耐药性的产生可能与其他耐药机制存在关联。谭爱萍等(2014)通过对龟鳖源气单胞菌耐药性的分析,发现喹诺酮药物耐药机制复杂,PMQR通常仅导致喹诺酮类低水平的耐药,但PMQR基因的存在可促进细菌染色体QRDR变异,从而导致具有稳定遗传性的高水平耐药性产生。【本研究切入点】目前,虽然对嗜水气单胞菌致病性与毒力基因的关系及耐药性与耐药基因突变已有一定了解,但针对致病性嗜水气单胞菌毒力基因和耐药基因的系统评价尚无报道。Meta分析是对多个相同研究结果进行合并汇总的分析方法,可从统计学角度达到增大样本量,从而提高检验效能的目的,尤其当多个研究结果不一致时,采用Meta分析可得到更加接近真实情况的综合分析结果,同时能克服叙述性综述的片面性和主观性等缺点。Meta分析已广泛应用于环境科学(时鹏等,2012)、心理学(刘霞等,2013)、人类医学(梁锦枝等,2013)、经济学(彭俞超和顾雷雷,2014)、畜牧兽医科学(杨健等,2016)等领域,但在水产科学领域尚无相关报道。【拟解决的关键问题】基于Meta分析对近年来我国关于嗜水气单胞菌毒力基因及耐喹诺酮类嗜水气单胞菌耐药机制的相关文献进行系统评价,了解我国耐喹诺酮类致病性嗜水气单胞菌主要毒力基因及引起耐药基因的突变情况,为致病性嗜水气单胞菌的防治及毒力基因和耐喹诺酮类药物机制的研究提供参考依据。
1 材料与方法
1. 1 纳入与排除标准
1. 1. 1 研究类型 所有检测耐喹诺酮类致病性嗜水气单胞菌相关毒力基因和以敏感菌株或标准菌株作为对照检测耐药基因及其突变的试验,语言限定为中文。
1. 1. 2 研究对象 经药敏试验发现的耐喹诺酮类嗜水气单胞菌(包括人工诱导产生的)及敏感菌。
1. 1. 3 干预措施 试验组和对照组均通过PCR检测嗜水气单胞菌耐药基因及毒力基因。
1. 1. 4 结局指标 检测出的毒力基因和耐药基因。
1. 1. 5 排除标准 数据不详或无法运用的研究,具体包括:①未进行药敏试验或攻毒试验的研究;②检测方法不可靠和未使用PCR检测毒力基因;③综述文献、重复检出或发表及只有摘要的会议文献;④只检测耐药基因,未进行突变位点突变的研究;⑤只进行药敏鉴定未检测耐药基因的研究、理论探讨的研究或报道;⑥研究菌株不是来自水生动物(水体,陆生动物)的研究;⑦同一作者或在实验室的人员在相同年度发表的相似研究;⑧试验菌株总数小于2株的研究。
1. 2 检索策略
计算机检索中国知网(CNKI)数据库、万方数据库、维普(VIP)中文科技期刊数据库、读秀知识库等,检索时限均为建库至2016年4月。以嗜水气单胞菌、喹诺酮类耐药性和毒力基因作为检索词,在上述数据库进行检索,并追溯纳入文献的中文参考文献。
1. 3 文献筛选与资料提取
提取内容包括:作者、年份、菌株来源、菌株数量、毒力基因、耐药基因、突变位点、主动外排系统及对照组(敏感菌株或标准菌株)等,数据不详则联系作者索要数据或在相关信息處填写不详。由两名评价人员按上述标准,对纳入的相关文献独立进行评价和提取相关数据,然后交叉核对,遇到分歧则讨论解决。
1. 4 统计分析
检出数据采用比值比(OR)及其95% CI作为检出统计量,采用χ2对文献进行异质性检验,P≥0.10且I2≤50%时,采用固定效应模型进行统计分析;反之,使用随机效应模型进行统计分析。采用RevMan 5.3进行常规Meta分析,以加拿大卫生药品技术总署编写的ITC软件进行间接比较Meta分析;率的比较采用χ2检验,检验水准为α=0.05,采用SPSS 18.0进行统计分析。
2 结果与分析
2. 1 文献检索结果
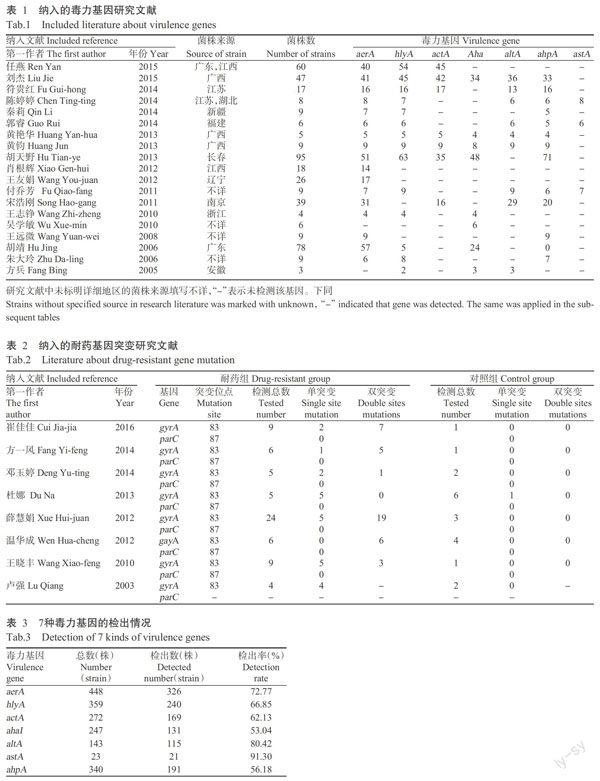
共检出耐喹诺酮类嗜水气单胞菌毒力基因、耐药基因相关文章312篇,经逐层筛选后,最终纳入31篇,其中有19篇检测了致病菌株的毒力基因,含457株菌株(表1);11篇检测了致病菌株的耐药基因,含101株菌株;8篇检测了耐药菌株的耐药基因突变位点,含88株菌株(表2)。由于不同文献对相同毒力基因的缩写不同,为了便于统计,本研究以毒力基因英文缩写+嗜水气单胞菌英文首字母作为该毒力基因的引文缩写(altA、aerA、hlyA、actA和ahpA),若毒力基因缩写结尾为字母A,则用嗜水气单胞菌缩写ah+毒力基因英文缩写作为嗜水气单胞菌相关毒力因子缩写(ahpA)。文献筛选流程及结果见图1。
2. 2 毒力基因的检出情况
由表3可知,我国致病性嗜水气单胞菌毒力基因astA、altA、aerA、hlyA、actA、ahpA、ahaI检出率均大于50.00%,分别为91.39%、80.42%、72.77%、66.85%、62.13%、56.18%和53.04%。其中以astA基因最高,altA和aerA基因次之。取单一地区来源且文献数目大于1篇的菌株进行南北地区(以气候特点划分地区)相关毒力基因检出率差异统计,结果显示,aerA、hlyA、actA和ahpA 4种毒力基因在淮河以北地区主要以hlyA基因为主,检出率(67.31%)高于淮河以南地区(表4),其差异具有统计学意义(P<0.05,下同),且高于全国平均检出率;而淮河以南主要以actA基因为主(93.59%),高于淮河以北地区,其差异具有统计学意义,也高于全国平均检出率。aerA基因检出率在淮河以南和淮河以北均位于第二,且淮河以南地区高于淮河以北地区,其差异具有统计学意义;淮河以北地区的ahpA基因检出率高于淮河以南地区,但其差异不具统计学意义(P>0.05)。
2. 3 耐药基因、主动外排泵、整合子耐药基因突变的检测结果
质粒介导的耐药基因主要是qnra、qnrB、qnrC、qnrD、qnrS、qnrR和qepA,但仅有4篇纳入文献(王小亮等,2013;方一风等,2014;乔毅,2015;张明辉等,2016)检测了质粒介导的耐药基因,而且没有一篇文献将上述所有基因完全检测,合并后的检出率分别为qnrB基因50.00%、 qepA基因32.00%、qnrS基因27.91%、qnrA基因6.98%,qnrC和qnrD基因未检出。即由质粒介导嗜水气单胞菌产生耐药的主要耐药基因是qnrB、qepA和qnrS(表5)。
有3篇纳入文献采用外排泵抑制剂羰基氰化氯苯腙(CCCP)诱导嗜水气单胞菌对喹诺酮类药物的MIC变化进行功能性主动外排检测。其中,杜娜(2013)通过观察CCCP诱导嗜水气单胞菌耐药株对左氧氟沙星的MIC变化进行功能性主动外排检测,结果发现喹诺酮耐药性的产生与外排泵机制相关;邓玉婷等(2014)通过对比CCCP诱导嗜水气单胞菌对恩诺沙星、诺氟沙星、氧氟沙星、洛美沙星4种喹诺酮类药物的MIC变化进行功能性主动外排检测,结果表明随着用药压力的逐渐增加,外排作用协同突变机制,进一步增加菌株对喹诺酮类药物的耐药性,说明耐喹诺酮类嗜水气单胞菌存在靶基因突变和主动外排作用等多种耐药机制;方一风等(2014)通过加入CCCP观察嗜水气单胞菌对恩诺沙星的MIC变化进行功能性主动外排检测,并检测外排泵相关基因qepA、oqxA和mdfA,结果显示主动外排泵机制只是个别菌株存在的耐药机制。
有2篇纳入文献对整合子进行了检测。肖根辉(2012)从临床分离获得的嗜水气单胞菌中证实了Ⅰ类和Ⅱ类整合子的存在,两种整合子的检出率分别为33.3%和88.9%。李绍戊等(2013)的研究结果表明,含有Ⅰ类、Ⅱ类整合子的嗜水气单胞菌菌株耐药率明显高于不含整合子的阴性菌株,且整合子的存在会影响其对氟喹诺酮类药物的耐药性。
目前,关于嗜水气单胞菌对喹诺酮类耐药的基因突变主要是gyrA和parC相关位点的研究。本研究共纳入7篇文献进行耐喹诺酮类嗜水气单胞菌与对照组(敏感菌/标准株)单gyrA基因突变检出情况的Meta分析,异质性检测提示各研究间无异质性(P=0.60,I2=0%),可采用固定效应模型进行Meta分析,结果表明,耐喹诺酮类嗜水气单胞菌gyrA83位点单突变检出率明显高于对照组[OR=4.45,95% CI(1.29,15.34),P=0.02],其差异具有统计学意义(图2)。由于parC87位点突变均是联合gyrA83位点一起突变,无单独突变,因此未进行Meta分析。纳入6篇文献进行gyrA83位点和parC87位点双突变检出率的Meta分析,异质性检测提示各研究间无异质性(P=0.59,I2=0%),可采用固定模型进行Meta分析,结果表明,耐药组的gyrA83位点和parC87位点双突变检出率明显高于对照组[OR=
9.10,95% CI(2.32,35.76),P=0.002],其差异具有统计学意义(图3)。将上述7篇纳入文献的gyrA83位点单突变和6篇纳入文献的gyrA83、parC87双位点突变用ITC软件进行间接Meta分析,发现目前gyrA83位点单突变检出率显著高于gyrA83、parC87双位点突变检出率[OR=0.49,95% CI(0.08,3.09),P=0.008],其差异具有统计学意义。
3 讨论
嗜水气单胞菌的致病过程一般可分为黏附、入侵、定植、增殖、分泌毒素或摄取宿主养分、养料等过程(Maji et al.,2006;邱军强等,2009)。毒力因子是通过调节自身相应的毒力基因来适应和满足其功能需求,如胞外蛋白酶是在嗜水气单胞菌的入侵过程中发挥重要作用。根据Ascencio和Wadstrom(1991)的相关研究结果可知,胞外蛋白酶能直接作用于宿主的相关器官组织,造成靶器官组织溶解或坏死,以利于病原菌入侵宿主和摄取营养物质。嗜水气单胞菌的胞外蛋白酶有较强的免疫原性,且具有独立的致病作用,由其引起的症状与菌体引起的败血症相似,在细菌对宿主组织的黏附、细菌在体内的增殖及逃避宿主的免疫应答等过程中发挥重要作用(Buchley and Howerd,1999)。嗜水气单胞菌分泌的外毒素主要以无活性的前体形式存在,在发挥生物学活性前须由蛋白酶将其C末端的蛋白进行降解(Chac n et al.,2003)。热稳定金属蛋白酶(altA)可直接致使机体发病,而热敏感丝氨酸蛋白酶(ahpA)不能直接使机体致病,但有促进其他致病因子分泌和活化外毒素前体蛋白的作用,对致病性也有重要影响(李槿年等,2000;夏昆華等,2004)。本研究的统计结果显示,热敏感抗金属蛋白酶基因(astA)的检出率为91.30%,高于其他6种毒力基因,进一步证实当前嗜水气单胞菌入侵宿主和活化外毒素前体蛋白的主要胞外蛋白是astA,而ahpA的作用次之。嗜水气单胞菌入侵水生动物的重要部位是鳃和皮肤,定植和繁殖的主要部位则是肠道(陈婷婷,2014)。动物被大量致病性嗜水气单胞菌感染时,肠道内的肠毒素含量会急速上升,且与细胞发生不可逆的结合,使体液损失严重,最终导致宿主死亡(方一风等,2014)。本研究对热敏感细胞肠毒素基因(altA)检出率的统计结果显示该基因的平均检出率为80.42%,也间接证实嗜水气单胞菌在肠道定植和繁殖时的过程中altA发挥了主要作用。
刘杰等(2015)用致病性嗜水气单胞菌对黄沙鳖进行攻毒,结果发现hly+Aer+Alt+Act+ahal-ahp+型菌株对黄沙鳖的平均致死率为95.00%,hly+Aer+Alt-Act+ahal+ahp-型菌株的平均致死率为70.56%,hly+Aer-Alt+Act+ahal- ahp+型菌株的平均致死率為60.00%。在自然情况下,致病性嗜水气单胞菌不依靠黏附素也可侵入宿主,引起病征,结合本研究对ahaI基因检出率的统计结果,可推测黏附素不是唯一为致病性嗜水气单胞菌提供黏附作用的因子,可能还存在其他未知的细菌黏附因子。astA可破坏宿主组织获取营养,并入侵宿主或定植而引起致病,本研究的统计结果显示其检出率最高,达91.30%,因此推测当宿主受伤时,毒力基因astA发挥主要作用而促使嗜水气单胞菌夺取营养,加快其入侵动物机体;或直接依靠环境提供的条件长期与宿主接触,并分泌毒素破坏宿主进而侵入,依靠趋化性向其他被毒素破坏掉的组织移动,引起宿主损伤范围扩大。这可能是嗜水气单胞菌的侵染机制具有多样性,随着环境和宿主的不同,致病菌相应选择不同的侵染机制,具体原理有待进一步研究确认。
现有文献中对嗜水气单胞菌主要毒力基因的认定也存在差异。朱大玲等(2006)认为对嗜水气单胞菌致病力影响最大的毒力基因是aerA和hlyA;付乔芳(2011)认为aerA和ahpA是对菌株致病力影响最大的毒力基因,而altA、hlyA基因与致病性无明显相关性;陈婷婷(2014)认为aerA、ahpA和hlyA基因对嗜水气单胞菌的致病性影响显著,而altA、astA基因对菌株的致病力影响较小;刘杰等(2015)将hlyA基因作为有毒嗜水气单胞菌菌株的鉴定标准,认为携带hlyA和actA基因,且同时携带有aerA、altA、ahal和ahpA 4种毒力基因中的2种或2种以上的嗜水气单胞菌为强毒株。可见,致病性嗜水气单胞菌的毒力主要与其携带和分泌出的各种致病因子密切相关。结合各毒力基因的功能及本研究对7种毒力基因检出率(均大于50.00%)的统计结果可知,嗜水气单胞菌在遇到不同的环境和宿主时,其菌体为了更好地生长繁殖,会选择性表达自身携带的毒力基因,通过调控基因表达量而侵入宿主并夺取营养。因此,本研究依据致病特点将毒力基因分为三大类,第Ⅰ类为细菌侵入宿主的主要基因,第Ⅱ类为可引起宿主死亡的主要毒力基因,第Ⅲ类为协助细菌入侵、激活外毒素蛋白前体等协助性毒力基因。其中,ahaI基因属于第Ⅰ类毒力基因,aerA、hlyA、actA和altA基因属于第Ⅱ类毒力基因,astA和ahpA基因属于第Ⅲ类毒力基因。
拓扑异构酶Ⅱ(或称DNA促旋酶)和拓扑异构酶Ⅳ均是喹诺酮类的作用靶点,前者由gyrA和gyrB组成,后者由parC和parE组成。喹诺酮类药物在细菌体内能选择性抑制在DNA合成过程中的拓扑异构酶Ⅱ和拓扑异构酶Ⅳ,从而干扰细菌DNA复制、转录及修复重组,达到杀灭细菌的效果(徐元宏和沈韶辉,2001)。郑伟等(2004)研究发现,gyrA、gyrB、parC和parE基因均有可能发生耐药相关突变,但以gyrA和parC基因出现突变最常见。结合本研究纳入的相关文献,发现目前针对基因变异产生耐药的研究主要是gyrA83位点和parC87位点突变,但有关基因突变引起耐药的主要突变位点有待进一步探究。本研究采用Meta分析将gyrA83位点单突变与对照组(对喹诺酮类敏感菌株或标准菌株)进行比较,发现耐药组的gyrA83位单突变显著高于对照组;将parC87位点单突变与对照组(对喹诺酮类敏感菌株或标准菌株)进行比较,也发现耐药组的parC87位点单突变显著高于对照组。同时对6篇纳入文献进行gyrA83和parC87位点双突变的检出率进行Meta分析,结果表明,耐药组的gyrA83和parC87位点双突变检出率明显高于对照组;而将上述7篇纳入文献的gyrA83位点单突变与6篇纳入文献的gyrA83、parC87双位点突变进行间接Meta分析,结果显示目前gyrA83位点单突变检出率显著高于gyrA83、parC87双位点突变检出率,说明国内喹诺酮类作用靶点的改变主要是由gyrA83位点单突变和gyrA83、parC87双位点突变所引起。
4 结论
我国致病性嗜水气单胞菌的分子检测方法为:淮河以南地区以毒力基因actA和aerA为致病性强的判断标准,淮河以北地区以毒力基因hlyA和aerA为致病性强的判断标准。目前我国耐喹诺酮类嗜水气单胞菌的基因突变位点主要是gyrA83单位点突变和gyrA83、parC87双位点突变。
参考文献:
陈婷婷. 2014. 团头鲂源嗜水气单胞菌流行病调查及致病性、耐药性研究[D]. 武汉:华中农业大学.
Chen T T. 2014. The study of the epidemiology investigation and pathogenicity,drug-resistance characteristics of Aeromonas hydrophila isolated from Megalobrama amblycephala[D]. Wuhan:Huazhong Agricultural University.
崔佳佳,王荻,卢彤岩,李绍戊. 2016. 养殖鱼源嗜水气单胞菌对氟喹诺酮类药物的耐药机制[J]. 水产学报,40(3):495-502.
Cui J J,Wang D,Lu T Y,Li S W. 2016. In vitro study on fluoroquinolone resistance mechanism of Aeromonas hydrophila from cultured fish[J]. Journal of Fisheries of China,40(3):495-502.
邓玉婷,薛慧娟,姜兰,谭爱萍,吴雅丽,王伟利,罗理,赵飞. 2014. 体外诱导嗜水气单胞菌对喹诺酮类耐药及其耐药机制研究[J]. 华南农业大学学报,35(1):12-16.
Deng Y T,Xue H J,Jiang L,Tan A P,Wu Y L,Wang W L,Luo L,Zhao F. 2014. Characterization of quinolone resistance mechanism of Aeromonas hydrophila selected in vitro[J]. Journal of South China Agricultural University,35(1):12-16.
杜娜. 2013. 嗜水气单胞菌耐药性分析及气溶素抗血清的免疫保护性研究[D]. 武汉:华中农业大学.
Du N. 2013. Drug-resistance analysis of Aeromonas hydrophila and study on immunoprotecive of antiserum of aerolysin [D]. Wuhan:Huazhong Agricultural University.
方兵. 2005. 气单胞菌安徽分离株的鉴定、毒力基因检测及其序列分析[D]. 合肥:安徽农业大学.
Fang B. 2005. Identification, virulence gene detection and its sequence analysis for Aeromonas isolated from Anhui[D]. Hefei:Anhui Agricultural University.
方一风,潘晓艺,蔺凌云,沈锦玉,尹文林,姚嘉赟,郝贵杰,徐洋. 2014. 嗜水气单胞菌对喹诺酮类药物耐药的分子机制[J]. 微生物学报,54(2):174-182.
Fang Y F,Pan X Y,Lin L Y,Shen J Y,Yin W L,Yao J Y,Hao G J,Xu Y. 2014. Molecular mechanisms of quinolone resistance in Aeromonas hydrophilia[J]. Acta Microbiologica Sinica,54(2):174-182.
符贵红,肖丹,胡鲲,杨先乐. 2014. 鲫源嗜水气单胞菌毒力基因多重PCR检测及ERIC-PCR分子分型[J]. 海洋渔业,36(6):549-556.
Fu G H,Xiao D,Hu K,Yang X L. 2014. Multiplex PCR and ERIC-PCR genotype in virulence genes of Aeromonas hydrophila in crucian carp[J]. Marine Fisheries,36(6):549-556.
付乔芳. 2011. 嗜水气单胞菌毒力特性研究[D]. 上海:上海海洋大学.
Fu Q F. 2011. The virulence of the Aeromonas hydrophila[D]. Shanghai:Shanghai Ocean University.
郭睿,刘年锋,江小斌,张善霹,王伟,郑晨晖,杨小强. 2014. 6株鱼源嗜水气单胞菌的分子鉴定与毒力基因分析检测[J]. 福建水产,36(2):87-95.
Guo R,Liu N F,Jiang X B,Zhang S P,Wang W,Zheng C H,Yang X Q. 2014. Molecular characterization of six strains of Aeromonas hydrophila isolated from fish as well as detection and analysis of virulence genes[J]. Journal of Fujian Fisheries,36(2):87-95.
胡靖. 2006. 气单胞菌的毒力基因及其表达的影响因素研究[D]. 南昌:南昌大學.
Hu J. 2006. The study on the virulence genes and the effect of environmental factors on the expressions of these genes in Aeromonas spp.[D]. Nanchang:Nanchang University.
胡天野. 2013. 健康乌鳢体内两种气单胞菌的分离、鉴定及其毒力基因检测[D]. 长春:吉林农业大学.
Hu T Y. 2013. Isolation,identification and virulence genes detection of two kinds of Aeromonas isolated from healthy Channa argus[D]. Changchun:Jilin Agricultural University.
黄钧,黄艳华,胡大胜,罗华平,施金谷,彭民毅,禤均成,覃丽芬,滕忠作,曾桂忠. 2013. 黄沙鳖白底板病病原菌的分离鉴定及6种毒力基因检测[J]. 水生生物学报,37(5):844-854.
Huang J,Huang Y H,Hu D S,Luo H P,Shi J G,Peng M Y,Xuan J C,Qin L F,Teng Z Z,Zeng G Z. 2013. Characterization of white plastron disease pathogens and detection of six known virulence genes in Truogx sinensis[J]. Acta Hydrobiologica Sinica,37(5):844-854.
黄艳华,黄钧,胡大胜,施金谷,彭民毅,彭亚. 2013. 黄沙鳖红底板病病原菌的分离鉴定及其毒力基因检测[J]. 西南农业学报,26(5):2116-2121.
Huang Y H,Huang J,Hu D S,Shi J G,Peng M Y,Peng Y. 2013. Isolation,identification and virulence Gene detection of pathogenitic bacteria from Trionyx sinensis with red abdominal shell disease[J]. Southwest China Journal of Agricultural Sciences,26(5):2116-2121.
李槿年,余为一,魏梅芳. 2000. 36株气单胞菌外毒素溶血性和致病性的测定[J]. 中国预防兽医学报,22(2):51-53.
Li J N,Yu W Y,Wei M F. 2000. Characterization of hemolysis and pathogenicity of exotoxin secreted by 36 strains of Aeromonas[J]. Chinese Journal of Preventive Veterinary Medicine,22(2):51-53.
李绍戊,王荻,刘红柏,尹家胜,卢彤岩. 2013. 鱼源嗜水气单胞菌多重耐药菌株整合子的分子特征[J]. 中国水产科学,20(5):1015-1022.
Li S W,Wang D,Liu H B,Yin J S,Lu T Y. 2013. Molecular characterization of integron-gene cassettes in multi-drug resistant Aeromonas hydrophila from fish[J]. Journal of Fi-
shery Sciences of China,20(5):1015-1022.
梁锦枝,罗钦宏,方乙生,古子娟,黄艳琼. 2013. 痰热清注射液治疗手足口病疗效评价的Meta分析[J]. 中国循证医学杂志, 13(12):1446-1454.
Liang J Z,Luo Q H,Fang Y S,Gu Z J,Huang Y Q. 2013. Clinical efficacy on Tanreqing injection for curing hand-foot-mouth disease:A meta-analysis[J]. Chinese Journal of E-
vidence-Based Medicine,13(12):1446-1454.
刘杰,黄艳华,黄钧,胡大胜,梁静真,彭亚,龙苏,牛志伟,韩书煜,植淇业. 2015. 黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J]. 中国水产科学,22(4):698-706.
Liu J,Huang Y H,Huang J,Hu D S,Liang J Z,Peng Y,Long S,Niu Z W,Han S Y,Zhi Q Y. 2015. Studies on the correlation with pathogenicity and virulence genes of Aeromonas hydrophila by Truogx sinensis[J] Journal of Fishery Sciences of China,22(4):698-706.
刘霞,张跃兵,宋爱芹,梁亚军,翟景花,李印龙,石敬芹. 2013. 留守儿童心理健康状况的Meta分析[J]. 中国儿童保健杂志,21(1):68-70.
Liu X,Zhang Y B,Song A Q,Liang Y J,Zhai J H,Li Y L,Shi J Q. 2013. Meta-analysis on mental health of left-behind children[J]. Chinese Journal of Child Health Care,21(1):68-70.
卢强,郑伟,李莲瑞,刘明远,于海彬. 2003. 嗜水气单胞菌喹诺酮类药物抗性决定区基因片段的克隆与突变分析[J]. 吉林农业大学学报,25(1):94-96.
Lu Q,Zheng W,Li L R,Liu M Y,Yu H B. 2003. Cloning and sequence mutation analysis of quinolone resistance determining regions of pathogenic Aeromonas hydrophila[J]. Journal of Jilin Agricultural University,25(1):94-96.
彭俞超,顾雷雷. 2014. 经济学中的Meta回归分析[J]. 经濟学动态,(2):126-131.
Peng Y C,Gu L L, 2014. Meta regression analysis in economics[J]. Economic Perspectives,(2):126-131.
乔毅. 2015. 江苏省沿海地区水产养殖主要致病菌耐药性研究[D]. 上海:上海海洋大学.
Qiao Y. 2015. Study on the major pathogenic bacteria resistance of aquaculture in the coastal regions of Jiangsu province[D]. Shanghai:Shanghai Ocean University.
秦莉. 2014. 白斑狗鱼嗜水气单胞菌败血症病原的分离鉴定及致病性研究[D]. 乌鲁木齐:新疆农业大学.
Qin L. 2014. The Aeromonas hydrophila sepsis pathogen of Nor-
thern Pike(Esox lucius) isolation, identification and pathogenic research[D]. Urumqi:Xinjiang Agricultural University.
邱军强,杨先乐,程训佳. 2009. 嗜水气单胞菌毒力因子特性及作用机理研究进展[J]. 中国病原生物学杂志,4(8):616-619.
Qiu J Q,Yang X L,Cheng X J. 2009. Advances in the characteristics and pathogenic mechanisms of virulence factors in Aeromonas hydrophila[J]. Journal of Pathogen Biology,4(8):616-619.
任燕,孙承文,石存斌,潘厚军,陶家发,吴淑勤. 2015. 嗜水气单胞菌毒力因子检测及不同毒力基因型菌株对剑尾鱼的致病性研究[J]. 广东农业科学,(17):113-117.
Ren Y,Sun C W,Shi C B,Pan H J,Tao J F,Wu S Q. 2015. Detection of virulence genes in Aeromonas hydrophila and the pathogenicity of different genotype isolates to swordtail[J]. Guangdong Agricultural Science,(17):113-117.
时鹏,汪亚峰,陈利顶. 2012. 廊道式工程建设对土壤生态环境影响的meta分析[J]. 生态学杂志,31(8):2029-2037.
Shi P,Wang Y F,Chen L D. 2012. Impacts of linear project construction on soil eco-environment:A meta analysis[J]. Chinese Journal of Ecology,31(8):2029-2037.
宋浩刚,吴亚峰,沈剑强,胡萌,刘永杰,陆承平. 2011. 南京某集贸市场淡水鱼感染嗜水气单胞菌的鉴定及毒力因子检测[J]. 中国兽医科学,41(2):111-115.
Song H G,Wu Y F,Shen J Q,Hu M,Liu Y J,Lu C P. 2011. Identification and detection of factors of Aeromonas hydrophila in freshwater fish from a market in Nanjing[J]. Chinese Veterinary Science,41(2):111-115.
谭爱萍,邓玉婷,姜兰,吴雅丽,冯永永,黄玉萍,罗理,王伟利. 2014. 养殖龟鳖源气单胞菌耐药性与质粒介导喹诺酮类耐药基因分析[J]. 水产学报,38(7):1018-1025.
Tan A P,Deng Y T,Jiang L,Wu Y L,Feng Y Y,Huang Y P,Luo L,Wang W L. 2014. Analysis of antimicrobial susceptibility and plasmid-mediated quinolone resistance genes in Aeromonas isolated from turtles[J]. Journal of Fisheries of China,38(7):1018-1025.
王晓丰,薛晖,丁正峰,杨林. 2010. 嗜水气单胞菌对氟喹诺酮类药物的敏感性及耐药相关基因分析[J]. 江苏农业学报,26(6):1298-1303.
Wang X F,Xue H,Ding Z F,Yang L. 2010. Fluoroquinolone susceptibility and resistance-associated genes in clinical isolates of Aeromonas hydrophila[J]. Jiangsu Journal of Agricultural Sciences,26(6):1298-1303.
王小亮,徐立蒲,曹欢,王静波,王姝. 2013. 鱼源病原菌对氟喹诺酮类药物的耐药性分析[J]. 中国畜牧兽医,40(3):195-199.
Wang X L,Xu L P,Cao H,Wang J B,Wang S. 2013. Analysis of the fluoroquinolone resista of pathogens isolated from fish[J]. Chinese Animal Husbandry and Veterinary Medicine,40(3):195-199.
王友娟,李榮峰,李华,李强,徐祥. 2012. 辽宁地区养殖淡水鱼感染嗜水气单胞菌的流行病学调查[J]. 中国农业科技导报,14(4):128-134.
Wang Y J,Li R F,Li H,Li Q,Xu X. 2012. Molecular epidemiology studies on Aeromonas hydrophila strains isolated from fresh water fish in Liaoning province[J]. Journal of Agricultural Science and Technology,14(4):128-134.
王远微,汤承,于学辉,王英,岳华. 2008. 三重PCR检测鱼类致病性嗜水气单胞菌[J]. 微生物学报,48(7):947-951.
Wang Y W,Tang C,Yu X H,Wang Y,Yue H. 2008. Detecting pathogenic Aeromonas hydrophila in fish by triplex PCR[J]. Acta Microbiologica Sinica,48(7):947-951.
王志铮,赵蓓蓓,王忠发,申屠琰,陈琼娜. 2010. 四株鳖源致病性嗜水气单胞菌(Aeromonas hydrophila)的表型、分子鉴定及其毒力基因检测[J]. 海洋与湖沼,41(5):776-783.
Wang Z Z,Zhao B B,Wang Z F,Shen T Y,Chen Q N. 2010. Phenotype and molecular indentification of virulence genes for four pathogenic Aeromonas hydrophila isolated from a dying Trionyx sinensis[J]. Oceanologia Et Limnologia Sinica,41(5):776-783.
温华成. 2012. 黄颡鱼源嗜水气单胞菌的分离鉴定及对三种氟喹诺酮类药物和氟苯尼考的耐药性研究[D]. 南宁:广西大学.
Wen H C. 2012. The identification and drug-resistance to fluoroquinolone and florfenicol of Aeromonas hydrophila from Pseudobagrus fulvidraco[D]. Nanning:Guangxi University.
吴学敏. 2010. 嗜水气单胞菌主要粘附素基因序列及其重组基因表达产物功能分析[D]. 福州:福建农林大学.
Wu X M. 2010. Analysis the major adhesin gene sequences and its recombinant gene products of Aeromonas hydrophila[D]. Fuzhou:Fujian Agriculture and Forestry University.
夏昆华,周鲁,郝丽芬. 2004. 喹诺酮类抗生素的研究进展[J]. 国外医药抗生素分册,25(3):138-141.
Xia K H,Zhou L,Hao L F. 2004. Research progress of quinolones antibiotics[J]. World Notes on Antibiotics,25(3):138-141.
肖根辉. 2012. 嗜水气单胞菌临床分离株的耐药性与整合子分析[D]. 南昌:江西農业大学.
Xiao G H. 2012. The analysis of the drug resistance and integrons of Aeromonas hydrophila clinical isolated strains[D]. Nanchang:Jiangxi Agricultural University.
徐元宏,沈韶辉. 2001. 气单胞菌基因种分布及溶血性探讨[J]. 安徽医学,22(2):8-11.
Xu Y H, Shen S H. 2001. Distribution and hemolysis from Aeromonas strains to genospecies level[J]. Anhui Medical Journal,22(2):8-11.
薛慧娟,邓玉婷,姜兰,吴雅丽,谭爱萍,王伟利,罗理,赵飞. 2012. 水产动物源嗜水气单胞菌药物敏感性及QRDR基因突变分析[J]. 广东农业科学,(23):149-153.
Xue H J,Deng Y T,Jiang L,Wu Y L,Tan A P,Wang W L,Luo L,Zhao F. 2012. Antimicrobial susceptibility and mutations of QRDR in Aeromonas hydrophila isolated from aquatic animals[J]. Guangdong Agricultural Sciences,(23):149-153.
杨健,严作廷,王东升,张世栋,杨志强,董书伟. 2016. 中药治疗奶牛乳房炎的系统评价与Meta分析[J]. 南方农业学报,47(4):656-663.
Yang J,Yan Z T,Wang D S,Zhang S D,Yang Z Q,Dong S W. 2016. Systematic evaluation and meta-analysis on efficacy of Chinese herbal medicine on cow mastitis[J]. Journal of Southeen Agriculture,47(4):656-663.
张明辉,肖雨,张海强,安伟,高晓华. 2016. 上海地区9株鱼源病原菌的耐药性监测与分析[J]. 水产科技情报,43(1):4-9.
Zhang M H, Xiao Y, Zhang H Q, An W, Gao X H. 2016. Drug resistance monitoring and analysis of nine strains of fish-derived pathogen in Shanghai[J]. Fisheries Science & Technology Information, 43(1): 4-9.
郑伟,卢强,韩文瑜,张雅斌,刘艳辉. 2004. 耐喹诺酮类药物嗜水气单胞菌的分离鉴定及电镜观察[J]. 水产科学,23(4):20-23.
Zheng W,Lu Q,Han W Y,Zhang Y B,Liu Y H. 2004. The identification and observation of Aeromonas hydrophil showing quinolones resistance[J]. Fisheries Science,23(4):20-23.
朱大玲,李爱华,汪建国,李明,蔡桃珍,胡靖. 2006. 嗜水气单胞菌毒力与毒力基因分布的相关性[J]. 中山大学学报(自然科学版),45(1):82-85.
Zhu D L,Li A H,Wang J G,Li M,Cai T Z,Hu J. 2006. The correlation between the distribution pattern of virulence genes and the virulence of Aeromonas hydrophila strains[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni,45(1):82-85.
Alcaide E,Blasco M D,Esteve C. 2010. Mechanisms of quinoloneresistance in Aeromonas species isolated from humans,waterand eels[J]. Research in Microbiology,161(1):40-45.
Ascencio F,Wadstrom T. 1991. Effect of Aeromonas protease on the binding of Aeromonas hydrophila strains to connective tissue proteins[J]. Microbios,66(2):27-37.
Buchley J T,Howerd S P. 1999. The cytotoxic enterotoxin of Aeromonas hydrophila is aerolysin[J]. Infection and Immunity,67(1):466-467.
Chacón M R,Figueras M J,Castre-Escarpulli G,Soler L,Guarro J. 2003. Distribution of virulence genes in clinical and environmental isolates of Aeromonas spp.[J]. Antonie Van Leeu-
wenhoek,84(4):269-278.
Giraud E,Blanc G,Bouju-Albert A,Weill F X,Donnay-Moreno C. 2004. Mechanisms of quinolone resistance and clonal relationship among Aeromonas salmonicida strains isolated from reared fish with furunculosis[J]. Journal of Medical Microbiology,53(9):895-901.
Han J E,Kim J H,Cheresca C H Jr,Shin SP,Jun J W,Chai J Y,Han S Y,Park S C. 2012. First description of the qnrS-like(qnrS5) gene and analysis of quinolone resistance-determining regions in motile Aeromonas spp. from diseased fish and water[J]. Research in Microbiology,163(1):73-79.
Maji S,Mali P,Joardar S N. 2006. Immunoreactive antigens of the outer membrane protein of Aeromonas hydrophila,isolated from gold-fish,Carassius auratus(Linn.)[J]. Fish & Shellfish Immunology,20(4):462-473.
(責任编辑 兰宗宝)

