木薯试管块根诱导技术研究
严华兵 周慧文 曾文丹

摘 要 以木薯主栽品种‘华南205组培苗为材料,利用正交实验设计L9(34)分析蔗糖浓度、萘乙酸(NAA)、多效唑(PP333)和茉莉酸甲酯(MeJA)对木薯试管块根诱导的影响,筛选适宜木薯试管块根诱导的培养基配方,并对较优配方组合进行验证试验和根系内淀粉粒观察。结果表明:木薯试管块根诱导较优的配方为1/2 MS+6-BA 0.02 mg/L+0.1 mg/L PP333+0.02 mg/L NAA+10 μmol/L MeJA+50 g/L蔗糖+6.3 g/L琼脂。在该配方诱导条件下,组培苗生根率达80%以上,组培苗形成的根系增粗明显,块根内有丰富的淀粉颗粒形成。PP333在木薯试管块根诱导和增粗中起着重要作用。本研究成功获得了较优的木薯试管块根诱导培养基配方,为木薯块根发生发育机理和育种研究奠定了基础。
关键词 木薯;试管块根诱导;蔗糖;植物生长调节剂
中图分类号 S533 文献标识码 A
木薯(Manihot esculenta Grantz)是大戟科(Euphorbiaceae)木薯属(Manihot)植物,耐旱抗贫瘠,广泛种植于非洲、美洲和亚洲等100余个国家或地区,是世界三大薯类作物之一[1]。木薯用途广泛,可食用、饲用和加工成各种工业产品,如淀粉、酒精等[2]。木薯主要在中国广西、云南等热带亚热带地区广泛种植,但产量供不应求,平均产量较低。木薯是以地下贮藏块根为主要经济收获器官,所以研究木薯贮藏块根发生发育具有重要意义。由于木薯块根的发育和成熟需要6~10个月,且块根生长在土壤中,研究观察耗时长且不方便取材[3];通过在离体培养条件下诱导试管块根,是研究木薯块根发生发育和形成机理的一个重要途径。有关试管块根或薯的诱导主要集中在马铃薯、山药等作物,而木薯试管块根诱导研究报道较少。Medina等[4]曾研究细胞分裂素、生长素等因素对木薯试管块根形成的影响,并对诱导产生的试管块根进行了解剖学和形态学的比较研究。Fan等[5]也开展了木薯试管块根诱导相关研究,在添加0.5 mg/L BA和0.5 mg/L NAA的条件下,60 g/L蔗糖浓度有利于木薯试管块根诱导。另外,木薯试管块根诱导的研究工作大多采用单因子分析法,这种方法效率较低,也不能探究各个因子的交互作用。本试验采用四因素三水平L9(34)正交实验设计方法研究蔗糖、萘乙酸(NAA)、多效唑(PP333)和茉莉酸甲酯(MeJA)4个影响因子对木薯试管块根形成和植株形态的影响,探索诱导木薯试管块根的较优配方和不同因素对木薯植株生长形态的影响。
1 材料与方法
1.1 试验材料
木薯品种‘华南205。
1.2 试验方法
1.2.1 外植体材料 采用木薯品种‘华南205无菌组培苗单芽茎段,单芽茎段在MS+6-BA 0.01 mg/L+NAA 0.02 mg/L+蔗糖20.0 g/L的固体培养基中继代增殖,继代周期为45 d。
1.2.2 木薯试管块根诱导 选择蔗糖浓度、萘乙酸(NAA)、多效唑(PP333)和茉莉酸甲酯(MeJA)作为试验因子,每个因子设置3个水平,采用L9(34)正交设计表设计实验,具体设计方法如表1所示,试验共有9个处理,其中处理1为对照(CK)。试验结束后,根据统计结果挑选出较优的处理进行验证试验。通过进一步验证实验的结果和淀粉粒观察比较确定最优配方组合。上述试验所使用的培养基均为固体培养基,由MS基本培养基和添加的6.3 g/L琼脂、6-BA 0.02 mg/L以及表1中不同激素和蔗糖所组合而成。所有培养基均将pH值调至5.8~6.0后灭菌。
1.2.3 试管块根淀粉颗粒观察 取木薯组培苗根系,放入鼓风干燥箱内50 ℃烘干,将烘干后的组培苗根系在研钵内碾碎,取碾碎后的样品0.5 g,以10~20倍蒸馏水均匀分散成悬浊液,加入3~4滴碘液染色。取1滴(约0.05 mL)悬浊液涂抹于载玻片上,盖上盖玻片,轻轻揉按以使颗粒分布均匀,在光学显微镜奥林巴斯BX-10下观察拍照。
1.2.4 培养条件 培养温度(27±1)℃,光照强度为2 000 lx,光照时间12 h/d。
1.3 数据统计分析
各处理设3个重复,每个重复接种5瓶,每瓶接种6个无菌单芽茎段,培养45 d后统计试验数据。
统计指标为:生根率、株高、最长根长、繁殖系数、平均根粗、最粗根粗、茎鲜重和干重、根鲜重和干重以及收获指数。
生根率=生根组培苗数目/接种的组培苗数目×100%
株高和最长根长用直尺测量;根粗用数显游标卡尺测量根部最粗处;干重为材料在恒温烘箱中50 ℃烘至恒重后称量重量的平均值;收获指数=根鲜重/全株鲜重;所有试验数据为3次重复的平均值,结果均以“平均值±标准误差”的形式表示。
采用软件SAS和Excel 2007对数据进行处理、统计与分析。
2 结果与分析
2.1 不同处理中植株形态的差异
经过45 d离体的培养,生长在9种处理培养基的组培苗有显著的形态差异(图1)。从图1和表2可以看出,CK生长正常,株高、最长根长、生根率和繁殖系数均是最高。与CK相比,其余8个处理对组培苗的生长存在不同程度的影响。在9个处理中,处理8的平均根粗和最粗根粗最大。从收获指数来看,不同处理对组培苗茎和根生长影响差异较大,CK的收获指数最低,收获指数最高的发生在处理9组合。
2.2 各因子水平变化对试管块根诱导和植株生长的影响
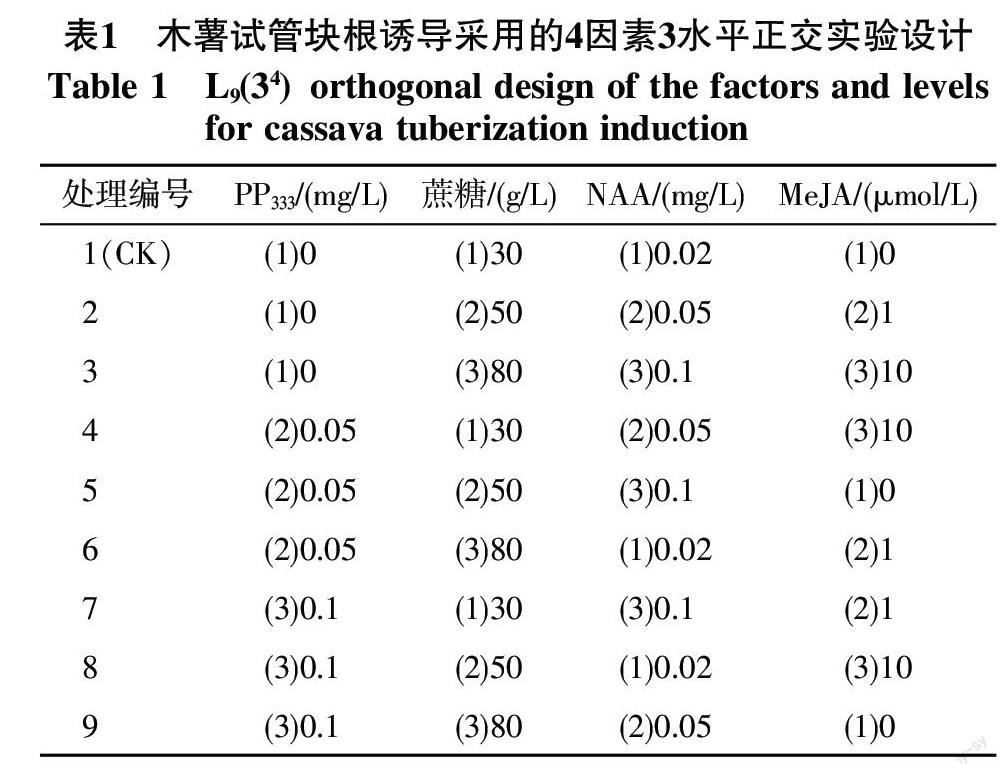
从极差分析结果(表3)可以看出,各因子水平变化均对木薯试管块根诱导和植株生长产生明显影响。从极差结果来看,PP333对平均根粗和最粗根粗的影响最大,其次是MeJA、蔗糖、NAA。使用最高水平的PP333浓度(0.1 mg/L)时,组培苗的平均根粗最大;说明高浓度PP333可以使木薯根部有效增粗。PP333和蔗糖对株高的影响相近,其次是NAA,影响最小的是MeJA。PP333或蔗糖添加浓度越高,组培苗越矮小。对生根率影响最大的是NAA,NAA浓度越高,组培苗生根率越低。
2.3 最优配方组合的初步筛选
从表2可以看出,从生根率来看,处理5、7、9的生根率均不超过20%,显著低于其它处理。处理3和处理6生根率仅50%左右,且它们的繁殖系数、最粗根粗和平均根粗较低。因此,本研究选择处理2、4、8进行验证试验,处理1作为对照。
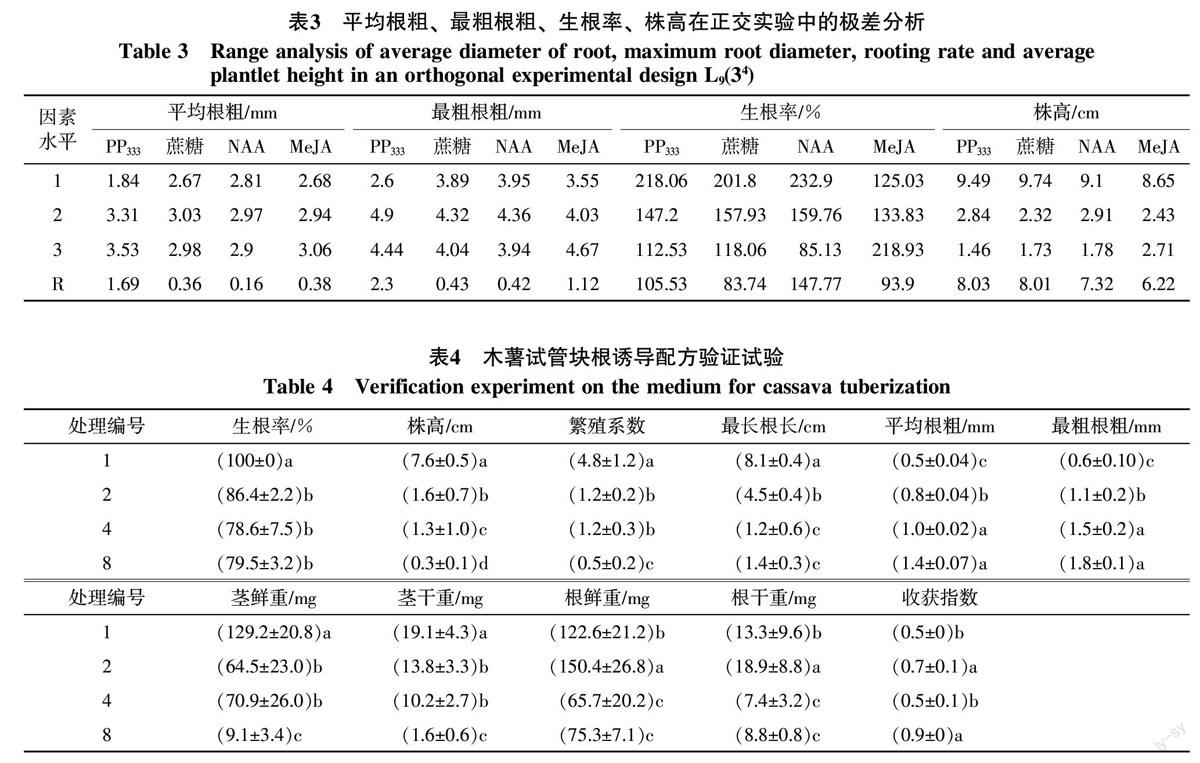
2.4 最优配方组合的验证试验
表4表明,验证实验结果与正交试验结果略有不同,但总体一致。从组培苗平均根粗和最粗根粗来看,处理4和处理8最高,显著高于对照和处理2。
2.5 试管块根淀粉颗粒观察
淀粉粒观察结果如图2所示(淀粉粒呈紫色)。从图2可以看出,4个处理的根系经碘液染色在光学显微镜40倍物镜下,1号处理只能观察出极少量的淀粉粒;2号处理可观察出大量淀粉粒,4号处理可观察到少量大颗粒淀粉粒,8号处理的淀粉粒较小,很难观察到淀粉粒,但在100倍物镜下,可以观察出有丰富的淀粉粒形成。
结合组培苗生长形态、根系形态和淀粉颗粒形成观察结果来看,处理2内有大量淀粉粒产生,但根系增粗不明显;处理4的平均根粗有一定增加,但淀粉粒数量少;处理8的组培苗根系增粗明显,且产生大量淀粉粒。因此,本研究认为处理8为较优的诱导试管块根配方,具体配方为:1/2 MS+6-BA 0.02 mg/L+0.1 mg/L PP333+0.02 mg/L NAA+10 μmol/L MeJA+50 g/L蔗糖+6.3 g/L琼脂。
3 讨论与结论
本试验采用正交实验设计方法探讨不同因素对木薯试管块根诱导的影响,该方法已被前人广泛应用到马铃薯[6-7]、山药[8-9]的试管结薯实验中,但还未见在木薯中的应用报道。在以往的木薯试管块根诱导中[4-5,10],采用的多为单因子实验方法,这种方法需要根据每一个因子设置实验,费时费力,且不能考虑因子之间的交互作用。本实验采用正交实验设计方法,优点是省时省工,缺点是不能具体考察某个因素对实验结果的具体影响,因为在应用正交实验设计方法的实验体系中,所得出的实验结果皆为几个因素共同导致的。笔者通过本次正交设计实验,快速得到了实验结果,并且弥补了应用正交实验设计方法诱导木薯试管块根研究报道中的空白。
以往的研究,PP333被广泛应用于诱导试管块根或试管薯。丰锋等[11]研究发现较高浓度的PP333有利于山薯试管块根的形成。肖关丽等[12]研究表明,高温长日照抑制马铃薯试管薯形成,但高温长日照条件下,马铃薯试管薯可以在添加PP333的培养基中形成,其机理是PP333可调节内源激素质量分数,逆转高温长日照对块茎形成的抑制作用。张翠萍等[13]研究也发现PP333可以成功诱导彩色马蹄莲组培苗在试管中结球。本研究发现,PP333对根粗的增加起到明显促进作用,生长在添加高浓度PP333的培养基的组培苗根系显著增粗,但植株生长受到明显抑制;这与张胜珍等[14]和褚明宇等[15]研究结果十分相似。茉莉酸(JA)及其衍生物,在诱导山药和马铃薯试管块根中已被较多的应用[8,16-17]。杜红梅等[18]研究结果表明,MeJA可以提高香酥芋的子球鲜重、干重和干物质含量,其推测机理可能是影响成球过程中贮藏物质的积累。目前关于MeJA对木薯试管薯诱导影响的研究甚少,据了解,本试验是第一次使用MeJA作为诱导木薯试管薯的试验因子。通过极差分析,发现MeJA对木薯组培苗的平均根粗和收获指数的影响较大,因此建议今后可开展关于MeJA对木薯块根生长调控影响的研究。而本试验中还观察到,有的淀粉粒较大,有的较小。推测可能是植物生长调节剂水平和种类的不同影响了组培苗根系的淀粉粒累积形态,具体原因有待进一步探讨研究。在姚远[10]的研究中,有单粒淀粉粒和复粒淀粉粒2种形态。
本试验在离体条件下成功诱导了木薯试管块根发生。以试管块根替代田间薯块,将可能有利于离体条件下探讨木薯块根形成和发生发育机理,研究不同外源条件如植物生长调节剂等对木薯块根形成的影响;也利于在木薯淀粉品质改良育种中,可作为木薯育种辅助技术,并在离体条件下观察淀粉粒形成和结构变化。
木薯试管块根诱导较优的配方为1/2 MS+6-BA 0.02 mg/L+0.1 mg/L PP333+50 g/L蔗糖+0.02 mg/L NAA+10 μmol/L MeJA+6.3 g/L琼脂。该配方诱导条件下,组培苗生根率达80%以上,组培苗形成的根系增粗明显,根内有较多淀粉颗粒形成。木薯试管块根可为木薯块根发生发育机理和育种研究奠定基础。
参考文献
[1] El-Sharkawy M A. Cassava biology and physiology[J]. Plant Molecular Biology, 2004, 56: 481-501.
[2] Balagopalan C. Cassava utilization in food, feed and industry[A]. In: Hillocks R J, Thresh J M, Bellotti A C(eds). Cassava: biology, production and utilization[C]. CAB International, 2002: 301-318.
[3] 赵 超, 黄 洁.木薯栽培与育种[M]. 北京: 中国农业出版社, 2011: 17-21.
[4] Medina R D, Faloci M M, Gonzalez A M, et al. In vitro cultured primary roots derived from stem segments of cassava(Manihot esculenta)can behave like storage organs[J]. Annals of Botany, 2007, 99: 409-423.
[5] Fan M X, Liu Z C, Zhou L G, et al. Effects of plant growth regulators and saccharide on in vitro plant and tuberous root regeneration of cassava(Manihot esculenta Crantz)[J]. Journal of Plant Growth Regulation, 2011, 30: 11-19.
[6] 何 进. 植物生长物质对马铃薯试管壮苗和试管块根诱导的影响[D]. 雅安: 四川农业大学, 2011.
[7] 万 林. 马铃薯试管块根壮苗与诱导结薯培养组合筛选[D]. 雅安: 四川农业大学, 2012.
[8] 严华兵, 梁春秀, 杨丽涛, 等. 山薯试管零余子的诱导[J]. 热带作物学报, 2009, 30(11): 1 641-1 645.
[9] Yan H B, Yang L T, Li Y R. Axillary shoot proliferation and tuberization of Dioscorea fordii Prain et Burk[J]. Plant Cell Tissue and Organ Culture, 2011, 104: 193-198.
[10] 姚 远. 木薯组培苗贮藏根形成及淀粉[D]. 海口: 海南大学, 2010.
[11] 丰 峰, 叶春海, 李映志, 等. 生长调节物质、碳源和光周期对山薯试管块根形成和生长发育的影响[J].植物生理学通讯, 2007, 43(6): 1 045-1 049.
[12] 肖关丽, 龙雯虹, 郭华春. 多效唑和温光对马铃薯组培苗内源激素及微型薯诱导的影响[J]. 西南大学学报(自然科学版), 2011, 33(8): 21-26.
[13] 张翠萍, 赵 健, 唐凤鸾, 等. 多效唑、 矮壮素对彩色马蹄莲试管微型种球诱导的影响[J]. 南方农业学报, 2011, 42(11): 1 320-1 323.
[14] 张胜珍, 客绍英, 马作东, 等. 植物延缓剂PP333和B9对菘蓝试管苗生长的影响[J]. 西南农业学报, 2009, 22(5): 1 428-1 431.
[15] 褚明宇, 毛 娟, 陈佰鸿. PP333和CCC对葡萄试管苗生长的影响[J]. 西北农业学报, 2012, 21(11): 151-157.
[16] Bazabakana R, Fauconnier M L, Diallo B, et al. Control of Dioscorea alata microtuber dormancy and germination by MeJA smonic acid[J]. Plant Growth Regulation, 1999, 27: 113-117.
[17] 陈大清, 王雪英, 李亚男. 水杨酸和茉莉酸甲酯对试管马铃薯形成的影响[J]. 华中农业大学学报, 2005, 24(1): 74-78.
[18] 杜红梅, 唐东梅, 黄丹枫. 茉莉酸甲酯对芋试管成球的影响[J]. 上海交通大学学报(农业科学版), 2009, 27(5): 480-484.

