拉米夫定对HepG2.2.15细胞MMP-9及p53表达的影响
王 雪,杨 伟,李 靖,马存花
基础医学
拉米夫定对HepG2.2.15细胞MMP-9及p53表达的影响
王雪,杨伟*,李靖,马存花
[摘要]目的通过检测拉米夫定作用于人肝癌细胞系(HepG2.2.15)后对其基质金属蛋白酶-9(MMP-9)及p53表达的变化,探讨拉米夫定对原发性肝癌发生发展的抑制作用。方法不同浓度(100μg/ml、200μg/ml、300μg/ml)拉米夫定作用于HepG2.2.15细胞不同时间(3 d及6 d)后,四甲基偶氮唑盐(MTT)比色法测定细胞增殖活性;双抗体夹心酶联免疫吸附实验(ELISA)测定细胞培养上清及胞质中MMP-9及p53蛋白含量。结果经拉米夫定作用后的HepG2.2.15细胞生长未受明显抑制;细胞中MMP-9及p53的表达均出现不同程度降低。结论拉米夫定通过降低HepG2.2.15细胞中MMP-9及p53的表达来抑制肝癌的侵袭及转移。
[关键词]肝细胞肝癌;HepG2.2.15细胞;MMP-9;p53;拉米夫定
肝细胞癌(hepatocellular carcinoma,HCC)是临床上最常见、恶性程度最高的肿瘤之一。在亚洲和非洲主要和感染乙肝病毒(HBV)有关,HBV是HCC的致病因子已被公认[1]。肝癌的特点是早期转移,由肿瘤细胞和微环境中分泌的几种生物分子在其发展和转移的关键环节中发挥了重要作用。其中,基质金属蛋白酶-9(MMP-9)及p53基因起到了关键作用。拉米夫定作为核苷类似物,通过终止HBV DNA链合成以抑制肝癌的机制已明确[2]。本实验用核苷酸类药物拉米夫定作用于人肝癌细胞系(HepG2.2.15)后,对其培养细胞和培养液中基质金属蛋白酶-9(MMP-9)及p53表达水平进行检测,探讨核苷酸类药物在分子水平对肝癌防治的意义。
1 材料与方法
1.1材料HepG2.2.15细胞株购自上海博谷生物科技有限公司。α-MEM培养基和胎牛血清均为Gibco产品。G418购自北京格林博远生物科技有限公司。胰蛋白酶/EDTA(0.25%/0.53 mM)、青链霉素混合液、PBS、MTT细胞增殖及细胞毒性检测试剂盒购于北京Solarbio公司。拉米夫定片购自葛兰素史克公司。MMP-9及p53试剂盒购自上海博谷生物科技有限公司。
1.2方法
1.2.1细胞培养常规复苏HepG2.2.15细胞,用含10%胎牛血清的α-MEM培养基(含青霉素100 U/ml、链霉素100 μg/ml,200 μg/ml G418),于5%CO2、37℃孵育箱中培养。每3~4 d更换一次培养基。待细胞生长至80%~90%融合时使用胰蛋白酶/EDTA (0.25%/0.53 mM)消化,按比例1∶3传代。
1.2.2四甲基偶氮唑盐比色法(MTT)测定细胞生长曲线取对数期HepG2.2.15细胞,用胰蛋白酶/EDTA(0.25%/0.53 mM)消化,细胞计数,调整细胞悬液浓度,按照104个细胞/孔接种于96孔板。设正常生长组和不同浓度拉米夫定(100 μg/ml、200 μg/ml、300 μg/ml)组,以不加细胞仅加培养液的平行孔作为空白对照。正常生长组使用常规培养基,拉米夫定处理组添加不同浓度拉米夫定。每组设5个复孔,于5%CO2、37℃孵育箱中培养。分别于第0、2、4、6、8 d采用MTT法测定每组细胞增殖情况。MTT法具体操作:小心吸弃上清,加入90 μl无血清培养基及10 μl MTT后于5%CO2、37℃孵育箱中培养4 h。小心吸弃上清,每孔加入110 μl Formazan溶解液,震荡10 min待结晶物充分溶解后,用酶标仪检测各孔490 nm波长处吸光度(A)值,计算平均值及标准差,绘制细胞生长曲线。
1.2.3ELISA方法测定细胞及培养上清中MMP-9及p53的表达取对数期HepG2.2.15细胞,按照5×104个细胞/孔接种12孔板。设正常对照组及拉米夫定处理组,每组设5个复孔。正常对照组使用常规培养基,拉米夫定处理组使用添加不同浓度拉米夫定的培养基。于5%CO2、37℃孵育箱中培养。分别于第3、6天收集细胞及上清。胰酶消化回收细胞,12000 r/min离心5 min后弃上清,加200 μl PBS重悬。液氮/37℃水浴反复冻融法裂解细胞,重复三次。12000 r/min离心10 min,留取上清,-70℃冻存。严格按照试剂盒说明书分别测定细胞及培养上清中MMP-9及p53的表达。
1.2.4统计学方法所得数据采用SPSS 19.0软件,统计处理以每组测定值的均数±标准差(±s)表示,组间比较用t检验和方差分析,P<0.05为差异有统计学意义。
2 结果
2.1四甲基偶氮唑盐比色法(MTT)测定细胞生长曲线从图1曲线可以看出:拉米夫定处理组与正常对照生长组细胞生长速度无明显差别(P>0.05),说明所用拉米夫定对HepG2.2.15细胞没有直接毒性杀伤作用。

图1 MTT法测定细胞生长曲线
2.2HepG2.2.15细胞及其培养液中MMP-9及p53表达水平的测定图2、3的结果显示,在第3、6天,拉米夫定各处理组HepG2.2.15细胞及其培养液中MMP-9及p53表达水平分别与正常培养对照组比较,有明显降低(P<0.05)。
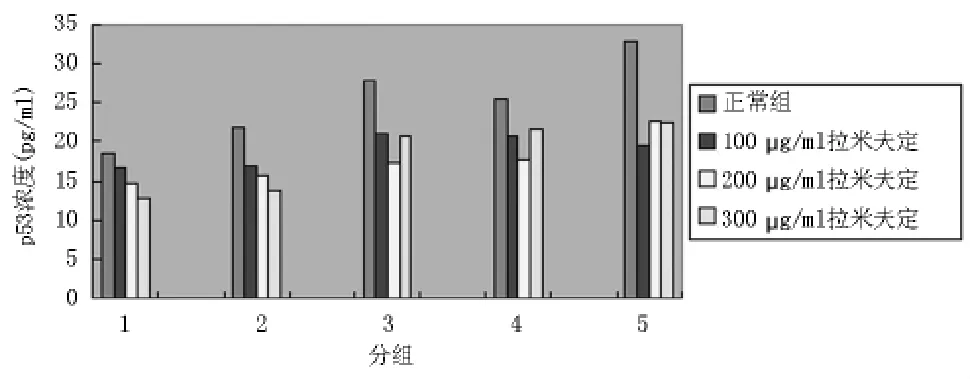
图2 细胞及培养上清液中MMP-9的表达

图3 细胞及培养上清液中p53的表达
3 讨论
MMP-9作为一种明胶酶,可以有效降解细胞外基质中Ⅳ、Ⅴ型胶原和明胶,研究发现,MMP-9与多种恶性肿瘤侵袭转移存在一定的关系[3-5]。Riedel等[6]报道,MMP-9可作为肿瘤血管形成的调控因素参与肿瘤血管形成,MMP-9与VEGF在肿瘤血管形成中起协同作用。其发挥作用时能够在细胞的表面对MMP-2有效地激活,并促进MMPs家族其他因子的活化,共同发挥降解细胞外基质的作用[7,8]。在肿瘤细胞复杂的转移和浸润过程中,MMP-9可通过刺激肿瘤细胞迁移、侵袭,促进血管生成而在肿瘤的发生发展中起核心作用[9,10],有研究发现,MMP-9与肝癌、胶质瘤、乳腺癌等多种肿瘤的浸润、转移和术后复发相关[11,12]。此外,MMPs还可以增强血管生长因子的作用,促进新生血管的形成[13,14]。已逐渐成为抗肿瘤治疗中重要的药物作用靶点[15]。p53基因是目前研究较早的抑癌基因,分为突变型和野生型。野生型p53是抑癌基因,对细胞增殖起负调控作用,野生型p53突变后失去抑癌基因功能,并且与野生型p53结合成复合物,抑制p53基因功能,导致细胞异常增殖[16,17],可诱导一些异常基因表达,促进肿瘤的发生[18]。并且可以下调抑制血管增生的凝血酶的反应素-1(TSP-1)和上调促血管增生的VEGF,因而成为调控肿瘤血管形成的重要因素[19]。
HBV作为一种病毒,它在细胞内的复制有可能作为激发p53活性的因素,使p53的表达及功能增强,进而可能导致细胞某些生物学活性(如细胞凋亡、细胞周期等)的改变,可能是细胞感染HBV后的保护性反应。有研究证实p53失活与MMP-9的表达在HCC发展中起协同作用[20]。Franchi等[21]认为,p53的突变可以上调MMP-9基因的转录,并且通过NOS和EGFR途径影响MMP-9的表达。本实验中,拉米夫定处理组细胞及上清中p53及MMP-9的表达均降低。进而推断,拉米夫定导致的HBV 及p53、MMP-9的表达降低可能是一个良性循环,对抑制肝癌的侵袭转移起重要作用。实验结果提示:核苷类药物不仅可以直接抑制HBV复制,还可能通过某种机制,降低p53及MMP-9的表达,从而抑制肝癌的发生和进展。
参考文献
[1]Lupberger J,Hildt E.Hepatitis B virus-induced oncogenesis[J].World J Gastroenterol,2007,13(1):74-81.
[2]徐瑗瑗,徐少保.拉米夫定治疗慢性乙型病毒性肝炎的新进展[J].中国医院用药评价与分析,2011,11(1):7-9.
[3]Raghu H,Sodadasu PK,Malla RR,et al.Localization of uPAR and MMP-9 in lipid rafts is critical for migration,invasion and angiogenesis in human breast cancer cells[J].BMC Cancer,2010,24(10):647.
[4]Canete A,Gerrard M,Rubie H,et al.Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment:the International Society of Paediatric Oncology EuropeanNeuroblastoma Experience[J].J Clin Oncol,2009,27 (7):1014-1019.
[5]Park JR,Eggert A,Caron H.Neuroblastoma:Biology,prognosis,and treatment[J].Pediatr Clin North Am,2008,55(1):97-103.
[6]Riedel F,Gotte K,Schwalb J,et al.Expression of 92 KD type IV collagenase correlates with angiogenic markers and poor survival in head and neck squamous cell carcinoma[J].Int J Oncol,2000,17(6):1099-1105.
[7]Zarrabi K,Dufour A,Li J,et al.Inhibition of matrix metalloproteinase 14(MMP-14)mediated Cancer cell migration[J].J Biol Chem,2011,286(38):33167-33177.
[8]Koyama Y,Naruo H,Yoshitomi Y,et al.Matrix metalloproteinase-9 associated with heparan sulphate chains of GPI anchored cell surface proteoglycans mediates motility of murine colon adenocarcinoma cells[J].J Biochem,2008,143(5):581-592.
[9]Chen Jingsong,Huang Xiaohui,Wang Qian,et al.Sonichedgehogsignaling pathway induces cell migration and invasion through focal adhesion kinase/AKT signaling-mediated activation of matrix metalloproteinase(MMP)-2 and MMP-9 in liver cancer[J].Carcinogenesis,2013,34(1):10-19.
[10]Cock-rada AM,Medjkane S,Janski N,et al.SMYD3 promotes cancer invasion by epigenetic upregulation of the metalloproteinase MMP-9[J].Cancer Res,2012,72(3):810-820.
[11]Chetty C,Ponnala S,Gujrati M,et al.Knockdown of MMP-9 inhibits radiation-induced invasive phenotype,angiogenesis and tum or growth in gliom a cancer stem cell[J].Cancer Res,2013,73(8S):4907.
[12]夏庆安,付玉环,姜广建.HSG、MMP-9和MMP-2在乳腺癌组织中的表达及意义[J].现代预防医学,2012,39(2):323-324,327.
[13]Yu C,Pan k,Xing D,et al.Correlation between a single nucleotide polymorphism in the matrix metalloproteinase-2 promoter and risk of lung cancer[J]. Cancer Res,2002,62(22):6430-6433.
[14]Huo N,Ichikawa Y,Kamiyama M,et al.MMP-7(matrilysin)accelerated growth of human umbilical vein endothelial cells [J].Cancer Lett,2002,177(1):95-100.
[15]Leifler KS,Svensson S,Abrahamsson A,et al.Inflamation induced by MMP-9 enhances term or regression of experimental breast cancer[J].J Immunol,2013,190(8):4420-4430.
[16]方嬿,黄必军,梁启万.原发性肝癌p53基因高频缺失的双色荧光原位杂交证据[J].中国病理生理杂志,2003,19(3):306-309.
[17]李红智,喻林升,王宗敏,等.乳腺癌细胞凋亡、增殖与相关基因表达突变的关系[J].中国病理生理杂志,2003,19(5):676-678.
[18]汪勤,解正新,张卫琴.p16、p53和ki67蛋白在子宫颈上皮内瘤变中的表达及意义[J].临床与实验病理学杂志,2013,29 (5):551-553.
[19]Freemantle SJ,Dmitrovsky E.Clinical link between p53 and angiognesis in lung cancer[J].J Clin Oncol,2002,20(4):883-884.
[20]谈黎.原发性肝癌组织中MMP-9、p53的表达[J].河南肿瘤学杂志,2005,5(3):236-238.
[21]Franchi A,Santucci M,Masini E,et al.Expression of matrix metalloproteinase I,matrix metalloprotinase 2,matrix metalloproteinase 9,in carcinomaof the and head and neck[J].Cancer,2002,95(9):1902-1910.
[2015-08-15收稿,2015-09-14修回][本文编辑:韩仲琪]
Effect of lamivudine on the expression of MMP-9 and p53 in HepG2.2.15 cells
WANG Xue①,YANG
Wei,LI Jing,et al.①
Weifang Medical University,Weifang,Shandong 261053,China
[Abstract]Objective To study the inhibitory effect of lamivudine on the formation and development of primary liver cancer by detecting the expression of matrix metalloproteinases-9(MMP-9)and p53 in human hepatocellular carcinoma cell line(HepG2.2.15).Methods HepG2.2.15 were treated with different concentrations (100 μg/ml,200 μg/ml,300 μg/ml)of lamivudine for 3d and 6d in vitro,the cell proliferation activity of HepG2.2.15 were assayed bv MTT.Double antibody sandwich enzyme linked immunosorbent assay(ELISA)for the determination of MMP-9 and p53 in the cell culture supernatant and cytoplasm.ResultsThe growth of HepG2.2.15 cells was not significantly inhibited by lamivudine.The expression of MMP-9 and p53 appeared to decrease in different degrees.ConclusionLamivudine inhibits the invasion and metastasis of HCC by reducing the expression of p53 and MMP-9 in HepG2.2.15 cells.
[Key words]HCC;HepG2.2.15 cells;MMP-9;p53;Lamivudine
[中图分类号]R735.7
[文献标志码]A
[作者单位]261053山东潍坊,潍坊医学院(王雪,马存花);261021山东潍坊,解放军89医院(杨伟,李靖)
DOI:10.14172/j.issn1671-4008.2016.02.025

