α-蒎烯衍生物对山核桃干腐病菌作用机理1)
杨洋 马玲 马岩 陈旭日 潘佳亮 葛康康 姚翰文 刘雪峰
(东北林业大学,哈尔滨,150040) (哈尔滨商业大学) (东北林业大学)
α-蒎烯衍生物对山核桃干腐病菌作用机理1)
杨洋马玲马岩陈旭日潘佳亮葛康康姚翰文刘雪峰
(东北林业大学,哈尔滨,150040)(哈尔滨商业大学)(东北林业大学)
摘要为了探讨α-蒎烯衍生物3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙对病原菌的作用机理,采用平板扩散法研究了α-蒎烯衍生物对山核桃干腐病原菌(Botryosphaeria fusisporae)的抑制作用。结果表明:该衍生物可以抑制山核桃干腐病原菌生长,最大抑制率为63.37%,EC50为0.059 4 g·L-1,可导致山核桃干腐病菌菌丝体生长缓慢、质量减轻、菌液中pH值减小程度逐渐变大、电导率明显升高、大分子物质的吸光值增大、可溶性蛋白增加、过氧化物酶(POD)和过氧化氢酶(CAT)活性降低。说明α-蒎烯衍生物主要改变病原菌细胞膜的通透性,具有开发利用的潜力。
关键词α-蒎烯衍生物;作用机理;山核桃干腐病
分类号S763.1
α-pinene Derivative on Action Mechanism ofBotryosphaeriafusisporae//
Yang Yang, Ma Ling
(Northeast Forestry University, Harbin 150040, P. R. China); Ma Yan(Harbin University of Commerce); Chen Xuri, Pan Jialiang, Ge Kangkang, Yao Hanwen, Liu Xuefeng(Northeast Forestry University)//Journal of Northeast Forestry University,2016,44(5):88-91,96.
To explore theα-pinene derivative of 3-methoxy-4-hydroxyphenyl-α-pinene maleimido acylhydrazone mechanism of pathogenic bacteria, we used the plate diffusion method to study theα-pinene derivative inhibition ofBotryosphaeriafusisporaepathogens. The derivative can inhibit the growth of B. fusisporae pathogens, the largest inhibition was 63.37%, EC50was 0.059 4 g/L, which led toB.fusisporaepathogens mycelial growth slow weight loss, pH value decrease degree of bacteria gradually increased, the electrical conductivity significantly increased, the absorbance macromolecules increases, the soluble protein increased, POD and CAT activity decreased. Theα-pinene derivative mainly changes the permeability of cell membrane pathogens with the potential development and utilization.
Keywordsα-pinene derivative; Function mechanism; Botryosphaeria fusisporae
山核桃干腐病是山核桃生产中发现的1种新病害,是一类主要由山核桃干腐病菌(Botryosphaeriafusisporae)引起的病害,又称溃疡病[1]。在山核桃主栽培区普遍发生,个别地区受害严重,病株上少则几个病斑,多则几十个病斑,最严重的可达数百个病斑,发病率在30%以上,不但影响山核桃的生长和产量,而且严重时会导致树木过早死亡,造成重大经济损失[2]。目前,关于该病的防治方法研究报道较少,只见物理刮除病斑法[3]和化学农药喷洒法[4]。直接刮除病斑会造成树木产生新的伤口,易再度引发病菌侵入,且防治效果较短;化学农药喷洒对防治山核桃干腐病效果更好[5],但从长远考虑,山核桃是一种高档干果,对食品安全性要求很高,因此寻找高效、低毒、低残留的生物防治方法迫在眉睫。
α-蒎烯是多种植物精油活性成分的重要组成部分,是植物挥发性有机化合物,具有广谱的抗真菌作用和很强的杀虫活性[6]。已有研究表明,α-蒎烯以及含有α-蒎烯的植物精油对很多森林害虫和某些病原菌具有很好的控制作用[7-8],例如土传病菌尖孢镰刀菌(Fusariumoxysporum)和斜纹夜蛾(Spodopteralitura)。但是α-蒎烯单体对病原菌的作用效果并不理想,所以对α-蒎烯的结构进行修饰改造合成具有更好抑菌效果的衍生物是非常必要的。与此同时,国内外对其抗菌机制报道较少,因此,选择α-蒎烯的1种衍生物3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理山核桃干腐病原菌,观察菌落生长情况,通过比较处理前后菌丝体质量的变化以及菌液中pH值、电导率等理化性质的变化,并比较α-蒎烯衍生物处理菌丝体后,其过氧化物酶(POD)和过氧化氢酶(CAT)的差异,旨在探究出α-蒎烯衍生物对山核桃干腐病的作用机理,为开发新型植物源杀菌剂,有效防治病原菌提供理论依据。
1材料与方法
1.1供试菌种
山核桃干腐病菌(Botryosphaeriafusisporae)菌株,由东北林业大学林学院森林保护学专业病理实验室提供。
1.2试验方法
1.2.1α-蒎烯衍生物对山核桃干腐病抑菌试验
PDA培养基的配制:准确称量洗净去皮马铃薯200 g,切碎,加入1 L蒸馏水煮沸30 min,用2层纱布过滤至烧杯。分别称量20 g的葡萄糖和琼脂,加入煮好的培养基中,充分搅拌使其溶解,定容至1 L,分装在锥形瓶中高温高压灭菌,冷却后保存备用。
山核桃干腐病抑菌试验:山核桃干腐病菌种接种在固体斜面培养基上,活化2次,然后挑取第2次活化菌种于固体培养基中,25 ℃、131 r·min-1摇床培养。采用平板扩散法[9-10]进行试验,在超净工作台内,将直径0.5 cm菌饼接种在灭好菌直径为9.0 cm的培养皿中央,在距离菌饼中心水平方向3.5 cm处分别用无菌打孔器打2个孔,在孔内分别注入0.02、0.04、0.06、0.08、0.10 g·L-1的3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙药液,以不含药剂但含相同体积的生理盐水作为对照,每处理重复3次,25 ℃在霉菌培养箱内培养5 d。观察菌落生长情况,并测量菌落直径,计算菌丝生长抑制率和抑制中浓度EC50。
菌落净生长量=测得菌落平均值-0.5。
菌丝生长抑制率=((对照组菌落净生长量-处理组菌落净生长量)/对照组菌落净生长量)×100%。
1.2.2菌丝体质量及其理化性质的测定
将1 mL山核桃干腐病菌的孢子悬浮液(1×107菌落·mL-1)接种到100 mL灭菌后的PDA液体培养基中,25 ℃、131 r·min-1摇床中培养。处理组加入1 mL 6.0 g·L-1的α-蒎烯衍生物使得液体培养基中药液质量浓度始终保持在0.06 g·L-1,对照组加入1 mL的生理盐水,分别测定以下指标。
菌丝体质量:培养12、24、36、48、60、72、84、96、108、120 h后,分别取样5 mL,过滤获得菌丝体,放入烘箱105 ℃烘干6 h,利用干重法获得其质量。
pH值:培养12、24、36、48、60、72、84、96、108、120 h后,分别取样,用pH计直接测定培养液的pH值。
培养液电导率:培养12、24、36、48、60、72、84、96、108、120 h后,分别取5 mL培养液,4 000 r·min-1离心10 min,弃沉淀,重复2次。取上清液,稀释成一定的浓度,用电导率仪测其液体电导率[11],每个试验重复3次。R=((Rs-Rc)/Rc)×100%。式中:Rs为处理组电导率;Rc为对照组电导率。
培养液中大分子物质吸光值:培养12、24、36、48、60、72、84、96、108、120 h后,分别取5 mL培养液,6 000 r·min-1离心10 min,留沉淀,用PBS缓冲液洗涤,重复2次。利用无菌水将离心后的沉淀制成菌悬液,在260 nm波长下,用紫外分光光度计测定上清液中大分子物质的吸光值[12]。对照组为无水乙醇,每个试验重复3次。
1.2.3培养液中蛋白质量浓度的测定
标准曲线绘制:取6支10 mL具塞试管,按照表1加样盖塞后,将各试管中溶液充分混合,放置3 min后用1 cm光经比色杯在595 nm波长下比色,记录各管测定的光密度值,并做标准曲线。

表1 各试管加样标准
培养液中蛋白质量浓度:将1 mL山核桃干腐病菌的孢子悬浮液(1×107菌落·mL-1)接种到100 mL灭菌后的PDA液体培养基中,25 ℃、131 r·min-1摇床中培养。处理组加入1 mL 6.0 g·L-1的α-蒎烯衍生物使得液体培养基中药液质量浓度始终保持在0.06 g·L-1,对照组加入1 mL的生理盐水。培养12、24、36、48、60、72、84、96、108、120 h后,分别取5 mL培养液,6 000 r·min-1离心10 min,弃沉淀,重复2次。取上清液,稀释成一定的浓度,取0.5 mL稀释提取液,加入5 mL考马斯亮蓝G-250试剂在室温下放置3 min后在595 nm下比色[13],记录吸光值,用蒸馏水作对照,每个试验重复3次。
1.2.4过氧化物酶和过氧化氢酶测定
将1 mL山核桃干腐病菌的孢子悬浮液(107菌落·mL-1)接种到100 mL灭菌后的PDA液体培养基中,25 ℃、131 r·min-1摇床中培养,分别加入适量的α-蒎烯衍生物使得液体培养基中药液质量浓度始终恒定,分别为0、0.04、0.06、0.08、0.10、0.15、0.20 g·L-1,培养5 d后分别取5 mL培养液,低温条件下用超声波细胞破碎仪处理50 s,8 000 r·min-1离心10 min弃沉淀。
过氧化物酶测定:取1 mL上清液作为粗酶液加入比色皿中,将3 mL反应液在室温25 ℃保温10 min,立即加入到含粗酶液的比色皿中,对照组加3 mL反应液,于470 nm处测其吸光度值,1 mL 100 mmol·L-1PBS(pH=6.0)缓冲液,每个处理重复3次[14]。以每毫克蛋白每分钟使反应体系的吸光度降低0.01为1个比活性单位。
过氧化氢酶测定:取1 mL上清液作为粗酶液加入比色皿中,将3 mL反应液在室温25 ℃保温10 min,立即加入到含粗酶液的比色皿中,对照组加3 mL反应液,1 mL含30% H2O2150 mmol·L-1PBS(pH=7.5)缓冲液,于240 nm处测其1 min内吸光度值的变化,每个处理重复3次[15]。以每毫克蛋白每分钟使反应体系的吸光度降低0.01为1个比活性单位。
1.3数据统计分析
采用POLO软件计算α-蒎烯衍生物对山核桃干腐病抑制中浓度EC50和95%置信区间。运用SPSS17.0软件分析不同时间、不同处理下各项指标的变化情况,采用Duncan’s法进行差异显著性分析(p<0.05)。
2结果与分析
2.1α-蒎烯衍生物对山核桃干腐病抑菌效果
0.02、0.04、0.06、0.08、0.10 g·L-1的3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙对山核桃干腐病菌的抑制率分别为12.32%、24.84%、51.79%、60.84%、63.37%。可见,α-蒎烯衍生物对山核桃干腐病菌有一定的抑制作用,导致菌丝体生长缓慢提前衰退,而且随着药液质量浓度的增大,抑制率也随之增大。当药液质量浓度为0.10 g·L-1时对山核桃干腐病菌抑制率最大,为63.37%。经计算得EC50为0.059 4 g·L-1,所以可选择在药液质量浓度为0.06 g·L-1时对山核桃干腐病菌的抑制作用为基准,探究抑菌作用机理。
2.2α-蒎烯衍生物对菌丝体质量及其理化性质的影响
不同处理时间菌丝体质量及其理化性质变化情况如表2所示,2组菌丝体质量均呈现先上升后下降的趋势,基本在96 h时,菌丝质量同时达到最大,对照组最大可达0.027 2 g。处理组的菌丝体质量始终小于对照组,说明该药液对山核桃干腐病菌有一定抑制作用,菌丝体生长缓慢;随着处理时间的增加,2组培养液的pH值都在相应的减小,并且减小的幅度逐渐变缓,处理120 h,pH值达到最低。处理组菌液的pH值始终明显小于对照组,推测该病原菌受α-蒎烯衍生物药液的作用后,可能产生一定量的酸性物质致使菌液的pH值变小,并且随着处理时间的增加,产生的酸性物质也随之增多。
由表2可知,离心后上清液电导率随着药液作用时间的增加而增大,处理96 h,趋于稳定,而且处理组培养液电导率始终高于对照组,推测培养液中电导率的变化可能是因为细胞膜通透性的改变,导致培养液中阴阳离子数目发生改变;培养液中大分子物质吸光值与电导率变化趋势相似,推测该药液破坏了山核桃干腐病的细胞膜,使细胞膜的通透性发生变化,从而导致大分子物质外漏,并且随着药液处理时间的增加,大分子物质外漏更加严重,导致大分子物质的吸光值不断增加,进而说明随着处理时间的增加细胞膜的通透性也在增加。
2.3α-蒎烯衍生物对培养液中可溶性蛋白质量浓度的影响
由表2可知,随着药液处理时间的增加,对照组可溶性蛋白质量浓度呈略微下降趋势,说明山核桃干腐病在培养的过程中消耗了一定量的蛋白;处理组培养液中可溶性蛋白质量浓度不断增加,且始终高于对照组,最高可达346.2 mg·L-1,推测该药液对山核桃干腐病原菌的细胞膜造成破坏,细胞膜内的蛋白外漏,从而导致培养液中可溶性蛋白质量浓度增加。

表2 不同处理时间菌丝体质量、理化性质及其可溶性蛋白质量浓度
2.4α-蒎烯衍生物对过氧化物酶和过氧化氢酶活性的影响
不同质量浓度的3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙药液对过氧化物酶(POD)和过氧化氢酶(CAT)活性的影响如表3所示。由表3可知,经不同质量浓度药液处理后,处理组培养液中POD和CAT活性变化明显,随着药液质量浓度的增加山核桃干腐病菌POD和CAT的活性显著下降,表现显著的抑制作用,在药液质量浓度为0.20 g·L-1时达到最低值,说明山核桃干腐病菌细胞内原有的POD和CAT系统平衡被该药液破坏,导致自由基清除系统出现障碍,活性不断降低,从而影响细胞正常代谢,菌丝体生长受到抑制。
表3不同质量浓度药液对过氧化物酶和过氧化氢酶活性的影响
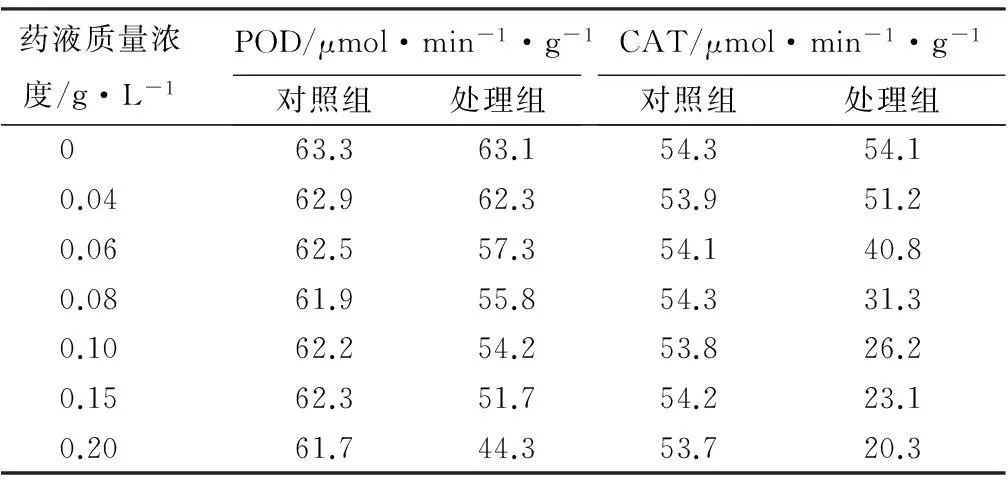
药液质量浓度/g·L-1POD/μmol·min-1·g-1对照组处理组CAT/μmol·min-1·g-1对照组处理组0 63.363.154.354.10.0462.962.353.951.20.0662.557.354.140.80.0861.955.854.331.30.1062.254.253.826.20.1562.351.754.223.10.2061.744.353.720.3
3结论与讨论
山核桃干腐病是山核桃上最重要的病害,不仅影响山核桃的产量,而且会削弱树势,严重时则导致树木过早死亡,生产中缺乏有效的防治方法[16]。本试验选择α-蒎烯的1种衍生物3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙处理山核桃干腐病原菌,并初步探究其作用机理。研究表明,α-蒎烯衍生物对山核桃干腐病原菌有一定抑制作用,随着药液质量浓度的增加,抑制效果增强,最大抑制率为63.37%,为代替传统化学杀菌剂提供了可能。
菌丝体质量、培养液pH值、电导率以及培养液中大分子物质含量和可溶性蛋白含量均可衡量病原菌的生长情况。其中菌丝体质量是病原菌生长是否良好的最直观展现[17]。本试验通过测定菌丝体质量发现,处理组的菌丝体质量始终小于对照组,由于菌丝体通过吸收培养基内营养物质来生长,达到对数期后逐渐衰退,所以处理组和对照组菌丝体生长均呈现先上升后下降的趋势,说明该药液对山核桃干腐病菌产生一定抑制作用,导致菌丝体生长缓慢,质量减轻;pH值是菌丝生长环境中很重要的因素,pH值反映菌液中酸碱度的高低,过低的pH值会抑制菌丝的生长[18]。本试验发现,处理组菌液的pH值明显小于对照组,说明该药液导致培养基内酸性增大或者是促进了山核桃干腐病菌的酸性次生代谢产物的产生,抑制了菌丝正常生长;菌丝体内电解质对菌丝的生命活性至关重要,正常情况下,由于细胞膜作用,菌丝体细胞内物质不会渗漏[19]。本试验通过测定处理组和对照组培养液电导率和大分子物质含量并比较其差异,推测该药液破坏了山核桃干腐病菌的细胞膜结构,影响菌丝体细胞膜的通透性,导致电解质从菌丝体内渗漏到溶液中,并且随着处理时间的延长和药液质量浓度的增加,细胞内的大分子物质外漏加快,电导率随之增大;蛋白质是培养基内重要的营养物质,本试验结果发现,处理组可溶性蛋白质量浓度始终高于对照组,推测该药液破坏山核桃干腐病菌的细胞膜,导致膜内大量蛋白外漏,培养液中可溶性蛋白质量浓度增加。
过氧化物酶(POD)和过氧化氢酶(CAT)属于山核桃干腐病菌细胞内的保护酶体系,能够清除活性氧自由基、抵抗多种理化因子胁迫、减少活性氧积累、保持细胞膜结构的完整性,同时在阻断自由基链式反应中起着至关重要的作用[20-21]。本研究发现,POD和CAT活性随着药液质量浓度的增加活性逐渐下降,表现出显著抑制作用,再次说明3-甲氧基-4-羟基苯基-α-蒎烯马来酰亚胺基酰腙改变了山核桃干腐病菌细胞膜的通透性,从而影响到POD和CAT活性,抑制病原菌生长。
目前,关于有效防治山核桃干腐病的方法及其作用机理研究较少,利用活性优良的植物源杀菌剂代替传统的化学药剂是比较理想的。本研究对α-蒎烯衍生物的作用机理进行分析,表明药剂可能是通过改变菌丝体细胞膜的通透性,并且促进山核桃干腐病菌次级代谢产物产生,进而抑制菌丝体生长,但是具体的作用位点和分子水平上的关系有待进一步研究。
参考文献
[1]郑宏兵,束庆龙,丁之恩.山核桃溃疡病与营养元素的关系[J].经济林研究,2007,25(3):19-23.
[2]ZHANG C Q, XU B C. First report of canker on Chinese hickory (Caryacathayensis) caused byBotryosphaeriadothideain China[J]. Plant Disease,2011,95(10):1319.doi.org/10.1094/PDIS-05-11-0457.
[3]CARROL G. Fungal endophytes in stems and leaves: from latent pathogen to mutualistic symbiont[J]. Ecology,1998,69(1):2-9.
[4]张璐璐.山核桃干腐病流行规律及田间防治的研究[D].临安:浙江农林大学,2012.
[5]张传清,徐志宏,孙品雷,等.基于侵染特性的山核桃干腐病防治技术[J].中国森林病虫,2011,30(3):43-45,35.
[6]何益良,王黎明.α-蒎烯大气化学反应的研究进展[J].化学研究,2008,19(2):97-101.
[7]CZOKAJLO D, TEALE S A. Synergistic effect of ethanol toα-pinene in primary attraction of the larger pine shoot beetle,Tamicuspiniperda[J]. Journal of Chemical Ecology,1999,25(5):1121-1130.
[8]SEKINE T, SUGANO M, MAJID A, et al. Antifungal effects of volatile compounds from black zira (Buniumpersicum) and other spices and herbs[J]. Journal of Chemical Ecology,2007,33(11):2123-2132.
[9]PIDDOCK L J. Techniques used for determination of antimicrobial resistance and sensitivity in bacteria[J]. Journal of Applied Bacteriology,1990,68(4):307-318.
[10]NCCLS. Methods for dilution antimicrobial susceptibility tests for bacterict that grow aerobically; approved standard-ninth edition[M]. Clinical and Laboratory Standards Institute,2012,32(2):2162-2914.
[11]李少华.细辛对番茄早疫病菌的抑制作用及其活性成分的分离[J].中国农业大学学报,2011,16(3):67-71.
[12]程燕林.中国Botryosphaeriaceae真菌的系统发育及模式种Botryosphaeriadothidea的遗传多样性研究[D].北京:中国林业科学研究院,2012.
[13]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[14]张文平,傅颖媛,谢小梅.柠檬醛、肉桂醛抗曲霉菌作用机制研究[J].江西医学院学报,2003,43(6):10-13.
[15]黄卓烈,苏婷,巫光宏,等.甲醇对酵母过氧化氢酶活性的影响机理研究[J].中国生物工程杂志,2003,23(12):103-106,115.
[16]傅锦婷.山核桃干腐病的生物学特性与控制研究[D].临安:浙江农林大学,2014.
[17]SLIPPERS B, WINGFIELD M J. Botryosphaeriaceae as endophytes and latent pathogens of woody plants: diversity, ecology and impact[J]. Fungal Biology Reviews,2007,21(2/3):90-106.
[18]TAYLOR J W, JACOBSON D J, KROKEN S, et al. Phylogenetic species recognition and species concepts in fungi[J]. Fungal Genetics and Biology,2000,31(1):21-32.
[19]田甜,沈振明,徐秋芳,等.土壤中山核桃干腐病抑制菌的筛选和鉴定[J].浙江农林大学学报,2012,29(1):58-64.
[20]李响,刘征涛,沈萍萍,等.卤代酚类物质对抗氧化酶活性的影响研究及构效分析[J].环境科学学报,2004,24(5):900-904.
[21]SUTTON T B, ARAUZ L F. Influence of temperature and moisture on germination of ascospores and conidia ofBotryosphaeriadothidea[J]. Plant Disease,1991,75(11):1146-1149.
收稿日期:2015年12月7日。
第一作者简介:杨洋,男,1992年1月生,东北林业大学林学院,硕士研究生。E-mail:yangyangnefu1992@163.com。通信作者:刘雪峰,东北林业大学林学院,教授。E-mail:liuxuefeng63@sina.com。
1)国家林业局“948”项目(2014-4-08)。
责任编辑:程红。

