梅奥诊所/肾脏病理学会关于肾小球肾炎病理分类、诊断及报告共识
曾彩虹 译 刘志红 校[译自J Am Soc Nephrol,2016,27(5):1278-1287]
·医学继续教育·
梅奥诊所/肾脏病理学会关于肾小球肾炎病理分类、诊断及报告共识
曾彩虹 译 刘志红 校[译自J Am Soc Nephrol,2016,27(5):1278-1287]
肾小球肾炎(增生性病变)根据病因学和发病机制,分为5类:免疫复合物相关性肾小球肾炎、寡免疫复合物性肾小球肾炎、抗肾小球基膜肾炎、单克隆免疫球蛋白相关性肾小球肾炎和C3肾病。在病理诊断和报告时,采用标准化、统一的描述性语言和层次分明的疾病诊断体系,有助于肾小球肾炎的正确分类,指导临床用药和判断疾病预后。因此,2015年提出了“梅奥诊所/肾脏病理学会关于肾小球肾炎病理分类、诊断及报告共识”,为肾小球肾炎的诊断提供规范化指导。共识要求,病理最终诊断应包括主要诊断和次要诊断。主要诊断应包含病种(或损伤的类型)、病种的评分/分级/分类,如IgA肾病、狼疮性肾炎Ⅳ型、抗中性粒细胞胞质抗体相关性血管炎肾损害。次要诊断应单独列出,包含其他合并存在的、不足以导致主要诊断的病变,如IgA肾病为主要诊断的病理报告,尚需列出高血压肾损害、肥胖相关性肾病等次要诊断。此外,本共识对光镜、免疫荧光、电镜和其他辅助诊断手段的报告模式也提供了指导意见和标准化语言范本。本共识拟定了标准化的肾活检病理报告模式,以反映肾小球肾炎的病理生理机制。
肾小球肾炎 病理报告
2015年2月20日肾脏病理学家和肾病学家在梅奥诊所召开会议,针对目前肾脏病理报告尚缺乏统一的标准化模式,疾病诊断之间的层次关系亦缺乏统一性,不利于患者的治疗、转诊和随访,也限制了肾脏疾病诊疗机构之间临床病理数据的共享和对比。提出了基于病因学和发病机制的肾小球肾炎分类标准和标准化的肾小球肾炎病理报告模式。本文只是针对肾小球肾炎(增生性病变),不包括肾小球疾病的其他类型,如膜性肾病、足细胞病和血栓性微血管病等。
肾小球肾炎的病理分类
肾小球肾炎是指肾小球固有细胞增殖和(或)白细胞浸润引起的以肾小球细胞成分增多为特征的一类疾病。根据发病机制/致病类型,肾小球肾炎分为5类:免疫复合物相关性肾小球肾炎、寡免疫复合物性肾小球肾炎、抗肾小球基膜(GBM)肾炎、单克隆免疫球蛋白相关性肾小球肾炎和C3肾病(表1)。这一分类主要借助免疫荧光结果(或不太常用的免疫组化结果)为基础,并结合光镜和电镜结果进行。
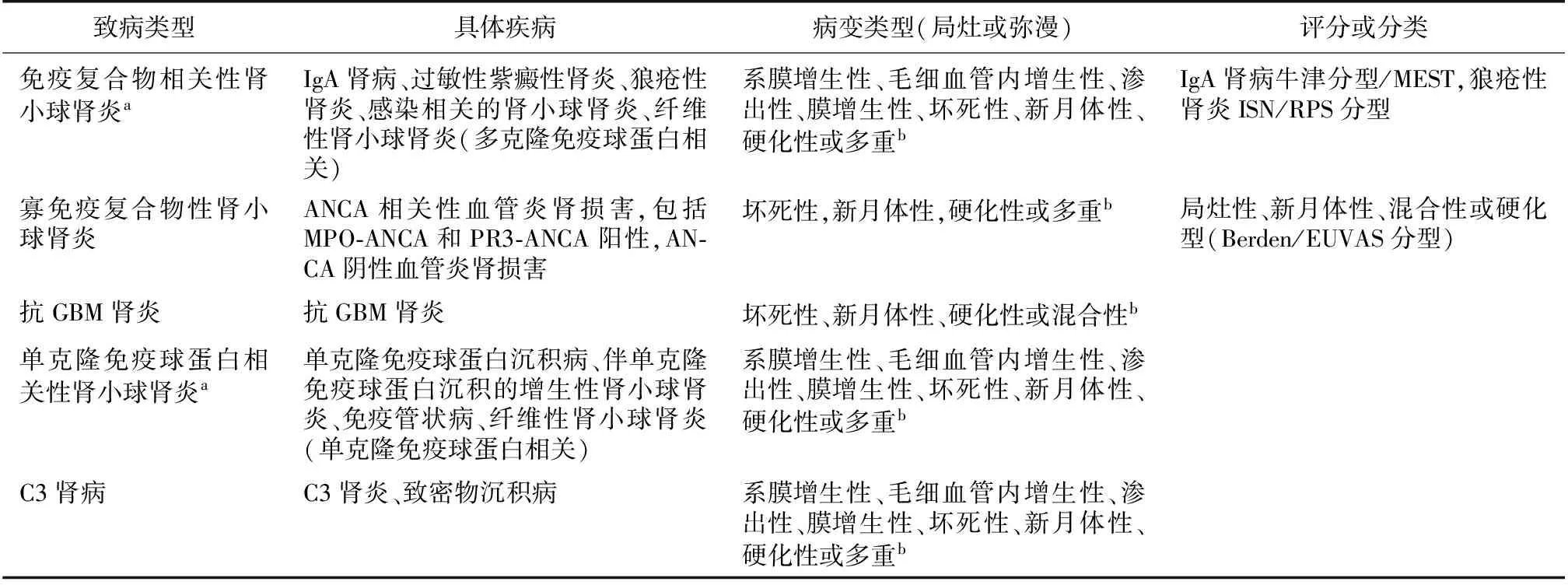
表1 肾小球肾炎分类
MEST:系膜增生,毛细血管内增生,节段硬化,间质纤维化/肾小管萎缩;ISN/PRS:国际肾脏病协会/肾脏病理协会;EUVAS:欧洲血管炎研究组;ANCA:抗中性粒细胞胞质抗体;MPO:髓过氧化物酶;PR3:蛋白酶3;GBM:肾小球基膜;a:部分病理医师使用免疫复合物介导的肾小球肾炎,单克隆免疫球蛋白相关的肾小球肾炎等,具体使用由病理医生自行裁定;b: 多重模式指的是两种或两种以上类型并存。病变类型必须描述(如局灶系膜增生性、新月体性和硬化性或弥漫坏死性、新月体性和硬化性)
免疫复合物相关性肾小球肾炎 主要特点是免疫荧光或免疫组化见多克隆的免疫球蛋白颗粒状或团块状沉积于肾小球系膜区、毛细血管袢内皮下、上皮侧,常伴补体沉积。免疫复合物沉积的类型和部位常与病因有关。这类疾病包括IgA肾病、过敏性紫癜性肾炎、狼疮性肾炎、纤维性肾小球肾炎、感染相关的肾小球肾炎及其他自身免疫性疾病导致的肾小球肾炎等。就目前认识而言,纤维性肾小球肾炎可能并不属于真正的免疫复合物相关性肾小球肾炎。无论是发展中国家还是发达国家,感染均是免疫复合物性肾小球肾炎的重要病因。肾小球光镜下病变的表现形式多样,包括无明显病变、系膜增生性病变、毛细血管内增生性病变、渗出性病变、膜增生性病变、坏死性或新月体性病变、硬化性病变,或以上各种形式的组合(如狼疮性肾炎可同时出现膜性病变和增生性病变)。
寡免疫复合物性肾小球肾炎 主要特点是免疫荧光或免疫组化无免疫球蛋白或仅少量免疫球蛋白沉积。80%~90%的患者血清抗中性粒细胞胞质抗体(ANCA)阳性,称为ANCA相关性血管炎肾损害,ANCA血清学阴性者则称为ANCA阴性血管炎肾损害。ANCA的主要靶抗原为髓过氧化物酶(MPO)和蛋白酶3(PR3),其他少见的包括弹性蛋白酶、组织蛋白酶G、溶菌酶相关膜蛋白2(LAMP-2)、乳铁蛋白和杀菌/通透性增强蛋白(BPI)。根据Chapel Hill共识,ANCA相关性血管炎肾损害分为微型多血管炎、肉芽肿伴多血管炎、嗜酸性粒细胞肉芽肿伴多血管炎。ANCA相关性血管炎肾损害的诊断应同时包括临床病理类型及相应的抗体类型(例如MPO-ANCA相关微型多血管炎)。
抗GBM肾炎 主要特点是免疫荧光或免疫组化见免疫球蛋白(通常是IgG)沿GBM呈线样沉积,有时伴C3沉积,偶有IgA线样沉积的报道。其沉积方式不同于免疫复合物相关性肾小球肾炎的颗粒状沉积和纤维性肾小球肾炎的污垢样沉积。可通过循环中抗GBM抗体的检测进行确诊。多数活动性的抗GBM肾炎表现为严重的坏死性和新月体性肾小球病变。≤25%抗GBM肾炎的患者同时伴循环中ANCA阳性。
单克隆免疫球蛋白相关性肾小球肾炎 主要特点是免疫荧光或免疫组化见单克隆免疫球蛋白在肾小球和(或)肾小管基膜沉积。其中部分患者与潜在的单克隆丙种球蛋白病/副球蛋白血症相关。光镜下最常见的肾小球病变是膜增生性病变,其他类型包括系膜增生性、弥漫增生性、坏死性、新月体性和硬化性病变等。这一类型中部分疾病在免疫荧光/免疫组化和电镜下具有一些特征性的病变,如单克隆免疫球蛋白沉积病、免疫管状肾小球病、少数纤维性肾小球肾炎也可伴单克隆免疫球蛋白的沉积。如果免疫荧光/免疫组化见单克隆免疫球蛋白沉积,电镜下见肾小球系膜区/毛细血管袢沉积物,而又缺乏明确病因,这类肾小球肾炎被称为伴单克隆免疫球蛋白沉积的增生性肾小球肾炎。
C3肾病 主要特点是免疫荧光或免疫组化肾小球以C3沉积为主,仅少量或不伴免疫球蛋白沉积。C3肾病与补体旁路途经调节异常有关。根据电镜超微结构特征,C3肾病分为致密物沉积病(DDD)和C3肾小球肾炎。C3肾病光镜下肾小球病变的表现形式多样,包括系膜增生性病变、弥漫毛细血管内增生性病变、膜增生性病变、坏死性和新月体性肾小球病变或硬化性肾小球病变等。
肾活检病理报告模式
肾活检病理报告包含以下几方面内容:标本类型、诊断(包括主要诊断和次要诊断)、评论、临床资料、大体描述、光镜描述、免疫荧光描述、电镜描述及其他特殊检查结果(表2)。

表2 肾活检病理报告模式
MEST:系膜增生,毛细血管内增生,节段硬化,间质纤维化/肾小管萎缩;ISN/PRS:国际肾脏病协会/肾脏病理协会
肾小球肾炎主要诊断规范
主要诊断(表3)包含3~4个部分,需依次进行描述:(1)疾病名称或发病机制/致病类型(疾病名称难以确定时);(2)肾小球病变类型;(3)肾脏病变的评分和分类(有需要时);(4)其他疾病相关的病理改变。存在两种致病机制导致的肾脏损害,可同时诊断,如ANCA相关性血管炎肾损害合并IgA肾病。下面分别介绍。
(1)首先是疾病诊断名称或发病机制/致病类型。如果疾病名称已经存在,则不需要发病机制/致病类型的诊断描述。
(2)其次是肾小球病变类型描述。肾小球病变可表现为局灶或弥漫,以及节段或球性。光镜下基本病理描述包括:基本正常、系膜增生性病变、渗出性病变、毛细血管内增生性病变、膜增生性病变、坏死性和新月体性病变、硬化性肾小球病变。注明新月体占肾小球的比例。列出同时存在的多种病变类型,不推荐将单一病变类型作为唯一主要诊断。肾小球病变类型的描述定义见表4。
(3)部分疾病需对病变进行评分和/或分级。如IgA肾病牛津分型/MEST评分,狼疮性肾炎ISN/RPS分型及ANCA相关性血管炎肾损害Berden/EUVAS预后分类。
(4)紧密联系临床实验室检查,在病理诊断的基础上增加临床潜在病因的提示。如免疫荧光以IgA沉积为主的感染后肾小球肾炎,提示可能为葡萄球菌感染,在临床提供了病原学及感染部位的情况下,需在报告中注明(如金黄色葡萄球菌蜂窝织炎相关)。抗GBM肾炎患者同时合并血清ANCA阳性,应诊断为抗GBM肾炎和ANCA相关血管炎肾损害。免疫复合物性肾小球肾炎光镜下表现膜增生性病变,免疫荧光为多克隆IgM/IgG沉积,临床存在丙型病毒性肝炎,应诊断为丙型病毒性肝炎相关;若丙型病毒性肝炎和冷球蛋白血症同时存在,应诊断为丙型病毒性肝炎合并冷球蛋白血症相关。单克隆免疫球蛋白性肾小球肾炎中,光镜见冷球蛋白血症的微管状物质沉积,免疫荧光为IgMκ阳性,患者临床存在华氏巨球蛋白血症时,应诊断为华氏巨球蛋白血症相关。
(5)其他需描述的病变包括肾小球球性硬化比例,间质纤维化/肾小管萎缩程度,血管病变包括动脉内膜硬化(动脉硬化)和小动脉内膜增厚及小动脉透明样变性。血管硬化程度可以用轻、中、重来表示。
这种肾脏病理报告模式对病因和发病机制具有提示性,报告标准化,不仅适合一些新的疾病,且方便录入数据库。尤为重要的是,便于对患者采取更具靶向性、基于发病机制的治疗。

表3 肾小球疾病诊断举例
ISN/PRS:国际肾脏病协会/肾脏病理协会;GBM:肾小球基膜; A/C:活动性/慢性
肾小球肾炎次要诊断规范
肾小球肾炎的次要诊断是指与主要诊断同时存在、但不构成主要诊断的病理改变。包括糖尿病肾病、薄基膜肾病等。当肾小球病变的病因与主要诊断相关,则应在主要诊断中一并描述,如狼疮性肾炎合并血栓性微血管病(表3,例2)。次要诊断还包括与主要诊断无关的肾小管间质病变或血管病变的描述,如药物导致的间质性肾炎、急性肾小管损伤、动脉粥样硬化栓塞性肾病等。如果间质炎症或急性肾小管损伤与主要诊断相关,则应在主要诊断中同时描述或在光镜报告中描述(如轻~中度炎症常与新月体肾炎和其他重症性肾炎伴随出现),但必须明确说明肾小管间质病变的程度及其在患者临床症状发生中所起的作用。
多数情况下肾小球肾炎是主要诊断,但部分病例的非增生性肾小球病变、肾小管间质病变或血管病变也可是主要诊断,而肾小球肾炎则反而成为次要诊断;甚至当诊断具有同等重要性时,可同时具有多个主要诊断(表3,例2)。
评论及建议
评论需总结肾活检组织病理改变,并讨论其可能的提示意义及与临床表现之间的联系。必要时亦需进行鉴别诊断,列举每个鉴别诊断的支持点、不支持点及最终倾向诊断的理由。并对疾病的评分/分级、预后和移植后复发的风险进行阐述。可以列上用于病理诊断描述的核心参考文献。
ISN/RPS:国际肾脏病协会/肾脏病理协会; GBM:肾小球基膜;a:除前两种病变类型外,多种病变类型常常可在一例标本中同时存在(根据ISN/RPS狼疮肾炎分型标准);b:新月体肾炎通常指新月体比例≥50%,该描述适用于免疫复合物性肾小球肾炎和C3肾病;而在抗中性粒细胞胞质抗体相关性血管炎肾损害和抗GBM肾炎诊断中,该比例可<50%
临床资料描述规范
病理报告中需包括简要的临床资料小结。包括患者年龄、性别、种族,临床表现是急性肾损伤还是慢性肾脏病,肾活检指征(如血尿、蛋白尿、肌酐升高或以判断预后为目的)等。记录相关的临床症状如易疲劳、水肿、气短、咯血、皮疹、感染等;合并症或合并疾病(如糖尿病、高血压、淋巴细胞增生性疾病),及用药史(包括过去的用药史)和疾病家族史等;血清肌酐、尿液分析、24h尿蛋白定量、血清补体水平、蛋白电泳、血生化、自身抗体(抗核抗体、抗ds-DNA抗体、ANCA滴度)及肝炎血清学指标,冷球蛋白水平;考虑感染的患者还应有微生物学检查指标。
病理描述规范
肾活检大体组织标本描述规范 分别描述送检光镜、免疫荧光及电镜的标本数量、大小及固定液种类。说明组织保存尤其保存不佳的情况(比如无固定液或固定液漏出导致组织太干),组织错放/误碰固定液的情况。
光镜描述规范 肾活检光镜检查所需观察的项目见表5。首先应描述病变的范围和程度,如病变是局灶或弥漫,节段或球性。重点观察并描述有无系膜增生,毛细血管内增生,毛细血管袢腔内白细胞浸润及浸润细胞的类型(单个核细胞、中性粒细胞抑或均同时存在),坏死性病变,核碎裂和/(或)新月体,毛细血管袢基膜和/(或)包囊壁断裂。新月体需区分其性质是细胞性、纤维细胞性抑或纤维性,判断新月体是节段还是环状体,计算新月体比例。观察肾小球是否呈分叶状,描述肾小球系膜区增宽程度及是否存在毛细血管袢基膜增厚,毛细血管袢腔内是否存在纤维素性血栓、透明血栓及白金耳,肾小球毛细血管袢基膜是否有空泡/小孔、钉突及双轨。

表5 肾活检光镜病变描述规范
肾小管间质病变描述包括有无间质炎细胞浸润、浸润细胞类型及有无肉芽肿形成,炎细胞浸润是否位于间质纤维化/肾小管萎缩区域,间质纤维化/肾小管萎缩的程度,即皮质区域间质纤维化/肾小管萎缩的比例。或将肾小管间质病变分为轻度(10%~25%)、中度(26%~50%)或重度(>50%),并在病变分级后标明具体比例。间质炎细胞(单个核细胞)浸润与间质纤维化/肾小管萎缩分布及所占比例一致时,不建议描述为慢性间质性肾炎,以避免临床误读为同时存在间质性肾炎。间质炎细胞在非间质纤维化/肾小管萎缩处浸润时,则考虑存在间质性肾炎,列为第二诊断,并在评论中进行鉴别诊断。血管病变描述包括动脉炎、TMA、高血压引起的动脉及小动脉硬化。动脉硬化分为轻、中及重度。
免疫荧光描述共识 肾活检免疫荧光病理观察的内容见表6。免疫病理常规染色项目包括IgG、IgA、IgM、C3、C1q、纤维蛋白、白蛋白、κ和λ轻链,需分别描述上述物质在肾小球、肾小管、间质及血管的分布及染色强度等特点。描述阳性分布情况包括局灶或弥漫、节段或球性分布,阳性的具体部位是系膜区、血管袢或两者均有。阳性的分布类型可描述为颗粒状、半线性(如沉积物位于肾小球毛细血管袢内皮下时,包括免疫复合物介导的膜增生性肾小球肾炎、表现为弥漫增生性病变的狼疮性肾炎)、粗颗粒状(如感染相关的肾小球肾炎)、线性(如抗GBM肾炎和单克隆免疫球蛋白沉积病)和污垢样(如纤维性肾小球肾炎)。肾小球节段硬化处常有IgM、C3和C1q节段毛细血管袢阳性,可不描述,或结合光镜肾小球节段硬化描述为肾小球节段毛细血管袢阳性,以避免误认为系膜区或毛细血管袢基膜沉积。大部分肾活检组织的血管均或多或少伴C3沉积,肾小管管腔内的管型κ、λ轻链及IgA阳性,可作为内部阳性对照。
免疫复合物性肾小球肾炎表现为免疫球蛋白和/或补体沉积,其沉积的类型、强度和分布是诊断关键。IgA肾病表现为肾小球IgA系膜区沉积为主;狼疮性肾炎表现为多种免疫球蛋白(包括IgG、IgA、IgM)沉积于肾小球系膜区和血管袢,干燥综合征表现为IgG/IgM沉积;感染相关的肾小球肾炎,细菌感染通常IgG/IgM沉积于血管袢,葡萄球菌感染则以IgA沉积为主,病毒感染IgM/IgG沉积。C3、C1q伴随免疫球蛋白沉积。

表6 免疫荧光描述规范
寡免疫复合物性肾小球肾炎,免疫球蛋白和补体的沉积强度为阴性~1+,坏死区域可达2+。若染色强度≥2+,或非坏死区域存在≥2+的IgA、IgG沉积,则需考虑两种疾病合并存在(如ANCA相关性肾小球肾炎合并IgA肾病,ANCA相关性肾小球肾炎合并膜性肾病)。肾小球坏死和(或)新月体处可见纤维蛋白原沉积。
抗GBM肾炎表现为IgG弥漫性沿GBM线状沉积,κ和λ的分布和染色强度与IgG类似。极少数情况下,可见单克隆IgG线状沉积,IgA线状沉积则提示IgA型抗GBM抗体。C3通常半线状半颗粒状沿血管袢分布。为了避免混淆,糖尿病肾病的线状沉积称为类线状沉积,主要为IgG和白蛋白。
单克隆免疫球蛋白沉积性肾小球肾炎是指肾小球单一类型免疫球蛋白沉积,沉积的单一重链以IgG最常见,IgM其次,IgA罕见,单一轻链为κ或λ。少数情况亦见单一重链或单一轻链。IgA肾病λ沉积显著强于κ,不能误以为单克隆免疫球蛋白疾病。常伴颗粒状C3沉积。
肾小球仅有C3沉积,或C3沉积强度超过所有其他免疫球蛋白及补体(如3+vs1+,2+vs±),应考虑C3肾病或感染后肾小球肾炎。
其他非特异沉积包括肾小球节段瘢痕或节段硬化处C3和IgM沉积,ANCA相关性血管炎纤维素样坏死处IgG沉积,大量蛋白尿时IgG和(或)IgA在足细胞胞质内形成蛋白吸收滴,有时误判为免疫复合物沉积而误诊为免疫复全物性肾小球肾炎,病理医师在判断时应加以鉴别,并结合光镜发报告。而免疫复合物性肾小球肾炎在缺血或硬化的肾小球免疫球蛋白染色可呈阴性。
电镜描述规范 虽然多数肾小球肾炎通过光镜、免疫荧光或免疫组化即可明确诊断,但约20%的肾活检病理在缺乏电镜的情况下无法明确诊断,而且几乎都是肾小球疾病,因此自体肾活检均需取肾皮质进行电镜检查。电镜检查可观察是否有合并情况,以免漏诊(如早期糖尿病肾病)。技术员需在病理医生观察电镜半薄切片后进行定位。应选择与光镜下病变一致并具有代表性的肾小球行电镜检查,尽量避免球性或大部分节段硬化或缺血的肾小球。电镜组织无肾小球或仅见硬化/缺血的肾小球时,而需电镜明确诊断时,尽可能采用石蜡组织进行电镜观察,但石蜡组织电镜具有局限性,超微结构严重破坏,仅电子致密物观察尚可。如果通过光镜和免疫荧光/免疫组化能明确诊断,则可省略这一步骤,因为石蜡组织本身的局限性不可能对诊断提供额外的信息(如GBM厚度的测量)。
电镜报告描述包括取材组织块数目,切块数目,半薄切片下肾小球总数,球性硬化和节段硬化的肾小球数,其他病变(如新月体)的肾小球数,肾小管间质和血管病变也应描述。肾小球肾炎的电镜报告描述规范见表7。

表7 电镜报告描述规范
电镜有助于确定沉积物的部位和超微结构特点,对免疫复合物相关性肾小球肾炎、C3肾小球病、单克隆免疫球蛋白相关性肾小球肾炎鉴别具有重要意义。肾小球毛细血管内增生及膜增生性病变沉积物常位于肾小球基膜内皮下,基膜内和(或)上皮侧,系膜增生性病变则以系膜区沉积为主。上皮侧“驼峰”样沉积见于感染后肾小球肾炎和C3肾病。电镜也是鉴别DDD和C3肾小球肾炎的重要手段。DDD表现为GBM内连续或间断致密的高密度电子致密物沉积,系膜区、包囊壁和肾小管基膜亦见类似电子致密物。而C3肾炎电子致密物多数沉积于肾小球系膜区和内皮下,有时也分布于基膜内和上皮侧。部分患者电子致密物和基膜样物质多层分布,导致GBM增厚。单克隆免疫球蛋白相关性肾小球肾炎的电镜表现多样,伴单克隆免疫球蛋白沉积的增生性肾小球肾炎见肾小球系膜区、多数内皮下、少数上皮侧电子致密物。单克隆免疫球蛋白沉积病可见肾小球系膜区、基膜和肾小管基膜点状或细颗粒状电子致密物沉积。纤维性肾小球肾炎沉积物特点是无分支、排列紊乱的纤维丝,直径一般15~24 nm。免疫管状肾小球病可见直径20~60 nm的微管状结构,常平行排列。弯曲微管状结构见于冷球蛋白血症,指纹状结构或管网状包涵体提示狼疮性肾炎,ANCA相关性血管炎和抗GBM肾炎少或无电子致密物沉积,可见肾小球纤维素样坏死和新月体。
辅助检查表述共识 在常规光镜、荧光和电镜的基础上,对于部分疾病需要进行一些辅助检查来明确诊断或分型。包括石蜡组织切片经链霉蛋白酶消化后进行免疫荧光染色(或石蜡组织免疫组化染色),免疫荧光IgG亚型测定, C4d染色,质谱分析确定沉积物的成分等。上述辅助检测对诊断的提示意义程度分为:强(A:明确有助于诊断或预后判断),中等(B:很可能有助于诊断或预后判断),弱(C:可能有助于诊断或预后判断)和诊断意义不明(U:对诊断或预后判断证据尚不足)。下面列举一些辅助诊断的推荐强度如下:
IgG亚型染色(即IgG1、IgG2、IgG3和IgG4)对诊断单克隆免疫球蛋白IgG的增生性肾小球肾炎,推荐强度为:A;
临床提示单克隆丙种球蛋白血症,同时怀疑肾组织有单克隆免疫球蛋白沉积,但常规冰冻组织免疫荧光染色阴性,电镜观察到电子致密物沉积,此时进行石蜡包埋组织免疫荧光染色,推荐强度为:C;
C4d染色:鉴别免疫复合物性肾小球肾炎和C3肾病,推荐强度:B;
C4d染色:用于判断IgA肾病预后的标志物,推荐强度:C。
质谱分析沉积物的组成,推荐强度:U。
本共识提出增生性肾小球肾炎的病理分类、诊断和报告描述共识。肾活检病理报告应基于病因和发病机制,包括主要诊断即病理类型或致病原因、损伤类型、疾病的评分或等级,以及和原发疾病直接相关的其他发现,独立的第二诊断。规范了光镜、免疫荧光、电镜和辅助检查报告模式。对提高肾小球肾炎诊断水平和指导临床治疗和判断预后具有重要意义。
从略
(致谢:吴燕、张炯、梁丹丹、徐峰、梁少姗和安玉参与文稿的翻译)
(本文编辑 心 平)
10.3969/cndt.j.issn.1006-298X.2016.03.013
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-06-01
编者按 肾小球肾炎是肾脏疾病的主要类型,其病因及病理改变复杂多样,目前对于肾小球肾炎病理报告缺乏统一的标准化模式,疾病诊断之间的层次关系亦缺乏统一性,不利于患者的治疗、转诊和随访,也限制了肾脏疾病诊疗机构之间临床病理数据的共享和对比。根据病因学和发病机制对肾小球肾炎(增生性病变)进行分类,有助于指导临床用药和判断预后。2015年2月20日肾脏病理学家和肾病学家在梅奥中心举行会议,提出据于病因学和发病机制将肾小球肾炎分为5类。在病理诊断和报告时,采用标准化、统一的描述性语言和层次分明的疾病诊断体系,最终达成了“梅奥诊所/肾脏病理学会关于肾小球肾炎病理分类、诊断及报告共识”。为了增进对这一共识的认识, 并在实际工作中推广应用, 现将这一共识译为中文供大家学习参考。

