二-2-苯基吡啶-2-(5-醛苯基)吡啶金属铱(Ⅲ)配合物的合成,晶体结构及光电性质研究
邓 阳,黄华容,张 焜
(广东工业大学轻工化工学院,广东 广州 510006)
二-2-苯基吡啶-2-(5-醛苯基)吡啶金属铱(Ⅲ)配合物的合成,晶体结构及光电性质研究
邓 阳,黄华容,张 焜
(广东工业大学轻工化工学院,广东 广州 510006)
以4-(2-吡啶基)-苯甲醛(fppy)和2-苯基吡啶(ppy)为配体合成了一个中性金属铱(Ⅲ)配合物Ir(ppy)2(fppy),通过单晶X-射线衍射分析法测定了晶体结构,并通过元素分析、质谱、核磁等表征手段对配合物进行了结构表征。研究了室温下配合物的紫外-可见吸收光谱,荧光发射光谱及寿命等光物理性质,此外还利用循环伏安法对配合物的电化学性质进行了研究。
铱(Ⅲ)配合物;合成;荧光;晶体结构
铱(Ⅲ)配合物具有高的发光量子效率,通过对配体的修饰能够有效调控吸收光谱和发光光谱的范围,良好的稳定性及相对长的激发态寿命等特点,已经成为科学研究的一个热点课题[1]。金属铱配合物在在显示器件、生物成像、化学传感、有机光伏、非线性光学和手性催化等多个领域都有着潜在的应用前景和市场价值[2-8]。
目前中性铱(Ⅲ)配合物Ir(ppy)3作为公认有效的光敏剂广泛应用于光敏化领域,而发展新的铱配合物和结构修饰是这类材料的未来研究重点方向[9]。而醛基是一个十分活泼的有机官能基团,它很容易与醛类、酮类、胺类等多种化合物反应,从而可以通过与醛基作用引入其他功能基团,获得各种功能配合物。为此,设计合成了一种带有醛基的中性环状铱(Ⅲ)配合物Ir(ppy)2(fppy),通过晶体X射线衍射法确定了其结构,并初步研究了其光电性质。
1 实验部分
1.1 试剂与表征
三水合氯化铱、邻二氯苯、2-苯基吡啶、4-(2-吡啶基)-苯甲醛、乙二醇乙醚、四氟硼酸银购自阿拉丁化学试剂有限公司,其他试剂和溶剂购自广州化学试剂厂。
核磁共振谱在瑞士Bruker AVANCE Ⅲ 400 MHz型核磁共振波谱仪,TMS为内标;氘代试剂为CDCl3,DMSO-d6和Methanol-D4。样品的C、N、H含量在德国Elementar公司的Vario EL cube元素分析仪上测定。质谱采用日本岛津LCMS-2010A液相色谱质谱联用仪测定。溶液紫外-可见吸收光谱是在美国珀金埃尔默公司PerkinElmer Lambda 25 紫外可见分光光度计上测定,荧光发射光谱和瞬态寿命是在法国Horiba Jobin-Yvon公司Horiba JY FL-3光谱仪上测定。样品的循环伏安曲线是以Ag/AgNO3电极为参比电极、玻碳电极为工作电极、Pt丝为对电级,测试前使用二茂铁为标准物进行电位标定,电解质溶液为0.1 mol/L四丁基六氟憐酸铵的超干乙腈溶液,配合物溶度为10-3mol/L的超干乙腈溶液在上海华辰CHI620E 电化学工作站测得。扫描速度为 100 mV·S-1。在测试前,通氩气鼓泡15 min除氧。
1.2 配合物Ir(ppy)2(fppy)的合成与表征
按照文献[10],在氩气保护下,将IrCl3·3H2O(393 mg, 1.0 mmol)和2-苯基吡啶(341 mg, 2.2 mmol)加入到20 mL乙二醇乙醚/水(体积比为3∶1)混合溶剂中,在130 ℃避光回流反应24 h。待溶液静止冷却到室温后,向溶液中加入50 mL去离子水,大量黄色沉淀析出,抽滤,依次用去离子水和乙醇洗涤数次后真空干燥得到黄色双核氯桥联产物Ir2(ppy)4Cl2(375 mg,产率为70.5%)。将双核中间产物氯桥联铱(375 mg, 0.35 mmol)和四氟硼酸银(144 mg, 0.74 mmol)溶于20 mL无水乙腈中,在50 ℃避光反应24 h。待溶液静止冷却到室温后,抽滤,依次用水和乙醇洗涤数次后真空干燥得到黄色中间产物中Ir(ppy)2(CH3CN)2(BF4)(462 mg,产率92.5%)。氩气保护下,将Ir(ppy)2(CH3CN)2(BF4)(356 mg, 0.5 mmol)和4-(2-吡啶基)-苯甲醛(110 mg, 0.6 mmol)加入到10 mL邻二氯苯中,在110 ℃避光反应24 h。待溶液冷却到室温后溶液在硅胶柱中用二氯甲烷和甲醇(体积比为50∶1)为洗脱剂进行柱层析分离,收集红色流段,真空干燥后得到红色固体产物Ir(ppy)2(fppy) (96 mg,产率28%)。元素分析(C34H24ON3Ir)(理论值w/%): C,59.81%; H, 3.54%; N,6.15%; 实验值:C,58.28%; H,3.75%; N,6.00%。1H NMR (400 MHz, CDCl3)δ:9.62(s, 1H), 7.88(d, 8.0 Hz, 1H), 7.81(d, 7.3 Hz, 2H), 7.67(d, 8.0 Hz, 2H), 7.61~7.57(m,3H), 7.53(d, 5.9 Hz, 3H), 7.46(d, 5.4 Hz, 2H), 7.41(d, 5.0 Hz, 1H), 7.37(dd,8.1 Hz, 1.4, 1H), 7.22(s, 1H), 6.92~6.84 (m, 3H), 6.83~6.78(m, 4H)。13C NMR(100 MHz, CDCl3)δ:193.58(s), 165.67(s), 164.34(s), 148.95(s), 146.49(s), 146.05(s), 145.94(s), 142.65(s), 142.50(s), 140.43(s), 136.14(s), 136.01(s), 135.47(s), 135.24(s), 135.16(s), 129.19(s), 128.97(s), 123.11(s), 123.01(s), 122.27(s), 121.01(s), 120.93(s), 119.29(s), 119.06(s), 117.95(s), 117.89(s)。 MS (ESI)m/z: 682.95(M+H+), 706.15(M+Na+), 721.80(M+K+)。

图1 配合物Ir(ppy)2(fppy)的合成路线Fig.1 Synthetic route of Ir(ppy)2(fppy)
2 结果分析与讨论
2.1 晶体结构测定与分析
将铱配合物Ir(ppy)2(fppy)溶于少量氯仿,然后加入大量正己烷溶液,放置在冰箱中,两周后获得橙红色块状晶体。
选取大小合适的单晶,于150 K下,在带有镜面单色器的Agilent Technologies Gemini A Ultra 面探衍射仪上进行衍射实验。用Cu/Kα辐射 (λ= 0.154 178 nm), 以ω/(2θ),扫描方式收集数据。数据的吸收校正使用SADABS程序[11]。空间群根据系统的消光规律确定,并由精修结果验证。所有的晶体结构均使用SHELXS-97程序[12],由直接法解出,用SHELXL-97程序以全矩阵最小二乘法修正结构[13],氢原子坐标由理论计算加入。铱配合物的晶体结构参数、选择性键长键角见表1和表2。
铱配合物的晶体结构如图2所示,不对称单元含有一个氯仿溶剂分子。铱离子中心采取八面体配位构型,分别与来自两种3个(C∧N)2-苯基吡啶类配体采取面式配位。其中4-(2-吡啶基)-苯甲醛上的醛基氧原子与来自氯仿分子的碳原子形成弱的氢键(0.305 7(3)nm),同时氯仿分子的3个氯原子与临近的碳原子存在一定的碳-氯键进一步稳定了这一溶剂包结结构。
2.2 光物理性质
图3是配合物在二氯甲烷和甲醇溶液中的紫外-可见吸收光谱。配合物在220~300 nm区间有很强的紫外吸收峰,可归属为配体芳环的π-π*跃迁。在波长大于400 nm的可见区有很弱的吸收,摩尔吸光系数小于1×104L·mol-1·cm-1,这是典型的传统Ir(Ⅲ)配合物的吸收,这些吸收可能来自自旋允许的单线态金属到配体的电荷跃迁(1MLCT)以及配体到配体的电子跃迁(1LLCT)

图2 铱配合物的晶体结构图Fig.2 Crystal structure of Ir(ppy)2(fppy) with 30% thermal ellipsoids

ComplexIr(ppy)2(fppy)ChemicalformulaC35H25ON3Cl3IrMolecularweight802.13crystalsystem,spacegroupmonoclinic,Ia(Cc)a/nm1.85199(2)b/nm0.88466(1)c/nm1.85841(2)α/(°)90β/(°)96.166(1)γ/(°)90V/nm3,Z3027.17(6),4F(000)1568.0Crystalsize/mm0.40×0.40×0.30reflectionscollected/unique(Rint)37565/5233(0.0458)Dc/(Mg·m-3)1.760μ/mm-111.246goodness-of-fitonF21.032FinalRindices[(I≥2σ(I))R1,wR1)20.0252,0.0618Rindices(alldata)R1,wR20.0263,0.0627Largestdiff.peak,hole/(e·nm-3)0.850,-0.000730
1)R1= ∑‖F0|-|Fc‖/∑|F0|;
w= 1/[σ2(F0)2+ (0.038 3P)2+ 8.570 2P];
的贡献[14-15]。也可能有自旋禁阻的三线态金属到配体的电荷跃迁(3MLCT)、自旋禁阻的三线态配体到配体的电荷跃迁(3LLCT)及配体本身的3π-π*,由于铱的重原子效应,原来自旋禁阻的3MLCT、3LLCT和配体本身的3π-π*跃迁也变得部分允许,在吸收光谱中表现出一定的吸收强度[16-17]。在极性溶剂甲醇溶液中配合物n-π*吸收带(R带)最大吸收波长蓝移(282→278nm),εmax随之增加,π-π*吸收带(K带)最大红移(228→242 nm),εmax略有减少。
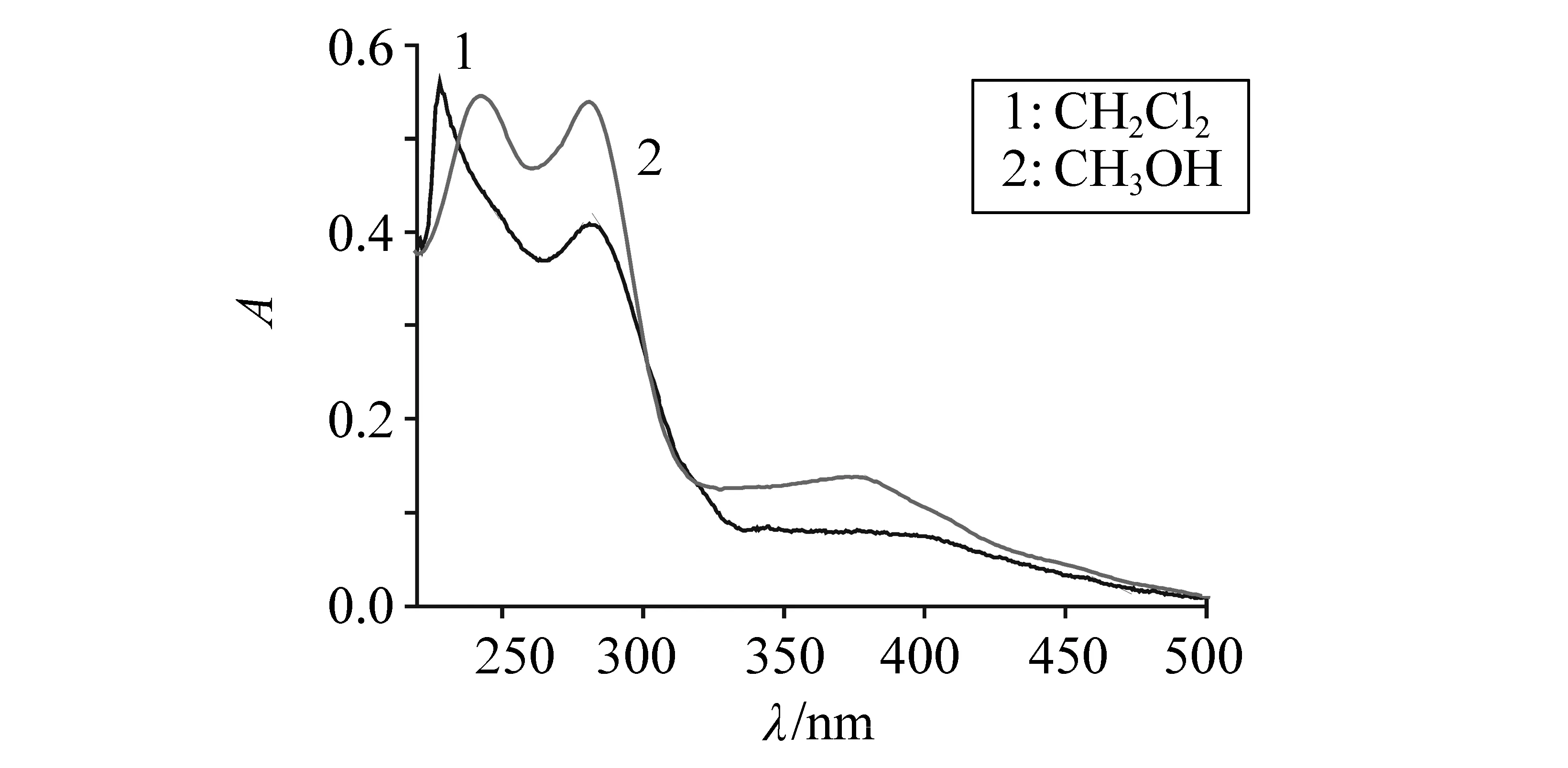
图3 配合物的紫外-可见吸收光谱Fig.3 UV-Vis absorption spectra of Ir(ppy)2(fppy)
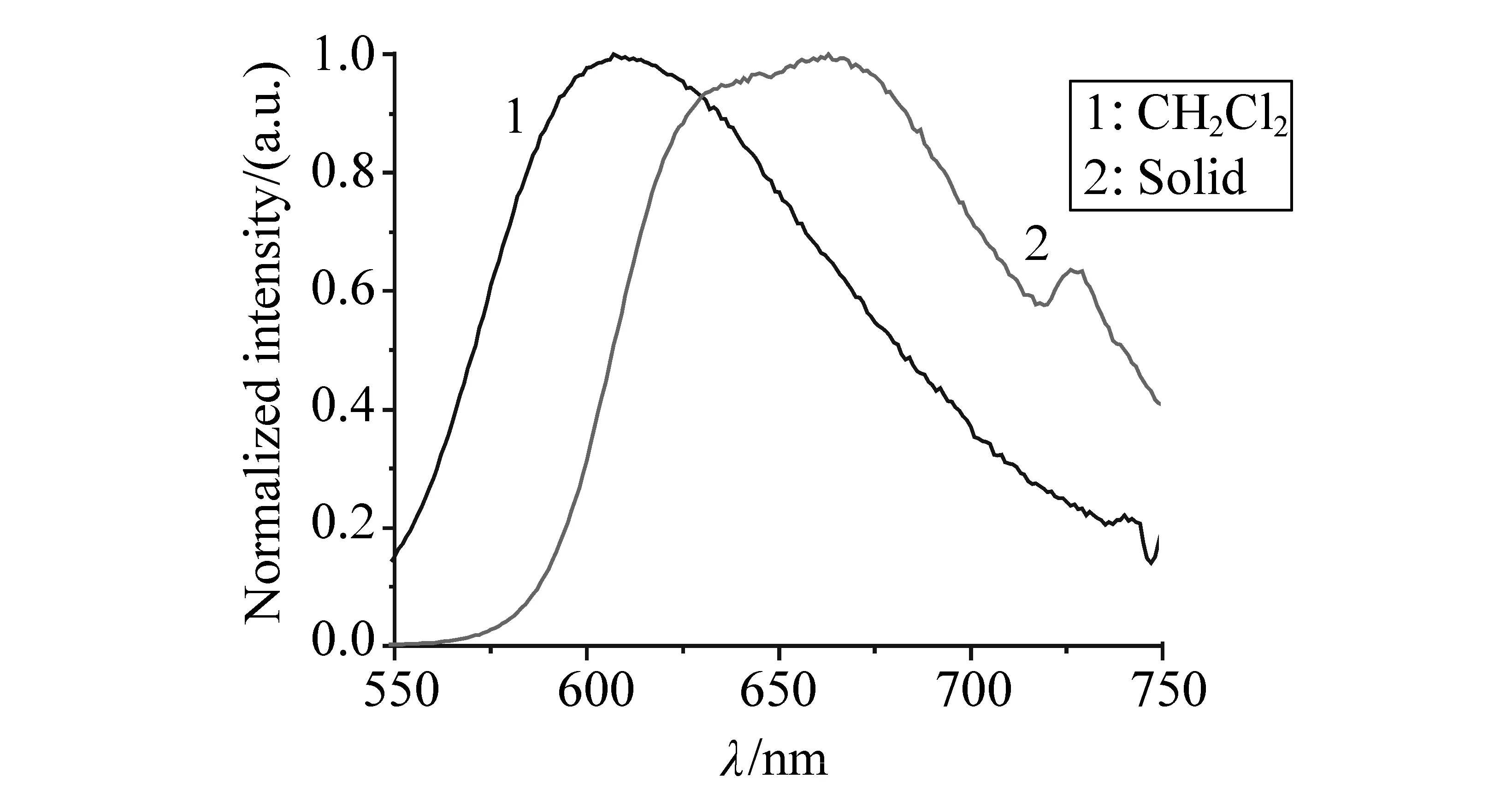
图4 配合物的荧光发射光谱Fig.4 PL spectra of Ir(ppy)2(fppy)
图4为配合物在二氯甲烷和固体状态下的发射光谱图。室温下,对配合物用MLCT吸收带激发,得到了配合物的发射光谱。配合物的发射光谱来源于配体木身的π-π*跃迁和3MLCT或3LLCT电荷转移跃迁,这也和紫外吸收光谱相对应。在二氯甲烷溶液中,配合物的最大发射波长分别为607 nm,配合物的固体最大发射波长则为663 nm,发射峰值发生了明显的红移,这是由于分子平面作用和分子间相互影响的结果。溶液中的分子的活动是相对自由的,而在固态中将以平面的形式存在,限制了分子的灵活性,分子平面作用直接致使π电子离域化具有强烈的π-π堆积效应(π-π stack effect),这种分子间作用影响电子能级分布导致了发光了红移[18]。
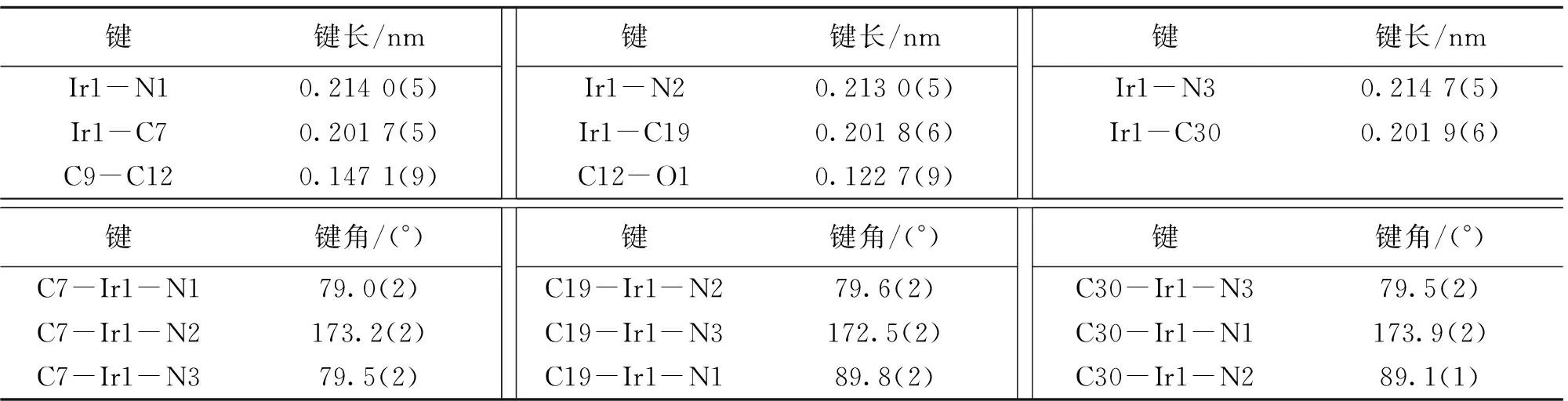
表2 铱配合物的部分键长和键角Table 2 Selected bond distances and angles of Ir(ppy)2(fppy)
在常温空气中,配合物在二氯甲烷溶液中的瞬态寿命为9.60 ns(50.6%) 和91.3 ns(49.4%),固体瞬态寿命为0.74 ns(10.26%)和152.7 ns(89.74%)。将配合物Ir(ppy)2(fppy)在溶液和固体下的光物理性质列在了表3中。

表3 配合物的光物理性质Table 3 Photophysical properties of Ir(ppy)2(fppy)
1)括号中的数值为ε/(10-4·L·mol-1·cm-1)
2)括号中的数值为样品对应波长组分寿命值与总寿命的百分比
2.3 电化学性质
图5为配合物Ir(ppy)2(fppy)的循环伏安(CV)曲线。配合物Ir(ppy)2(fppy)在乙腈溶液中发生可逆的氧化过程和不可逆的还原过程,其氧化电位与还原电位分别为1.16 V和-1.06 V(相比氢标准电极)。铱配合物的氧化过程通常发生在金属中心和(或)Ir-C的σ键轨道[19-20],还原峰来自于配体本身的还原。以二茂铁的费米能级4.8 eV为参照,根据循环伏安测试数据可以推算出配合物Ir(ppy)2(fppy)最高分子占据轨道(HOMO)能级为-5.96 eV,最低分子未占据轨道(LUMO)能级分别为-3.74 eV,从而计算得出其带隙为2.22 eV。

图5 配合物的循环伏安曲线Fig.5 Cyclic voltammograms of Ir(ppy)2(fppy)
本文设计合成了一种带醛基官能团的中性铱(Ⅲ)配合物Ir(ppy)2(fppy),测定了其晶体结构。从紫外-可见吸收光谱发现,在不同极性溶剂中的吸收特点并不相同。配合物在二氯甲烷中发橙光,在固体状态下由于强烈的π-π堆积效应发光波长红移而发红光。配合物的瞬态寿命在0.74~152.7 ns之间,通过循环伏安法可以测得各产物的氧化还原电位,并计算出它们的HOMO能级和LUMO能级,计算得到其带隙为2.22 eV。
[1] CHI Y, CHOU P T. Transition-metal phosphors with cyclometalating ligands: fundamentals and applications [J]. Chem Soc Rev, 2010, 39(2): 638-655.
[2] XIAO L, CHEN Z, GONG Q, et al. Recent progresses on materials for electrophosphorescent organic light-emitting devices [J]. Adv Mater, 2011, 23(8): 926-952.
[3] XIONG L, ZHAO Q, CHEN H, et al. Phosphorescence imaging of homocysteine and cysteine in living cells based on a cationic iridium(Ⅲ) complex [J]. Inorg Chem, 2010, 49(14): 6402-6408.
[4] ZHAO Q, LIU S, LI F, et al. Multisignaling detection of Hg2+based on aphosphorescent iridium(Ⅲ) complex [J]. Dalton Trans, 2008 (29): 3836-3840.
[5] SCHULZ G L, HOLDCROFT S. Conjugated polymers bearing iridium complexes for triplet photovoltaic devices [J]. Chem Mater, 2008, 20(16): 5351-5355.
[6] HO C L, WONG K L, KONG H K, et al. A strong two-photon induced phosphorescent golgi-specific in vitro marker based on a heteroleptic iridium complex [J]. Chem Commun, 2012, 48(19): 2525-2527.
[7] CHEN L A, XU W, HUANG B, et al. Asymmetric catalysis with inert chiral-at-metal iridium complex [J]. J Am Chem Soc, 2013, 135(29):10598-10601.
[8] TIAN C, GONG L, MEGGERS E. Chiral-at-metal iridium complex for efficient enantioselective transfer hydrogenation of ketones [J]. Chem Commun, 2016, 52(22): 4207-4210.
[9] 廖章金, 朱彤珺, 密保秀, 等. 小分子铱配合物及其电致发光 [J]. 化学进展, 2011, 23(8): 1627-1643.
[10] WHANG D R, SAKAI K, PARK S Y. Highly efficient photocatalytic water reduction with robust iridium(Ⅲ) photosensitizers containing arylsilyl substituents [J]. Angew Chem Int Ed, 2013, 125(44): 11826-11829.
[11] SHELDRICK G M SADABS. Program for empirical absorption correction of area detector data[M]. Göttingen: University of Göttingen, 1996.
[12] SLUIS P van der, SPEK A L. BYPASS: an effective method for the refinement of crystal structures containing disordered solvent regions [J]. Acta Cryst, 1990, A46, 194-201.
[13] SHELDRICK G M. SHELXS 97, Program for crystal structure refinement[M].Göttingen :University of Göttingen, 1997.
[14] LALEVE J, PETER M, DUMUR M, et al. Subtle ligand effects in oxidative photocatalysis with iridium complexes: application to photopolymerization[J]. Chem Eur J, 2011, 17(52): 15027-15031.
[15] LICINI M, WILLIAMS J A G. Iridium(Ⅲ) bis-terpyridine complexes displaying long-lived pH sensitive luminescence [J]. Chem Commun, 1999(19):1943-1944.
[16] SERGEY L, PETER D, DREW M, et al. Highly phosphorescent bis-cyclometalated iridium complexes: synthesis, photophysical, characterization, and use in organic light emitting diodes [J]. J Am Chem Soc, 2001, 123(52):4304-4312.
[17] AUFFRANT A, BARBIERI A, BARIGELLETTI F,et al. Dinuclear iridium(Ⅲ) complexes consisting of back-to-back tpy-(ph)n-tpy bridging ligands (n= 0, 1, or 2) and terminal cyclometallating tridentate N^C^N ligands [J]. Inorg Chem, 2006, 45(26): 10990-10997.
[18] 胡丽华,黄志斌,纪顺俊,等.固体荧光的测试方法 [J]. 仪器分析,2011(5): 55-58.
[19] WILKINSON A J, PUSCHMANN H, HOWARD J A K, et al. Luminescent complexes of iridium(Ⅲ) containing N^C^N-coordinating terdentat Ligands [J]. Inorg Chem., 2006, 45(21): 8685-8699.
[20] ZHAO Q, LIU S J, SHI M, LI F Y, et al.Tuning photophysical and electrochemical properties of cationic iridium(Ⅲ) complex salts with imidazolyl substituents by proton and anions [J]. Organometallics, 2007, 26(24): 5922-5930.
Synthesis, structure, photoluminescence and electrochemical properties of one netural iridium (Ⅲ) complex Ir(ppy)2(fppy)
DENG Yang, HUANG Huarong, ZHANG Kun
(School of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China)
One neutral iridium (Ⅲ) complex Ir(ppy)2(fppy) (ppy = 2-phenylpyridine, fppy = 4-(2-pyridinyl)benzaldehyde) was synthesized, and the structure was characterized by single crystal X-ray diffraction analysis as well as EA, MS and NMR. The photophysical property of the complex was studied by UV-visible absorption spectroscopy, fluorescence emission spectroscopy and the fluorescence lifetime both in solid state and solution at room temperature. In addition, the electrochemical property of the complex was studied by cyclic voltammetry.
iridium (Ⅲ) complex; synthesis; photoluminescence; crystal structure
10.13471/j.cnki.acta.snus.2016.05.014
2016-04-05
国家自然科学基金资助项目(21102020)
邓阳(1990年生),男;研究方向:超分子化学;通讯作者:黄华容;E-mail:hrhuang@gdut.edu.cn
O634
A
0529-6579(2016)05-0077-06

