miR-217通过靶向14-3-3ν抑制胃癌转移的作用及机制研究*
雷微 邓明明
(四川医科大学附属第一医院消化科, 四川 泸州 646000)
·论著·
miR-217通过靶向14-3-3ν抑制胃癌转移的作用及机制研究*
雷微邓明明
(四川医科大学附属第一医院消化科, 四川 泸州 646000)
【摘要】目的探讨miRNA-217(miR-217)抑制胃癌细胞转移的作用及其机制。方法qRT-PCR法比较胃癌组织、癌旁组织、胃癌细胞系和正常胃上皮细胞中miR-217的表达差异。转染miR-217 mimics或Inhibitors后,通过Transwell侵袭实验观察miR-217的胃癌细胞转移能力的影响;建立裸鼠尾静脉转移模型,观察稳定表达miR-217在体内对胃癌转移能力的影响;生物信息学分析miR-217的候选靶基因为14-3-3ν,荧光素酶报告基因实验检测SGC7901细胞中miR-217过表达对野生型和突变型14-3-3ν荧光素酶活性的影响。Western blot检测miR-217对14-3-3ν野生型和突变体蛋白表达的影响。结果miR-217在胃癌组织中的表达明显低于癌旁组织(P<0.01);在各胃癌细胞中的表达量较正常胃上皮细胞GES显著降低(P<0.01)。miR-217 mimics抑制SGC7901细胞的侵袭能力,与阴性对照的差异有统计学意义(P<0.01)。而miR-217 inhibitors明显促进SGC7901细胞的侵袭能力(P<0.01);体内实验发现稳定过表达miR-217的SGC7901细胞转移能力明显降低。荧光素酶报告基因结果证实miR-217能够抑制14-3-3ν的3′-UTR区荧光素酶活性;Western blot结果显示转染miR-217后,SGC7901细胞中的14-3-3ν蛋白水平明显低于对照组;Western blotting结果显示miR-217过表达显著抑制14-3-3ν-wt,而不能抑制14-3-3ν-mut的蛋白表达。结论miR-217能够通过靶向14-3-3ν抑制胃癌转移,促进miR-217的表达或抑制14-3-3ν的表达可能是抑制胃癌转移的有效手段。
【关键词】胃癌;转移;微小RNA;微小RNA-217;14-3-3ν
胃癌是我国的主要恶性肿瘤之一,占肿瘤相关死亡人数占42.5%,是各类癌症死亡率的第三位[1]。大多数患者发现胃癌时已发生临近器官或者远处转移,成为胃癌患者的主要死因。微小RNA(miRNA,miR),即20-24个核苷酸的是近年来发现的一类通过与靶基因的mRNA发生特异性结合而发挥转录后负性调控作用的非编码小RNA[2]。多种miRNA已被证实通过调控下游靶基因,在胃癌侵袭和转移恶性生物学行为中发挥关键作用[3, 4]。有研究发现miR-217能够靶向KRAS抑制胰腺癌生长[5],miR-217还能够靶向E2F3抑制肝癌转移[6]。然而,miR-217在胃癌中的作用尚不清楚。本研究通过探索miR-217在胃癌转移过程中的作用及其分子机制,为抑制胃癌转移提供新的有效治疗靶点。
1材料与方法
1.1标本与细胞收集2014年3月~6月我院普通外科胃癌组织和对应正常组织标本各20例。其中男14例,女6例;年龄36~63岁,中位年龄53岁。胃癌标本、对应正常组织均得到病理证实。胃永生化正常上皮细胞GES,胃癌细胞AGS、MKN28、SGC7901、BGC823、MKN45均保存于我院。
1.2实验耗材RPMI-1640、胎牛血清均购自美国Gibco公司。miR-217 mimics 和inhibitor均购自广州锐博生物科技有限公司。Dual-luciferase检测试剂盒购自美国Pormega公司。Transwell培养小室购于Corning公司。鼠抗人β-actin单克隆抗体购于Sigma公司,兔抗人14-3-3ν抗体购于Cell signaling公司。
1.3方法
1.3.1细胞转染取正常生长的SGC7901细胞,消化后重新接种到相应的6孔板,培养24 h后进行转染。利用脂质体转染试剂Lipofectamine 2000并参照其转染步骤将NC或miR-217 mimics或inhibitors转染到SGC7901细胞中,终浓度为100 nmol/L,转染6 h后更换为完全培养基。
1.3.2RNA提取和qRT-PCR细胞经过不同处理后,加入TRIzol充分裂解。每1 ml TRIzol加入0.3 mL氯仿,剧烈震荡15 s,室温静置15 min,4℃下12000 g离心15 min,小心转移上层水相至新EP管中,加入05 ml异丙醇后混匀,4℃下12000 g离心20 min,弃上清,加入 1 ml 75 % 乙醇,洗涤RNA沉淀,4℃下12000 g 离心5 min;加入适量DEPC水溶解后于-80℃保存备用。反转录和qRT-PCR引物均购自广州锐博公司。qRT-PCR采用茎环法SYBR green PCR mix(Takara)对miRNA进行定量分析,所有反应在8联管中进行,扩增反应采用三复孔;反应体系为20 μl,包含SYBR Green PCR Master Mixture试剂10 μl,cDNA模版2 μl,上下游引物各0.8 μl,去离子水H2O 6.4 μl;扩增程序:95℃,15 s;60 ℃,30 s;70 ℃,15 s,40个循环;U6为内参。
1.3.3靶基因预测 使用Targetscan,PicTar,miranda等miRNA靶基因数据库共同预测,对靶基因3′-UTR区与miR-217种子序列进行碱基互补比对并计算结合稳定性,同时检查该基因的miR-217结合区域是否具有保守型。
1.3.4双荧光素酶报告基因实验与验证构建野生型全长14-3-3ν的3′UTR的质粒,并通过定点突变技术构建突变型载体。将NC或miR-217以及14-3-3ν-wt或14-3-3ν-mut载体共转到胃癌细胞中。转染48 h后,每孔加入1 X PLB裂解液100 μl,裂解15 min,将裂解液转移到1.5 ml的EP管中, 4℃下10000 g离心5 min。转移上清到新的EP管中待测。在EP管中加入LAR 底物40 μl,加入10 μl稀释的上清,酶标仪读取Renilla荧光素酶的荧光值。加入终止试剂40 μl,立即读取firefly荧光素酶荧光值。用比值计算各样本荧光强度。
1.3.5Transwell实验将转染NC或miR-217 48 h后的SGC7901细胞消化计数,并用无血清的培养基重悬, 分别接种到平衡后的Insert小室中,下室的24孔板中加入含有10% FBS的培养基,37℃ 下培养24 h后取出。擦除未穿孔的上室细胞、甲醇固定15 min后0.1%结晶紫染色40 min,显微镜下观察并计数。
1.3.6Western blotting法检测转移和凋亡相关蛋白表达细胞经过不同处理后,提取总蛋白,并测定蛋白浓度;每孔30 μg总蛋白上样进行SDS-PAGE电泳,半干转至NC膜,5 %脱脂奶粉室温封闭1h后,分别一抗(14-3-3ν,1∶1000;β-actin,1∶2000)4 ℃下孵育过夜。TBST漂洗后,再加HRP标记的二抗室温孵育1 h,TBST漂洗后,采用化学发光法显影。
1.3.7裸鼠体内转移实验5~7 周龄雄性裸鼠,在恒温恒湿环境下饲养。取稳定表达miR-217或NC的Luciferase标记的SGC7901细胞细胞,消化计数并调整浓度至 1×107个/ml,每只裸鼠尾静脉注射 0.2 ml,每组接种7只,自接种日起每周观察 1 次。7 周后,利用小动物成像系统观察Luciferase信号强度。
1.4统计学分析每次实验至少重复三次,用SPSS 17.0统计软件进行数据处理,均数的比较采用t检验,P<0.05有统计学意义。
2结果
2.1miR-217在胃癌组织和胃癌细胞中的表达情况我们首先通过qRT-PCR验证miR-217在20对胃癌与对应癌旁组织中的表达。结果表明,miR-217在胃癌组织中表达显著高于对应癌旁组织(P<0.05)(图1 A)。同时,我们发现miR-217在多个胃癌细胞系的表达比永生化正常上皮细胞GES明显下降(P<0.05)(图1 B)。这些结果提示miR-217可能在胃癌发生发展中具有重要作用。

图1miR-217在胃癌和癌旁组织,胃癌细胞系和正常胃黏膜永生化细胞系中的表达情况
Figure 1miR-217 expression in gastric cancer, adjacent normal tissues, gastric cancer cell line and normal immortalized gastric epithelial cells
注:A.qRT-PCR检测miR-217在20对胃癌及癌旁组织中的表达;B.qRT-PCR检测miR-217在胃癌细胞系和正常胃癌上皮细胞中的表达
2.2miR-217过表达能够抑制胃癌细胞迁移侵袭能力为明确miR-217在胃癌转移中的作用,分别用miR-217 mimics或inhibitors上调或抑制其表达(图2 A),观察对胃癌细胞转移能力的影响。Transwell结果发现过表达miR-217 mimics细胞中,迁移细胞数为(86±16)个/200倍视野,而NC组迁移细胞数(159±3)个/200倍视野,差异有统计学意义。而在SGC7901细胞中转入miR-217 inhibitors下调其表达,其迁移细胞数为(215±30)个/200倍视野,而NC组迁移细胞数(145±23)个/200倍视野,细胞迁移和侵袭能力明显增强(P<0.05)(图2B、C)。
我们进一步构建了miR-217的慢病毒表达载体及其对照载体,并分别感染稳定表达Luciferase的SGC7901细胞,分别命名为LV-miR-217和LV-NC。qRT-PCR证实miR-217在稳定表达细胞系中高表达(P<0.05)(图2D)。取14只裸鼠,随机分为2组后,通过尾静脉注射分别建立胃癌体内转移裸鼠模型。7周后,采用体内成像系统,观察胃癌转移情况。发现尾静脉注射后LV-miR-217细胞的裸鼠中,Luciferase信号比LV-NC组明显降低。在LV-NC组中,7只裸鼠仅有1只发现转移灶;而在LV-miR-217组中,有5只裸鼠发现转移灶(P<0.05)(图2 E)。这些结果表明,miR-217能够明显降低SGC7901细胞的转移能力。
2.314-3-3ν是miR-217的靶基因我们通过Targetscan等生物信息学软件预测,发现14-3-3ν是miR-217的靶基因(图3A)。我们构建了野生型(wt)和突变型(mut)14-3-3ν荧光素酶报告基因载体。将14-3-3ν-wt和14-3-3ν-mut质粒分别与miR-217质粒、空载体(NC)共转染,或单独转染(Vehicle) SGC7901细胞。48 h后检测细胞的荧光素酶活性。结果显示:14-3-3ν-wt与miR-217质粒共转染组荧光素酶活性为0.55±0.6,较NC组荧光素酶活性(1.0±0.10)和空白对照组荧光素酶活性(0.95±0.11),差异有统计学意义(P<0.05),阴性对照与空白对照相比,差异无统计学意义(P>0.05)。而14-3-3ν-mut与miR-217共转染组荧光素酶活性为0.95±0.05,与阴性对照组荧光素酶活性(0.94±0.09)和空白对照荧光素酶活性(0.98±0.09)比较,差异无统计学意义(P>0.05) (图3B)。这些结果提示miR-217过表达显著抑制14-3-3ν-wt荧光素酶的活性;而对在14-3-3ν-mut的荧光素酶活性没有明显抑制作用。
Western blot结果显示,SGC7901细胞过表达miR-217后,14-3-3ν的 mRNA和蛋白表达均明显低于NC(图3C)。用 miR-217 的抑制剂下调 GC9811 细胞中 miR-217 的表达时,14-3-3ν的mRNA和蛋白表达均升高,提示 miR-217 负性调控 14-3-3ν的表达。
我们将14-3-3ν-wt和14-3-3ν-mut的表达载体分别转入SGC7901细胞中,western blot检测发现其14-3-3ν表达均明显上调。转染miR-217后,发现14-3-3ν-wt明显能被miR-217抑制,然而3′-UTR突变的14-3-3ν-mut的表达并没有被miR-217下调(图3D),说明miR-217通过作用于14-3-3ν的3′-UTR来抑制其表达。
3讨论
本研究在胃癌中开展miR-217的功能探讨,我们通过检测miR-217在胃癌组织和胃癌细胞系中的表达阐明了miR-217通过其下游靶基因14-3-3ν抑制胃癌转移的作用及机制,为将miR-217作为胃癌的分子标志物以及转移靶向分子提供了重要依据。

图2体内外实验表明miR-217能够抑制胃癌转移
Figure.2 miR-217 inhibited metastasis of gastric cancer both in vitro and in vivo
注:A.转染miR-217 mimics或inhibitors之后,qRT-PCR检测miR-217表达;B、C.Transwell检测转染miR-217 mimics或inhibitors对SGC7901细胞转移能力的影响;D.稳定转染miR-217或对照慢病毒后,qRT-PCR检测miR-217的表达情况;E.体内转移模型检测稳定转染miR-217对SGC7901细胞转移能力的影响
MicroRNA 通过作用于靶基因mRNA的3′非编码区,抑制其翻译或促进其降解,在转录后水平负性调控靶基因的表达[2, 4, 7]。近来研究也证实microRNA参与了肿瘤发生和演进的各个阶段,如转移、增殖和耐药[8-10]。胃癌转移涉及侵袭基膜、体内播散、远端定殖等多个过程[2, 3]。miRNA作为基因的重要调控分子,参与转移的各个步骤[10]。已有研究提示miR-217可能在肿瘤转移中发挥重要作用,但先前的研究表明miR-217在不同的恶性肿瘤中所发挥的功能不一致[11-13]。研究发现miR-217能够靶向KRAS抑制胰腺癌生长[5],miR-217还能够靶向E2F3抑制肝癌转移[6],也有研究发现miR-217具有促癌作用[14]。本研究通过体内外实验都证明miR-217的过表达能引起胃癌细胞转移能力的下降,进一步通过荧光素酶报告基因实验证实miR-217通过靶向14-3-3ν抑制胃癌转移的机制。miR-217的作用可能并非仅集中在抑制侵袭转移方面,可能在多种胃癌恶性生物学行为中发挥作用,还有待更多的实验证明。14-3-3家族分子在肿瘤中具有重要作用[15-17],其中,14-3-3ν是14-3-3家族中的重要成员,在肺癌、乳腺癌中高表达,并与患者预后相关[16, 17]。在肺癌中,14-3-3ν受到p53的抑制。当p53缺失时,14-3-3ν表达增高,可能参与肺癌的发生发展[16, 18]。本研究率先发现miR-217能够直接靶向14-3-3ν,抑制胃癌转移。这些结果提示,14-3-3ν发挥了癌基因的作用,在胃癌等多种肿瘤的恶性生物学表型的发生发展中发挥了重要作用。
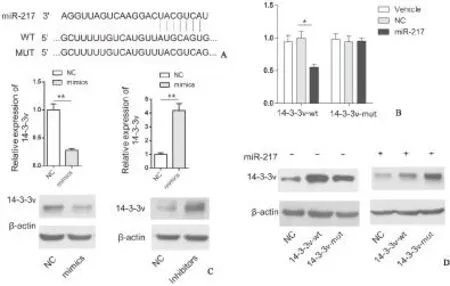
图314-3-3ν是miR-217的靶基因
Figure 314-3-3ν is a target gene of miR-217
注:A。生物信息学分析miR-217与14-3-3ν的结合位点;B.SGC7901细胞分别共转染Luc-14-3-3ν-wt或Luc-14-3-3ν-mut和NC或miR-217后,检测相对Luciferase荧光值。分别转染miR-217 mimics或inhibitors之后,qRT-PCR检测miR-217的表达情况;C.SGC7901细胞转染miR-217 mimics或inhibitors后,14-3-3ν mRNA和蛋白的表达情况;D.SGC7901细胞转染14-3-3ν-wt或14-3-3ν-mut,或同时转染miR-217 mimics后,检测14-3-3ν的蛋白表达
4结论
本研究发现miR-217/ 14-3-3ν这一抑制胃癌转移的重要通路,为胃癌靶向治疗提供了新的潜在靶点。通过恢复miR-217的表达或抑制14-3-3ν的表达,有可能提高胃癌转移的治疗效果。
【参考文献】
[1]Fock KM. Review article: the epidemiology and prevention of gastric cancer[J]. Alimentary pharmacology & therapeutics, 2014, 40(3):250-260.
[2]Cai Yimei, Yu Xiaomin, Hu Songnian,etal. A brief review on the mechanisms of miRNA regulation[J]. Genomics, proteomics & bioinformatics, 2009, 7(4): 147-154.
[3]Wu William KK, Cho Chi H, Lee Chung W,etal. Dysregulation of cellular signaling in gastric cancer[J]. Cancer Letters, 2010, 295(2):144-153.
[4]Shi Z, Wei Q, She J, MicroRNAs in gastric cancer metastasis[J]. Crit Rev Eukaryot Gene Expr, 2014, 24(1): 39-53.
[5]Zhao Wu-Gan, Yu Shuang-Ni, Lu Zhao-Hui,etal. The miR-217 microRNA functions as a potential tumor suppressor in pancreatic ductal adenocarcinoma by targeting KRAS[J]. Carcinogenesis, 2010, 31(10):1726-1733.
[6]Su Jing, Wang Qing, Liu Yiping,etal. miR-217 inhibits invasion of hepatocellular carcinoma cells through direct suppression of E2F3[J]. Molecular and cellular biochemistry, 2014, 392(1-2):289-296.
[7]Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2):215-233.
[8]Esquela-Kerscher A, Slack FJ. Oncomirs - microRNAs with a role in cancer[J]. Nat Rev Cancer, 2006, 6(4): 259-269.
[9]Di Leva Gianpiero, Garofalo Michela, Croce Carlo M. MicroRNAs in cancer[J]. Annual review of pathology, 2014, 9:287.
[10] Seton-Rogers Sarah, Metastasis: Feeding the beast[J]. Nature Reviews Cancer, 2015.
[11] Guo J, Feng Z, Huang Z,etal. MicroRNA-217 functions as a tumour suppressor gene and correlates with cell resistance to cisplatin in lung cancer[J]. Mol Cells, 2014, 37(9): p. 664-671.
[12] Zhang S, Liu L, Wang R,etal. MicroRNA-217 promotes angiogenesis of human cytomegalovirus-infected endothelial cells through downregulation of SIRT1 and FOXO3A[J]. PLoS One, 2013, 8(12):e83620.
[13] Beckman JD, Chen C, Nguyen J,etal. Regulation of heme oxygenase-1 protein expression by miR-377 in combination with miR-217[J]. J Biol Chem, 2011, 286(5):3194-202.
[14] de Yébenes Virginia G, Bartolomé-Izquierdo Nahikari, Nogales-Cadenas Rubén,etal. miR-217 is an oncogene that enhances the germinal center reaction[J]. Blood, 2014, 124(2):229-239.
[15] ten Dijke Peter and van Dam Hans, 14-3-3 Turns TGF-β to the Dark Side[J]. Cancer Cell, 2015, 27(2):151-153.
[16] Chen DY, Dai DF, Hua Y,etal. p53 suppresses 14-3-3gamma by stimulating proteasome-mediated 14-3-3gamma protein degradation[J]. Int J Oncol, 2015, 46(2): 818-824.
[17] Song Y, Yang Z, Ke Z,etal. Expression of 14-3-3gamma in patients with breast cancer: correlation with clinicopathological features and prognosis[J]. Cancer Epidemiol, 2012, 36(6):533-536.
[18] Raungrut P, Wongkotsila A, Lirdprapamongkol K,etal. Prognostic significance of 14-3-3gamma overexpression in advanced non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2014, 15(8):3513-3518.
[19] 刘梅, 贺平, 罗志华,等. MiRNA与肿瘤[J]. 西部医学, 2012, 24(5):1022-1024.
[20] 刘劲松, 房修椢. miRNA-451对结肠癌细胞侵袭力的影响研究[J]. 西部医学, 2014, 7(7):825-826.
miR-217 inhibits gastric cancer metastasis by targeting 14-3-3ν
LEI Wei,DENG Mingming
(DepartmentofDigestiveDiseases,SichuanMedicalUniversity,Luzhou646000,Sichuan,China)
【Abstract】ObjectiveTo investigate the role and mechanisms of miRNA-217 (miR-217) in inhibition of gastric cancer metastasis. MethodsqRT-PCR was used to evaluate miR-217 expression between gastric cancer tissues and paired adjacent tissues, gastric cancer cell lines and normal gastric epithelial cells. After transfection of miR-217 mimics or Inhibitors, transwell invasion assay was applied to the effect of miR-217 in gastric cancer cell metastasis; metastasis model in nude mice was used to observe the effect of miR-217 overexpression in metastasis of gastric cancer in vivo; Bioinformatics analysis revealed 14-3-3ν as a candidate target genes of miR-217. Luciferase activity of the luciferase reporter assay was used to detect the effect of miR-217 on wild-type and mutant 14-3-3ν in SGC7901 cells. Western blot was used to evaluate whether miR-217 affect protein expression of 14-3-3ν and its mutant. ResultsThe expression of miR-217 in gastric cancer tissues was significantly decreased, compared with adjacent normal tissues (P<0.01). miR-217 expression level in the gastric cancer cells was significantly reduced, compared with normal gastric epithelial cell GES (P<0.01). MiR-217 mimics significantly inhibited invasion of SGC7901 cells, compared with the negative control (P<0.01). While miR-217 inhibitors significantly promoted invasion of SGC7901 cells (P<0.01); stable expression of miR-217 in SGC7901 cells demonstrated a reduced invasion capacity in vivo. Luciferase reporter assay showed that miR-217 inhibited luciferase activity of 14-3-3ν by targeting its 3′-UTR region; Western blot assay showed SGC7901 cells transfected with miR-217 significantly decreased 14-3-3ν expression, compared with the negative control. Western blotting showed that overexpression of miR-217 significantly inhibited the expression of14-3-3ν-wt, but not 14-3-3ν-mut. Conclusion MiR-217 inhibits gastric cancer metastasis by targeting 14-3-3ν. Restore of miR-217 expression or 14-3-3ν inhibition may be effective for the treatment of gastric cancer metastasis.
【Key words】Gastric cancer; Metastasis; miRNA; miR-217; 14-3-3ν
(收稿日期:2015-09-27; 编辑: 何兴华)
【中图分类号】R 735.2
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.04.003
通讯作者:雷微,E-mail:hileiwei@163.com
基金项目:国家自然科学基金(30973422)

