磁性功能吸附剂的制备及吸附Cr(Ⅵ)的行为
文 晨,郭 静,朱文清(天津工业大学环境与化学工程学院,天津 300387)
磁性功能吸附剂的制备及吸附Cr(Ⅵ)的行为
文晨,郭静,朱文清
(天津工业大学环境与化学工程学院,天津300387)
摘要:以1,6-己二胺、柠檬酸钠和三氯化铁为前驱物,借助溶剂热法制备了磁性功能吸附剂(FMS),通过调控1,6-己二胺的量制备出3种磁性功能吸附剂,用于处理含铬(Cr(Ⅵ))废水,探索了吸附时间、初始浓度和pH值对去除Cr(Ⅵ)的影响,得到了最佳的磁性功能吸附剂(FMS3),并借助场发射扫描电子显微镜(FESEM)、傅里叶红外光谱(FT-IR)和Zeta电位表征了磁性功能吸附剂的微观形态.结果表明:在25℃、pH = 2.0和吸附剂投加量为1.0 g/L等条件下,吸附在120 min内可达到饱和,FMS3最大吸附量为63.78 mg/ g.该吸附规律较好地符合二阶动力学吸附方程和Langmuir等温吸附模型,从热力学参数值ΔG°、ΔH°和ΔS°说明此吸附为自发、吸热的熵增加过程,升温益于吸附发生,且可重复使用.此外,所制备的磁性功能吸附剂为球形颗粒,平均粒径为45~65 nm,表面呈现较强的正电性.
关键词:磁性功能吸附剂;吸附行为;Cr(Ⅵ)去除;溶剂热法
随着电镀和皮革行业等快速发展,加大了重金属废水的排放.因其具有毒性大、浓度高、排放量大、致突变性和致癌性等特点,已成为重点污染源之一,对环境和生物体危害严重.近年来,频繁出现的重金属污染事件提醒人类控制与治理重金属污染已刻不容缓[1].其中,铬(Cr)是一种应用广泛的工业重金属,是国际公认的三种致癌金属物之一.通常去除水中Cr(Ⅵ)的方法有吸附法[2]、化学沉淀法[3]、膜分离法[4]和离子交换处理法[5]等.其中,吸附法以高效性、简便性和选择性高等优点被广泛研究,并研发出多种吸附材料用于去除废水中超标的Cr(Ⅵ),如活性炭、工业废物类与矿物类吸附剂和生物吸附剂等[1].然而,上述部分吸附材料均存在再生成本高、回用难、固液分离受限以及次生污染等,而磁性材料则可借助外加磁场解决该问题.迄今为止,已有一些磁性材料用于深度处理重金属废水的报道[6-7],它们在吸附过程中显示出较好的吸附性能,且易于磁分离法与再利用.特别是含官能团的磁性功能化吸附剂越来越受到青睐,这得益于其表面功能化增强了捕集重金属离子的能力,呈现出更优良的吸附性和选择性等.如Singh等[6]采用共沉淀法制备纳米Fe3O4颗粒,并用琥珀酸修饰其表面得到的羧基化纳米Fe3O4,并考察了对Cr(Ⅲ)的吸附性能和机制.赵永纲等[7]采用化学共沉淀法获得了油酸包覆的纳米Fe3O4颗粒,并用氨基修饰其表面,探讨了其对废水Cr(Ⅵ)的吸附性能.
本文以乙二醇为溶剂,以FeCl3、1,6-己二胺和柠檬酸钠为前驱体,通过溶剂热法一步合成了含氨基的磁性吸附剂FMS,将其用于含Cr(Ⅵ)废水的处理,考察了吸附时间、pH值和初始浓度等条件对吸附过程的影响,探讨了吸附动力学和等温吸附过程,为确定最佳工艺条件和吸附机理奠定了基础,并通过场发射扫描电子显微镜(FESEM)、傅里叶转换红外光谱(FT-IR)和Zeta电位表征了该磁性吸附剂的微观形态,以期为含铬废水的吸附法处理提供理论依据与技术支持.
1 实验部分
1.1试剂和仪器
试剂:三氯化铁,分析纯,天津市福晨化学试剂厂;乙二醇,分析纯,天津市赢达稀贵化学试剂厂;1.6己二胺,分析纯,天津市科密欧化学试剂有限公司;柠檬酸钠,分析纯,国药集团化学试剂有限公司产品;乙酸钠,分析纯,国药集团化学试剂有限公司产品;重铬酸钾,分析纯,天津市福晨化学试剂厂产品;二苯碳酰二肼,分析纯,天津市科密欧化学试剂有限公司产品.
仪器:TU-1901型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司产品;NICOLET6700型场发射扫描电子显微镜,日本HITACHI公司产品;FTIR-650型红外光谱仪,天津港东科技发展股份有限公司产品;Zeta电位仪,英国马尔文仪器有限公司产品.
1.2实验方法
1.2.1磁性功能吸附剂制备
在一定量的乙二醇中,依次加入三氯化铁、1,6-

式中:qe为平衡吸附量(mg/g);C0和Ce分别为Cr(Ⅵ)的初始质量浓度和平衡质量浓度(mg/L);V为溶液的体积(L);m为磁性吸附剂的投加量(g/L).
1.2.3磁性功能吸附剂表征
用扫描电镜观察磁性功能吸附剂的形态和粒径;用FT-IR表征其表面功能基团;用Zeta电位测其表面电性能.
1.2.4磁性功能吸附剂再生
取一定量达到吸附平衡的磁性功能吸附剂,置于1.0 mol/L的NaOH溶液中,在常温下振荡2 h后通过磁铁分离吸附剂,用紫外分光光度计测定碱液中Cr(Ⅵ)的浓度.将FMS用1.0 mol/L HAc、去离子水和乙醇清洗至中性,烘干,继续循环使用.己二胺、柠檬酸钠和乙酸钠,于50℃下磁力搅拌得到棕色溶液,将其转移入反应釜中,于200℃下保持24 h,降温后借磁棒分离产物,分别用去离子水和无水乙醇清洗3次,于50℃真空干燥得到磁性功能吸附剂(FMS).其中,调控1,6-己二胺的量分别为32.4 g、64.8 g、97.2 g得到3种磁性功能吸附剂,分别标记为FMS1、FMS2和FMS3.
1.2.2磁性功能吸附剂吸附性能评价
分别取1.0 g/L磁性功能吸附剂FMS1、FMS2和FMS3放入50 mL含一定浓度Cr(Ⅵ)的锥形瓶中,置于恒温振荡器上,调节振荡频率和吸附拟定时间.吸附完成后,磁铁置于锥形瓶下,静置30 min,取上清液分别用紫外可见分光光度计,于540 nm波长下测定Cr(Ⅵ)吸光度.根据式(1)计算单位质量磁性功能吸附剂对Cr(Ⅵ)吸附量:
2 结果与讨论
2.1吸附性能评价
2.1.1时间的影响
常温下考察了3种磁性功能吸附剂吸附Cr(Ⅵ)的经时变化,其结果如图1所示.反应条件为:[Cr(Ⅵ)]0= 60.0 mg/L,吸附剂投加量= 1.0 g/L,pH=2.0,T = 25℃.
由图1可见,吸附起始30 min内,吸附量快速增加,这是基于FMS表面的氨基被质子化,使其表面带正电性,而Cr(Ⅵ)在强酸性溶液中带负电,受静电引力作用,Cr(Ⅵ)经溶液快速地扩散到FMS表面;此时,吸附剂表面Cr(Ⅵ)与水溶液之间的浓度差也是促使Cr(Ⅵ)快速迁移到吸附剂表面另一原因.另外,吸附剂表面富有的吸附位点也是导致快速吸附的重要因素.随着FMS表面的吸附量接近饱和,孔道扩散成为影响吸附速率的关键,即吸附的驱动力变弱,在120 min内基本趋于饱和,处于动态平衡状态,吸附量基本保持稳定.其中3种吸附剂去除Cr(Ⅵ)效率依次为:FMS3>FMS2>FMS1.由此可见,适量增加1,6-己二胺的量可有效地促进对Cr(Ⅵ)的吸附,为此后续研究主要探索FMS3对Cr(Ⅵ)的吸附行为.

图1 吸附时间对吸附量的影响Fig.1 Effect of contact time on adsorption capacity
2.1.2 pH值的影响
常温下考察了3种磁性功能吸附剂对Cr(Ⅵ)的吸附容量随pH值的变化,其结果如图2所示.其中,[Cr(Ⅵ)]0= 60.0 mg/L,吸附剂投加量= 1.0 g/L,T = 25℃,t = 120 min.

图2 溶液pH值对吸附量的影响Fig.2 Effect of pH on adsorption capacity
由图2可见,FMS3的吸附量随溶液pH值的变化有较大差异,随pH值增加吸附量减少,当pH=2时,吸附量达到最大.众所周知,当溶液pH=2~6时,Cr(Ⅵ)以和HCrO4-存在,且随pH值降低,其平衡则趋于,即在强酸性中Cr(Ⅵ)主要以形式存在[8],同时酸性溶液中,FMS3的氨基被质子化,使其表面带正电,与之间的静电引力强化,吸附量增大[9].然而,随溶液pH值进一步升高,质子化程度降低,吸附量随之减少,这意味着碱性溶液有利于脱附.
2.1.3初始浓度的影响
常温下考察了3种磁性功能吸附剂对Cr(Ⅵ)的吸附容量随初始浓度的变化,配制系列质量浓度为20~100 mg/L Cr(Ⅵ)溶液,加入1.0 g/L FMS3,调pH值为2,于常温下吸附2 h,其结果如图3所示.其中,吸附剂投加量= 1.0 g/L,pH = 2.0,T = 25℃,t = 120 min.

图3 Cr(Ⅵ)初始浓度对吸附量的影响Fig. 3 Effect of Cr(Ⅵ)initial concentration on adsorption capacity
由图3可见,FMS3吸附Cr(Ⅵ)的平衡吸附量(qe)随初始浓度的增加而增大,到一定浓度后,达到FMS3的饱和吸附量,这是因为在FMS3量一定情况下,随着增加Cr(Ⅵ)量,浓度梯度提升,增加了吸附剂表面和溶液之间的推动力,益于吸附Cr(Ⅵ).此外,当Cr(Ⅵ)质量浓度达到100 mg/L时,FMS3对Cr(Ⅵ)吸附量达到63.78 mg/g,表明FMS3上的氨基对Cr(Ⅵ)吸附发挥了着重要作用.
2.1.4吸附动力学
为了研究FMS3吸附过程的速率规律和吸附机理,分别采用准一级动力学方程和准二级动力学方程对数据进行模拟.
准一级动力学方程线性表达式[10]:

准二级动力学方程的线性表达式[11]:

式中:qt为t时刻的吸附量(mg·g-1);qe为平衡吸附量(mg·g-1);t为吸附时间(min);k1为准一级动力学速率常数(min-1);k2为准二级吸附速率常数(g·min-1·mg-1).
利用准一级动力学模型式(2)和准二级动力学模型式(3)对不同时间所测的吸附数据线性拟合,依据斜率和截距计算得到动力学参数如表1所示.

表1 FMS3的吸附动力学拟合模型参数Tab.1 Kinetic parameters for Cr(Ⅵ)adsorption by FMS3
由表1中可以看出,准二级动力学模型有较好的线性拟合性,且相关系数R2>0.990,即由R2和拟合曲线接近实验点的程度可知,该吸附过程符合准二级动力学模型,表明FMS3的吸附可能是以化学吸附为主导的吸附过程[12].
2.1.5等温吸附模型
为了进一步考察磁性功能吸附剂FMS3对Cr(Ⅵ)的吸附特性,在不同温度(298 K、308 K和318 K)下进行了Cr(Ⅵ)的吸附平衡实验,用Langmuir和Freundlich吸附等温模型对数据拟合,试图阐明FMS3的吸附机理.事实上,Langmuir和Freundlich等温吸附方程分别描述了均匀表面单层吸附和非均匀表面非均相吸附,其表达式如下:
Langmuir等温吸附方程[13]:


式中:qe为平衡吸附量(mg/g);qm为单层吸附的最大吸附量(mg/g);Ce为平衡时溶液浓度(mg/g);b为Langmuir模型的吸附平衡常数(L/g);KF为经验常数(L/g),与吸附能力大小有关;n为与温度和体系有关的经验常数.
FMS3对Cr(Ⅵ)吸附的等温吸附方程的拟合实验结果如表2所示.
Freundlich等温吸附方程[14]:

表2 不同温度下Cr(Ⅵ)在FMS3的Langmuir和Freundlich参数Tab.2 Langmuir and Freundlich parameters for Cr(Ⅵ)by FMS3at different temperatures
由表2可见,在不同温度下,Langmuir的相关系数较高(R2>0.95),因此,FMS3对Cr(Ⅵ)的吸附过程较好地符合Langmuir等温吸附规律,其中在298 K、308 K、和318 K这3种温度下FMS3理论饱和吸附量分别为63.78 mg/g、69.46 mg/g和78.22 mg/g,分别与实验所得的平衡吸附量62.41 mg/g、68.99 mg/g和77.15 mg/g很接近,且b值随温度升高而增加,这意味着提高温度有利于吸附过程进行.

式中:ΔG(kJ·mol-1)、ΔH(kJ·mol-1)与ΔS(J·mol-1·K-1)分别为吸附过程吉布斯自由能、吸附焓变与吸附熵变;R为气体常数,取8.314 J/(mol·K)-1;Kc为等温吸附平衡常数.
不同温度下,由ln Kc~1/T关系曲线的截距及斜率可得到ΔS和ΔH,如图4所示.该吸附剂吸附Cr(Ⅵ)的热力学参数如表3所示.
2.1.6吸附热力学
通过考察不同温度下FMS3对Cr(Ⅵ)的等温吸附方程发现,Langmuir等温吸附的线性拟合度较高.为此,以Langmuir等温吸附的实验结果为基础计算吸附自由能ΔG、吸附焓变ΔH和吸附熵变ΔS等热力学参数,判断该吸附是否为自发过程.
ΔG,ΔH和ΔS的计算如下:
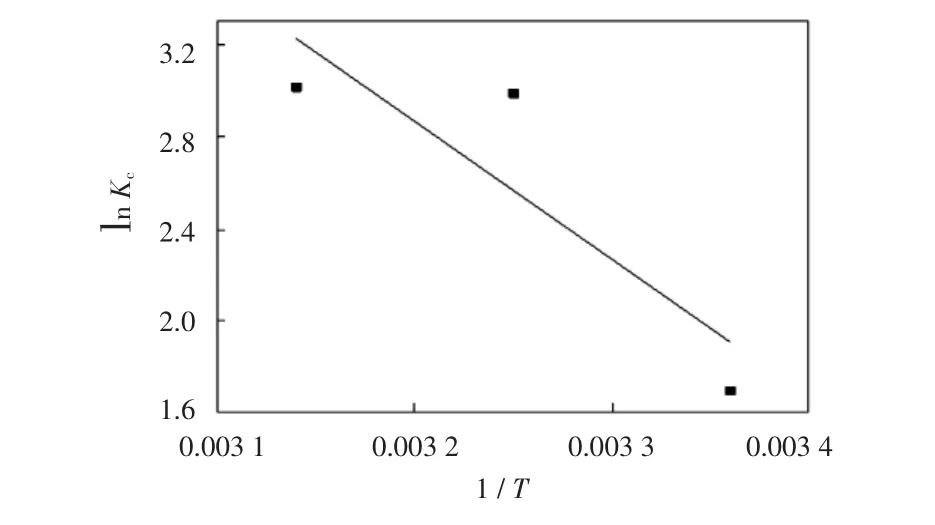
图4 FMS3对Cr(Ⅵ)吸附的热力学关系Fig.4 Thermodynamic relationships on adsorption for Cr(Ⅵ)onto FMS3
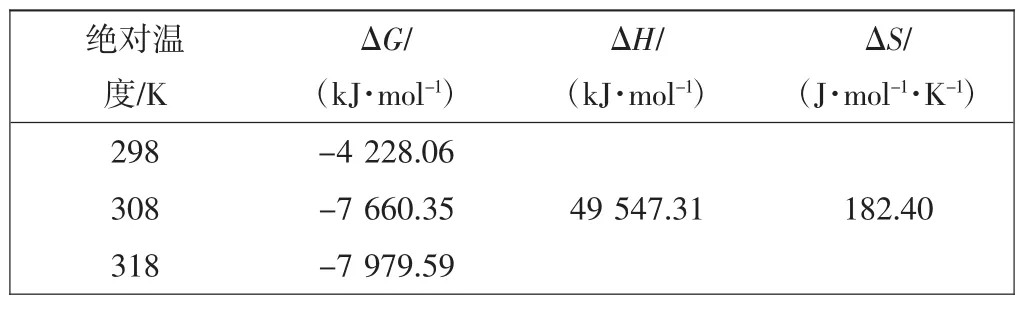
表3 磁性功能吸附剂FMS3吸附Cr(Ⅵ)的热力学参数Tab.3 Thermodynamic parameters of Cr(Ⅵ)absorption by FMS3
由表3可知,不同温度下ΔG均为负值,表明FMS3对Cr(Ⅵ)的吸附过程是自发进行的,即Cr(Ⅵ)容易被FMS3吸附.ΔH大于零,表明吸附过程是吸热的,升温有利于吸附,这与实验结果相一致,而ΔS大于零,意味着吸附为系统无序度增大过程,其原因主要是水分子由固体表面向溶液紊乱运动所致[15],即该吸附过程是无序的.
2.2吸附剂表征
2.2.1电镜表征及粒径分布图
为研究FMS3的微观结构,对其进行扫描电镜表征,其结果如图5所示.
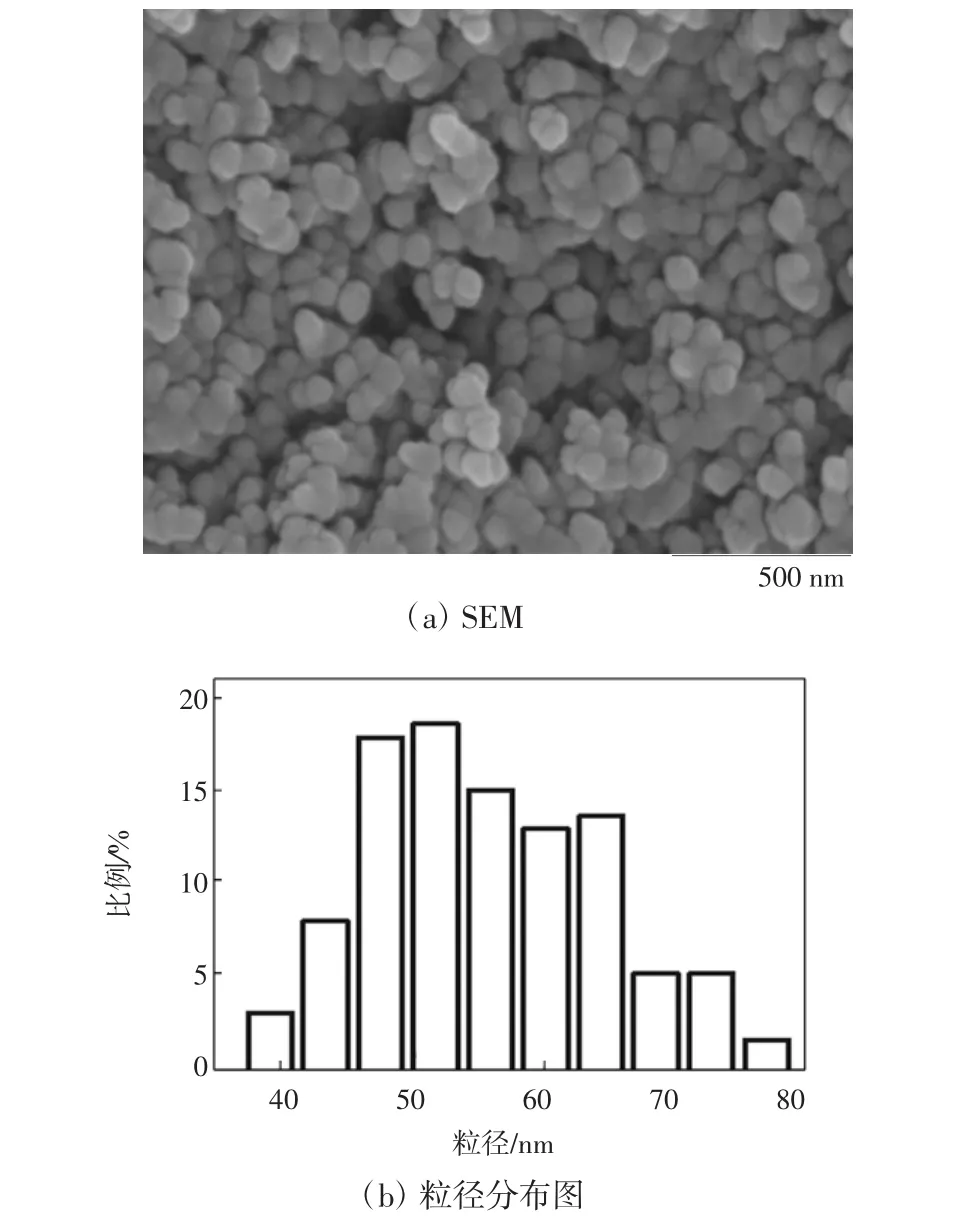
图5 FMS3的SEM和粒径分布图Fig. 5 SEM and particle size distribution of FMS3
图5(a)为FMS3的扫描电镜图.从图5(a)可以看出,FMS3的外形为较规则的球形,其粒径在45~65 nm间,且粒径分布较宽,说明添加1,6-己二胺和柠檬酸钠的交联作用致使其形成微球形状.
2.2.2傅里叶转换红外光谱分析
为研究FMS3所含有的官能团,对其进行傅里叶变换红外光谱表征,其结果如图6所示.

图6 FMS3的红外光谱图Fig.6 FT-IR spectrum of FMS3
由图6可以看出,在750~450 cm-1处的特征峰对应是Fe3O4中Fe—O键的吸收峰;1 620 cm-1的特征峰是水的吸收峰;1 635 cm-1和1 419 cm-1处的特征峰对应于羧酸盐吸收峰,即C=O键的反对称伸缩振动峰和C=O键对称伸缩振动峰,这是柠檬酸钠与磁体产生键合所致[16].此外,2 928 cm-1和2851 cm-1处的特征峰对应—CH2—中的—C—H键的伸缩振动[17],—OH和—NH2在3 800~3 000cm-1处的吸收峰重叠;在3 410 cm-1处的特征峰为N—H键的伸缩振动.上述各吸收峰表明,FMS3带氨基和羧基功能团.
2.2.3 Zeta电位分析
为研究FMS3的表面带电性,对其进行Zeta电位表征,其结果如图7所示.
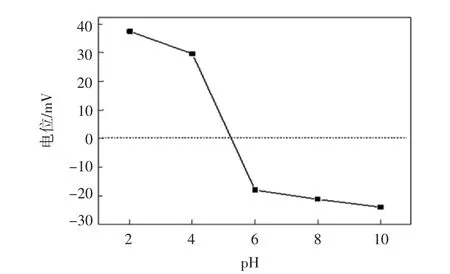
图7 MS3的Zeta电位Fig.7 Zeta potential of FMS3
从图7可知,当溶液pH控制在2~5时,磁性功能吸附剂FMS3表面带正电,而溶液pH控制在5~10则表面带负电荷,其等电点为pH=5.由此可见,所制备的FMS3因其分子结构中含氨基和羧基,故导致其表面电学性随溶液pH而改变.
2.3吸附剂再生
循环再生性是磁性吸附剂的重要功能,为研究FMS3的再生性,将其进行重复利用,FMS3对Cr(Ⅵ)的吸附容量随使用周期的变化如图8所示.

图8 FMS3的再生性能Fig.8 Regeneration performance of FMS3
由图8可知,FMS3经5次循环处理含Cr(Ⅵ)废水后,其饱和吸附量由62.41 mg/g降至51.11 mg/g,最大吸附量仍保持在81%以上,这表明FMS3的再生性较好,可重复使用.
3 结论
本文采用溶剂法制备了磁性微球,其粒径均一,含氨基和羧基等功能基团,并用于对含Cr(Ⅵ)溶液的吸附,考察了其吸附性能.其中FMS3的吸附性最佳,在室温下和pH=2时,其饱和吸附量最大;随初始浓度的增加,吸附量也逐渐增大,最大吸附量接近63.78 mg/g;吸附在120 min内可达到平衡,吸附速率较快. FMS3的对Cr(Ⅵ)的吸附符合准二级动力学方程,以化学吸附为主;其吸附等温线较好地符合Langmuir等温方程式;吸附为自发吸热熵增加过程,高温度有利于吸附进行. FMS3吸附Cr(Ⅵ)后可重复使用,具有良好的吸附与解吸能力,且无二次污染,作为处理含Cr(Ⅵ)工业废水的有效吸附剂可发挥重要的作用.
参考文献:
[1]谭丽莎,孙明洋,胡运俊,等.功能化纳米Fe3O4磁性材料的制备及其对水中重金属离子的去除[J].化学进展,2013,25 (12):2147-2158. TAN L S,SUN M Y,HU Y J,et al. Heavy metal removal from aqueous solution by functional magnetic Fe3O4nanoparticles[J]. Progress in Chemistry,2013,25(12):2147-2158(in Chinese).
[2]王家宏,常娥,丁绍兰,等.吸附法去除水中六价铬的研究进展[J].环境科学与技术,2012,35(2):67-72. WANG J H,CHANG E,DING S L,et al. Advance in adsorptive removal of Cr(Ⅵ)from aqueous solutions[J]. Journal of Environmental Science and Engineering,2012,35(2):67-72 (in Chinese).
[3]白圆,高凌超,刘寰.化学沉淀法去除工业废水中的六价铬[J].中国资源综合利用,2012,30(11):30-33. BAI Y,GAO L C,LIU H. Removal of Cr(Ⅵ)by chemical precipitation from industrial wastewater[J]. China Resources Comprehensive Utilization,2012,30(11):30-33(in Chinese).
[4] XU Guorong,WANG Jiaona,LI Congju. Preparation of hierarchically nanofibrous membrane and its high adaptability in hexavalent chromium removal from water[J]. Chemical Engineering Journal,2012,198:310-317.
[5]胡国飞,孟祥和.重金属废水处理[M].北京:化学工业出版社,2000:17-51. HU G F,MENG X H. Treatment of Heavy Metal-Containing Wastewater [M]. Beijing:Chemical Industry Press,2000:17-51(in Chinese).
[6] SINGH Sarika,BARICK K C,BAHADUR D. Surface engineered magnetic nanoparticles for removal of toxic metal ions and bacterial pathogens[J]. Journal of Hazardous Materials,2011,192:1539-1547,
[7]赵永纲,沈昊宇,李勍,等.氨基功能化纳米Fe3O4磁性高分子吸附剂对废水中Cr(VI)的吸附研究[J].化学学报,2009,67 (13):1509-1514. ZHAO Y G,SHEN H Y,LI Q,et al. Adsorption studies on Cr(VI)inwastewaterby NH2-functionalized nano-Fe3O4magnetic composites[J]. Journal of Chemical Industry and Engineering,2009,67(13):1509-1514(in Chinese).
[8] HUANG Shih-Hung,CHEN Dong-Hwang. Rapid removal of heavy metal cations and anions from aqueous solutions by anamino-functionalized magnetic nano-adsorbent [J]. Journal of Hazardous Materials,2009,163:174-179.
[9] CHANG Y C,CHEN D H. Recovery of gold(III)ions by a chitosan-coated magnetic nano-adsorbent[J]. Gold Bull,2006,39:98-102.
[10] YAN H,LI H J,YANG H,et al. Removal of various cationic dyes from aqueous solutions using a kind of fully biodegradable magnetic composite microsphere[J]. Chemical Engineering Journal,2013,223:402-411.
[11] SHUANG C D,LI P H,LI A M,et al. Quaternized magnetic microspheres for the efficient removal of reactive dyes[J]. Water Research,2012,46:4417-4426.
[12] GE F,YE H,LI M M,et al. Efficient removal of cationic dyes from aqueous solution by polymer -modified magnetic nanoparticles[J]. Chemical Engineering Journal,2012(198/ 199):11-17.
[13]王艳,张继国,李淑君,等. Fe3O4-羧甲基纤维素-聚乙烯亚胺微球的制备及对Cd2+的吸附性能[J].功能材料,2012,45 (2):2095-2100. WANG Y,ZHANG J G,LI S J,et al. Preparetion and characterization of the composite materials of SiO2-multi-arms star hyperbranched block copolymer [J]. Journal of Functional Materials,2012,45(2):2095-2100(in Chinese).
[14] JIN X Y,YU B,CHEN Z L,et al. Adsorption of Orange II dye in aqueous solution onto surfactant -coated zeolite:Characterization,kineticand thermodynamic studies[J]. Journal of Colloid and Interface Science,2014,435:15-20.
[15] CHEN A H,CHEN S M. Biosorption of azo dyes from aqueous solution by glutaraldehyde-crosslinked chitosans[J]. Journal of Hazardous Materials,2009,172:1111-1121.
[16] HASSAN Hosseini-Monfared,FATEMEH Parchegani,SOHAILA Alavi. Carboxylic acid effects on the size and catalytic activity of magnetite nanoparticles[J]. Journal of Colloid and Interface Science,2015,437:1-9.
[17]肖旭贤,何琼琼,覃罡,等.新型氨基化磁性纳米粒子的合成[J].应用化工,2007,36(7):641-643,655. XIAO X X,HE Q Q,QIN G,et al. Synthesis of a newly aminated magnetic nanoparticles[J]. Applied Chemical Industry,2007,36(7):641-643,655(in Chinese).
Preparation of magnetic functional adsorbent and its adsorption behavior for Cr(Ⅵ)
WEN Chen,GUO Jing,ZHU Wen-qing
(School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China)
Abstract:Magneticfunctionaladsorbents(FMS)were synthesized by solvothermal method with 1,6-hexanediamine,sodium citrate and ferric trichloride as the precursors and three kinds of magnetic functional adsorbents were obtained via changing contents of the 1,6-hexanediamine,respectively. Magnetic functional adsorbents were used to adsorb Cr(Ⅵ)from aqueous solution. The effects of contact time,initial concentration and pH on removing amount of Cr(Ⅵ)were investigated,and the best adsorbent was found to be FMS3,which was characterized by field emission scanning electron microscope(FESEM),Fourier transform infrared spectrometer(FT-IR),and Zeta potential. The experimental results indicated that the highest adsorption capacity of Cr(Ⅵ)was around pH = 2 at 25℃with the adsorbent amount of 1.0 g/L,and the adsorption of Cr(Ⅵ)on FMS3reached equilibrium within 120 min and the saturated adsorption capacity for Cr(Ⅵ)was approximately 63.78 mg/g. The adsorption isotherm can be well described by the adsorption kinetics fitted to the pseudo-second-order model and the Langmuir equation. The thermodynamic parameters ΔG°、ΔH°and ΔS°indicated that the adsorption was spontaneous and endothermic process with increased entropy,and higher temperature would improve the adsorption. The adsorbent can be repeatedly utilized with no significant loss of adsorption capacity. In addition,the magnetic functional adsorbent FMS3is spherical particles with the average particle size of 45 - 65 nm,and its surface possesses positive electricity in acidic solution.
Key words:magnetic functional adsorbents;adsorption behavior;Cr(Ⅵ)removel;solvothermal method
通信作者:文晨(1959—),女,教授,主要研究方向为工业污水处理、有机-无机纳米杂化膜的制备. E-mail:wenchen@tjpu.edu.cn
收稿日期:2015-11-19基金项目:国家自然科学基金资助项目(41301542)
DOI:10.3969/j.issn.1671-024x.2016.02.002
中图分类号:TQ314.269;X708
文献标志码:A
文章编号:1671-024X(2016)02-0007-06

