豆清发酵液中一株产细菌素乳酸球菌的分离鉴定
孙 菁,张臣飞,尹乐斌,2,孔小婷,周新星,夏秋良,赵良忠
(1.邵阳学院生物与化学工程系,湖南邵阳 422000;2.豆制品加工技术湖南省应用基础研究基地建设,湖南邵阳 422000)
豆清发酵液中一株产细菌素乳酸球菌的分离鉴定
孙菁1,张臣飞1,*尹乐斌1,2,孔小婷1,周新星1,夏秋良1,赵良忠1
(1.邵阳学院生物与化学工程系,湖南邵阳422000;2.豆制品加工技术湖南省应用基础研究基地建设,湖南邵阳422000)
摘要:从豆制品生产副产物豆清发酵液中分离得到1株产细菌素球状菌,编号SQ- 12- 3。结合菌株生长特征、菌体形态及生理生化性质,初步将其鉴定为乳球菌属(Lactococcus sp.)。排除发酵液中可能存在的有机酸、过氧化氢及菌株菌体的干扰,并检测抑菌物质蛋白酶稳定性,可确定菌株SQ- 12- 3产细菌素抑菌。研究该菌株产细菌素动态,确定菌株最适生长温度在37℃,菌株在该温度下发酵18 h后菌液pH值低至4.11;当NaCl质量分数大于7%时,菌株生长受到明显抑制。
关键词:乳酸球菌;细菌素;豆清发酵液
乳酸菌是一类能利用可发酵糖产生大量乳酸的细菌通称,在自然界中分布广泛,并在利用乳糖等发酵糖[1]的代谢过程中产生有机酸、过氧化氢、细菌素和二乙酰等具有抑制腐败菌生长的物质,是健康人和动物肠道的优势菌群之一,对于维持肠道微环境的稳定与健康发挥着重要的作用[2-4]。细菌素是细菌代谢过程中合成并分泌到环境中的一类对同种或亲缘关系较近的、有抑制作用的杀菌蛋白或多肽物质,而具有广谱抑菌作用的细菌素很少见。乳酸菌可产细菌素,乳酸菌细菌素是一种杀菌蛋白或多肽,可抑制广谱的革兰氏阳性菌,尤其是抑制一些腐败菌和病原菌且与鳌合剂结合,可以将其活性谱拓宽到革兰氏阴性菌,因而为食品加工和食品保藏提供了一个新方法[5-6]。
豆清发酵液是豆腐生产过程中废液经自然发酵而形成,俗称黄浆水、酸水,是一种传统的天然豆腐凝固剂[5]。以豆清发酵液点浆的豆腐,不仅质地细腻、持水性好,而且乳酸菌发酵产生的有机酸及蛋白酶等物质还增加了豆腐独特风味,并保持了良好的组织状态,深受广大消费者欢迎。目前,有关豆清发酵液的研究主要集中在其循环再利用及其产酸发酵条件优化[7-10],有关利用豆清蛋白发酵产乳酸菌细菌素相关研究还未见报道。本文从湖南省传统豆制品企业的豆清发酵液中分离筛选产细菌素的乳酸菌,并对其进行初步鉴定及相关生物学特性研究,旨在为其进一步开发提供理论依据,并为充分利用这些优良菌种奠定了基础,也对充分挖掘豆清发酵液的乳酸菌资源具有重要意义。
1材料与方法
1.1材料与设备
豆清发酵液(pH值为3.45),采集于湖南省恭兵食品有限公司豆制品生产车间,保存于4℃冰箱备用。
金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、单核细胞增生李斯特氏菌(Listeria monocytogenes)均保存于邵阳学院生物与化学工程系。
乳酸菌分离及发酵培养基:MRS培养基(蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,葡萄糖20 g,醋酸钠5 g,柠檬酸二铵2 g,吐温- 80 0.1 g,硫酸镁0.58 g,硫酸锰0.25 g,琼脂15 g,蒸馏水1 000 mL,pH值调至6.0);指示菌培养基:LB培养基(胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂15 g,蒸馏水1 000 mL,pH值调至7.2);胰蛋白酶、胃蛋白酶、过氧化氢酶、蛋白酶K,购自成都格雷西亚化学技术有限公司。
SW- CJ- 1D型单人单面洁净工作台,苏州净化设备有限公司产品;高压蒸汽灭菌锅,宁波久兴医疗器械厂产品;BA301 Digital型电子显微镜,麦克奥迪实业有限公司产品;VELOCITY18R型高速冷冻离心机,驭锘实业有限公司产品;IS- RDD3型全温摇床,美国精骐有限公司产品;EL20型pH计,梅特勒-托利多国际贸易上海有限公司产品。
1.2试验方法
1.2.1菌种的分离纯化
豆清发酵液样品(pH值3.45)粗过滤后,先于37℃下以转速50 r/min摇床培养1 h,然后取摇床培养后样品用灭菌的生理盐水进行10倍梯度稀释,并在超净工作台内分别取1 mL各梯度稀释液于灭菌培养皿,再于皿内进行MRS培养基倒平板,待培养基凝固后,于37℃恒温培养1~2 d。培养期间观察是否有明显溶钙圈,并挑取特征菌落分离纯化,多次革兰氏镜检后与《伯杰氏细菌鉴定手册》第8版[11]进行对比,符合乳酸菌形态特征的菌株制备发酵液,打孔法[12]测定对指示菌的抑菌活性。
1.2.2菌株产细菌素的确认
除细菌素外,乳酸菌在生长过程中代谢还可以产生其他具有抑菌作用的物质,如有机酸、过氧化氢、双乙酰等[12-13]。因此,在筛选产细菌素的乳酸菌菌株时必须排除这些干扰因素,确定抑菌作用是由细菌素所引起。
(1)有机酸抑菌作用的排除。以2%接种量将活化的菌株接种至MRS液体培养基,于37℃下恒温静置发酵2 d,离心收集豆清发酵上清液,调节发酵液pH值至6.0。以同pH值乳酸和乙酸为对照,检测抑菌活性。
(2)过氧化氢抑菌作用的排除。按1∶1体积比例,0.5 mg/mL H2O2酶液加至pH值7.0菌株发酵上清液,于37℃下恒温水浴2 h。以原菌株发酵上清液为对照,于37℃下培养24 h后测定抑菌圈大小。重复3次,求平均值。
(3)细菌过滤器除去菌体的干扰。发酵上清液经细菌过滤器分离杂质[14],收集滤液重复进行抑菌试验,观察2次抑菌试验中抑菌圈大小是否有显著差别。
(4)抑菌物质的酶稳定性。在排除有机酸、过氧化氢和菌株菌体干扰后,在发酵上清液中分别加入2 mg/mL胰蛋白酶、胃蛋白酶及蛋白酶K 5 mL,随后分别调节pH值至3种最适生长值。于37℃下灭酶2 h后,将pH值调至7.0,检测抑菌活性。
1.2.3菌株生物学特性研究
(1)菌株生长曲线。以2%接种量将活化的菌株接种至MRS液体培养基,于37℃下恒温发酵1 d,每间隔2 h抽取样品,摇匀测定发酵液OD600 nm值,24 h后绘制菌株的生长曲线。
(2)菌株发酵产酸。以2%接种量将活化的菌株接种至MRS液体培养基,于37℃下恒温发酵1 d,每间隔2 h抽取样品,摇匀测定发酵液pH值,24 h后绘制菌株的产酸曲线。
(3)菌株的最适生长温度。以2%接种量将活化的菌株接种至MRS液体培养基,分别置于27,32,37,42,47℃恒温静置发酵1 d,摇匀后取样测定不同温度发酵液的OD600 nm值,确定菌株的最适生长温度。
(4)菌株对盐的耐受性。以2%接种量将活化的菌株接种至分别含3%,5%,7%,9%,11% NaCl 的MRS液体培养基,于最适生长温度下发酵1 d,摇匀后取样测定不同NaCl质量分数发酵液的OD600 nm值,确定菌株对盐的耐受性。
2结果与分析
2.1产细菌素乳酸菌的筛选
经过平板反复划线,分离得到5株有抑菌圈的乳酸菌,并通过测定这5株菌株对指示菌菌落周围形成抑菌圈的大小来判断抑菌效果的好坏,结果得到1株抑菌效果最好的菌株,编号为SQ- 12- 3。
5株菌株对不同指示菌的抑菌效果见图1。
2.2菌株SQ- 12- 3的鉴定
2.2.1菌株SQ- 12- 3的形态学鉴定
菌株SQ- 12- 3在培养基上呈乳白色、不透明的圆形小菌落状,微微隆起,表面光滑,有光泽,菌落边缘整齐,有较大的溶钙圈,无色素,兼性厌氧生长。革兰氏染色阳性,形态呈球状,无芽孢、鞭毛和荚膜,不运动,不形成内生芽孢,(0.5~0.7 μm)×(0.5~0.7 μm)。
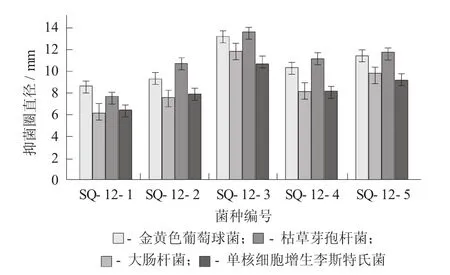
图1 5株菌株对不同指示菌的抑菌效果
菌落、菌体形态及菌株溶圈钙见图2。

图2 菌落、菌体形态及菌株溶圈钙
参照《伯杰氏细菌鉴定手册》第8版、《常见细菌鉴定手册》[15]及《乳酸细菌分类鉴定及实验方法》对菌株SQ- 12- 3进行生理生化试验。菌株SQ-12- 3的菌落及菌体形态、生理生化特性符合《乳酸细菌分类鉴定及实验方法》中有关乳酸菌典型菌落特征的描述,初步鉴定为乳球菌属(Lactococcus sp.)。
2.2.2菌株SQ- 12- 3的生理生化鉴定
菌株SQ- 12- 3的生理生化特性见表1。
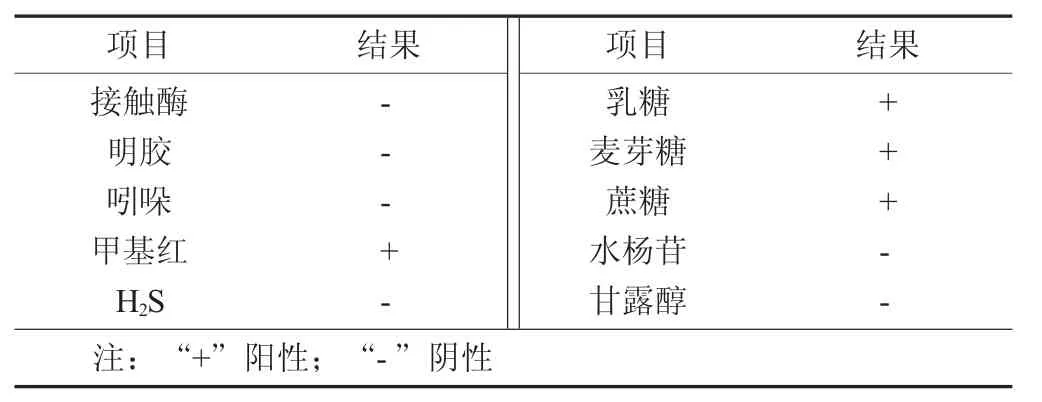
表1 菌株SQ- 12- 3的生理生化特性
由表1可知,在糖发酵试验中,可以利用乳糖、麦芽糖、蔗糖,不能利用水杨苷和甘露醇;并在生化试验中,接触酶试验呈阴性、明胶试验阴性、吲哚试验呈阴性及H2S试验呈阴性,甲基红试验呈阳性。综合以上,可初步判定菌株SQ- 12- 3为乳球菌属(Lactococcus sp.)。
2.3菌株SQ- 12- 3产细菌素的鉴定
2.3.1有机酸及过氧化氢作用的排除
乳酸菌的代谢产物(如有机酸、过氧化氢)会有一定的抑菌效果。在鉴定菌株SQ- 12- 3的抑菌作用前,要排除这些干扰因素。
菌株SQ- 12- 3发酵液和有机酸的抑菌作用见表2。

表2 菌株SQ- 12- 3发酵液和有机酸的抑菌作用
由表2可知,pH值6.0的乳酸和乙酸对指示菌均无抑菌作用,而除单核细胞增生李斯特氏菌的抑菌圈外,其他指示菌在pH值6.0的发酵液与原发酵液的抑菌圈大小差异不明显,表明在排除有机酸物质后,发酵液中仍存在其他抑菌物质;H2O2酶处理菌株SQ- 12- 3发酵液后,其抑菌圈比原发酵液抑菌圈略有减小,但除单核细胞增生李斯特氏菌的抑菌圈外,差异仍不明显,由此说明发酵液中除H2O2外还存在其他抑菌物质。
2.3.2菌体干扰的排除
菌株SQ- 12- 3发酵液与无菌体发酵液的抑菌作用见表3。

表3 菌株SQ- 12- 3发酵液与无菌体发酵液的抑菌作用
在排除菌体干扰试验中,通过试验比较菌株SQ- 12- 3发酵液与无菌体发酵液的抑菌效果。结果发现,除单核细胞增生李斯特氏菌外,发酵液经细菌过滤器处理后抑菌圈与原发酵液的抑菌圈大小差别基本不明显,由此说明菌体无抑菌作用。
2.3.3菌株酶稳定性的检测
发酵液与酶处理发酵液的抑菌作用见表4。

表4 发酵液与酶处理发酵液的抑菌作用
由表4可知,菌株SQ- 12- 3发酵上清液经胰蛋白酶、胃蛋白酶和蛋白酶K处理后均无抑菌作用。由此表明,发酵液中的抑菌物质对胰蛋白酶、胃蛋白酶和蛋白酶K均非常敏感。初步判定,该抑菌物质是一类具有蛋白质特性的细菌素。
2.4菌株SQ- 12- 3产酸及生长特性研究
菌株SQ- 12- 3产酸及生长特性动态曲线见图3。

图3 菌株SQ- 12- 3产酸及生长特性动态曲线
由图3可知,菌株SQ- 12- 3生长曲线的延滞期为4 h,该时期活菌数变化极其微小;4 h后进入对数生长期,活菌数呈对数增加;16 h后进入稳定期,该时期活菌数最大;20 h后进入衰亡期,活菌数呈下降趋势。由于延滞期的原因,前4 h内菌株pH值变化幅度极小;8 h后菌液pH值曲线急剧下降;菌株发酵18 h后,菌液pH值低至4.11。
2.5菌株最适生长温度
菌株SQ- 12- 3最适生长温度见图4。

图4 菌株SQ- 12- 3最适生长温度
由图4可知,当温度较低时,OD600 nm值随温度升高,而逐渐升高;当温度到达37℃时,OD600 nm值达到最大;当温度超过37℃时,OD600 nm值随温度升高而逐渐降低。其原因是乳酸菌的最适生长温度是35~43℃,温度超过或低于这个范围菌株的生长会受到抑制,故温度太低,菌株SQ- 12- 3的生长速度会很慢;温度太高,菌株SQ- 12- 3的活性会被抑制或丧失,造成菌体死亡。
2.6菌株SQ- 12- 3对盐的耐受性
菌株SQ- 12- 3对盐的耐受性见图5。

图5 菌株SQ- 12- 3对盐的耐受性
由图5可知,在低盐浓度下,菌株SQ- 12- 3的OD600 nm值无明显变化;当NaCl质量分数为7%时,OD600 nm值有下降趋势;当NaCl质量分数超过7%时,菌株SQ- 12- 3的OD600 nm值随质量分数增加而降低。原因是盐度增大,菌体的渗透压增大,会使细胞丧失活性,抑制了菌株SQ- 12- 3的生长。
3结论与讨论
从湖南省传统豆制品生产副产物豆清发酵液中分离出的5株菌株,以金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和单核细胞增生李斯特氏菌为指示菌,根据菌斑周围形成的抑菌圈大小挑选得到1株抑菌效果较好的菌株,编号为SQ- 12- 3。结合菌株生长特征、菌体形态及生理生化性质,初步将其鉴定为乳球菌属(Lactococcus sp.)。乳酸菌可通过单一的代谢产物或由有机酸、过氧化氢、二乙酰和细菌素,以及所生产的酶共同起作用[16]。国内外科研人员已发现的乳酸菌细菌素有40余种[17-20],但只有Nisin得到公认并应用于生产。通过排除有机酸、过氧化氢及菌株菌体的干扰并检测抑菌物质的蛋白酶稳定性,确定菌株SQ- 12- 3的抑菌活性物质为细菌素。通过鉴定菌株SQ- 12- 3的一系列生物学特性,该菌株最适生长温度在37℃,菌株在该温度下发酵18 h后菌液pH值低至4.11;当NaCl质量分数大于7%时,菌株SQ- 12- 3生长受到明显抑制。本研究为菌株的进一步发酵提供理论依据,并对从豆清发酵液中挖掘乳酸菌资源及循环再利用豆制品企业废水等研究均具有重要意义。
参考文献:
[1]凌代文,东秀珠.乳酸菌的分类鉴定及实验基础[M] .北京:中国轻工业出版社,1999:18-21.
[2]Ghanbari M,Jami M,Kneifel W,et al. Antimicrobial activity and partial characterization of bacteriocins produced by Lactobacilli isolated from sturgeon fish [J] . Food Control,2013,32:379-385.
[3]De Souza Barbosa M,Todorov S D,Ivanova I,et al. Improving safety of salami by application of bacteriocins produced by an autochthonous Lactobacillus curvatus isolate [J] . Food Microbiol,2015,46:254-262.
[4]Barbosa M S,Todorov S D,Jurkiewicz C H,et al. Bacteriocin production by Lactobacillus curvatus MBSa2 entrappedin calcium alginate during ripening of salami for control of Listeria monocytogenes [J] . Food Control,2015,47:147-153.
[5]贡汉生,孟祥晨.乳酸菌细菌素分类与作用机制[J] .食品与发酵工业,2008,34(1):105-108.
[6]李平兰,张篪,江汉湖.乳酸菌细菌素研究进展[J] .微生物学通报,1998,25(5):295-298.
[7]陈则华,李理.利用大豆黄浆水的发酵研究[J] .食品研究与开发,2007,28(3):42-46.
[8]于海峰,徐国华,卢松,等.酸浆中嗜酸乳杆菌在豆腐废水发酵中的条件研究[J] .发酵科技通讯,2011,40(1):21-23.
[9]刘平,李晓峰,谭新敏.利用大豆黄浆水发酵生产维生素B12的工艺探索[J] .陕西科技大学学报(自然科学版),2004,21(4):83-85.
[10]熊卫东,卫军.利用豆渣、黄浆水发酵生产曲酸的研究[J] .食品研究与开发,2004,25(4):52-57.
[11]布坎南R E,吉本斯N E,著.中国科学院微生物研究所,译.伯杰细菌鉴定手册[M] .北京:科学出版社,1984:136-141.
[12]腾利志,钱方,姜淑娟,等.产广谱细菌素乳酸菌的筛选及分类鉴定[J] .食品与机械,2014,29(6):45-48.
[13]周配东,潘道东,张玉千,等.产广谱细菌素乳酸菌的筛选及其所产细菌素的特性[J] .食品科学,2011,32(17):303-307.
[14]刘国荣,周康,李平兰,等.传统干酪中一株产Ⅱa类细菌素乳酸菌的分离与鉴定[J] .食品科学,2007,28(5):185-189.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M] .北京:科学出版社,2001:242-244.
[16]Pasteris S E,Pingitore E V,Ale C E,et al. Characterization of a bacteriocin produced by Lactococcus lactis subsp. Lactis CRL 1584 isolated from a Lithobates catesbeianus hatchery [J] . World J Microbiol Biotechnol,2014,30(3):1 053-1 062.
[17]李悦,孙玉梅,杨红,等.产细菌素乳酸菌的筛选及其发酵特性[J] .大连工业大学学报,2008,27(1):19-21.
[18]Saraiva M A F,Nes I F,Baracat-Pereira M C,et al. Purification and characterization of a bacteriocin produced by Lactococcus lactis subsp. Lactis PD6. 9 [J] . Journal of Microbiology and Antimicrobials,2014,6(5):79-87.
[19]Hwanhlem N,Jaffrès E,Dousset X,et al. Application of a nisin Z-producing Lactococcus lactis subsp. Lactis KT2W2L isolated from brackish water for biopreservation in cooked,peeled and ionized tropical shrimps during storage at 8℃under modified atmosphere packaging [J] . Eur Food Res Technol,2015(15):2 428-2 436.
[20]陈沛,王雪青,阮海华.产细菌素乳酸菌的筛选及其纯化和稳定性研究[J] .天津师范大学学报(自然科学版),2011,31(2):82-85.
Isolation and Identification of a Bacteriocin- producing Lactococcus sp. Strain Isolated from Fermented Soybean Processing Wastewater
SUN Jing1,ZHANG Chenfei1,*YIN Lebin1,2,KONG Xiaoting1,ZHOU Xinxing1,XIA Qiuliang1,ZHAO Liangzhong1
(1. Department of Biology and Chemical Engineering,Shaoyang University,Shaoyang,Hu'nan 422000,China;2. Soybean Processing Techniques of the Application and Basic Research Base in Hu'nan Province,Shaoyang,Hu'nan 422000,China)
Abstract:A bacteriocin- producing lactic acid bacteria strain designated as SQ- 12- 3 is isolated from natural fermentation broth of a soybean plant. By excluding the disturbances of organic acids and H2O2to antibacterial activity of indicator bacteria,and after the fermentation broth protein stability analysis,the antibacterial substance is determined as bacteriocin. On the basis of the colonies,cells morphology,dissolved calcium circle,physiological and biochemical characteristics,strain SQ- 12- 3 is preliminary identified as Lactococcus sp. The biological characteristics of strain SQ- 12- 3 show that,its optimum growth temperature is at 37℃,after 16 hours fermentation,the pH value reach 4.11 and it has a wider range of salt tolerance. When the NaCl concentration is greater than 7%,and the growth of this strain is significantly inhibited.
Key words:Lactococcus sp.;bacteriocins;fermented soybean processing wastewater
*通讯作者:尹乐斌(1982—),男,博士,讲师,研究方向为食品微生物。
作者简介:孙菁(1994—),女,本科,研究方向为食品质量与安全。
基金项目:湖南省大学生研究性学习和创新性实验计划项目(2014[445]);湖南省研究生科研创新项目(CX2015B604)。
收稿日期:2016- 01- 19
文章编号:1671- 9646(2016)03a- 0044- 05
中图分类号:Q935
文献标志码:A
doi:10.16693/j.cnki.1671- 9646(X).2016.03.012

