尿酸引发的氧化应激与相关疾病关系的研究
杭建花 陈 真(中国药科大学药学医学基础实验教学中心 南京 211198)
尿酸引发的氧化应激与相关疾病关系的研究
杭建花陈真*(中国药科大学药学医学基础实验教学中心南京211198)
摘要:尿酸是一种强大的促氧化剂,在黄嘌呤氧化还原酶(XOD)催化次黄嘌呤生成尿酸的过程中,会伴随活性氧分子(ROS)的生成,过量的ROS可在多种细胞(内皮细胞、脂肪细胞、免疫细胞等)中通过不同的信号通路导致细胞或组织器官产生多样的病理性改变,从而引发各种相关性病症或疾病。此外,尿酸具有抗氧化作用,对神经系统疾病有一定保护作用。
关键词:尿酸氧化应激活性氧信号通路疾病
尿酸(Uric acid,UA)是嘌呤代谢的最终产物,诸多因素如遗传的易感性、环境因素、治疗干预、营养失衡都会促使代谢紊乱,进而发展成高尿酸血症[1]。高尿酸会导致多种组织细胞产生氧化应激,如脂肪细胞[2]、血管平滑肌细胞(VSMCs)[3]、人脐静脉内皮细胞(HUVECs)[4]、胰岛β细胞[5]等。尿酸过高容易在关节、肾脏或皮下组织中形成病理性的尿酸钠和尿酸结晶,这会引发多种尿酸相关性疾病,如肿瘤溶解综合症、痛风等[6];高尿酸血症还会引发多种与痛风相关的并发症,尤其是高血压、糖尿病肾病;高尿酸血症还会伴随代谢综合征,包括如腹部肥胖、葡萄糖不耐受、胰岛素抵抗、血脂异常、高血压等[6]。
1 尿酸与氧化应激
尿酸是一种弱的有机酸,是人体内嘌呤核苷酸降解的终产物。黄嘌呤氧化还原酶(XOR)是参与嘌呤核苷酸降解的一种重要的酶,能够使次黄嘌呤氧化生成黄嘌呤,进而催化黄嘌呤氧化生成尿酸。在该反应中,活性氧自由基(reactive oxygen species,ROS)作为副产物产生,这种途径是ROS生成的关键来源。ROS包括分子氧及各种细胞氧化代谢产物,如超氧化物(O2-)、羟基自由基(OH-)。其他的还有如过氧化氢(H2O2)、过氧亚硝基阴离子(ONOO-)、次氯酸(HOCl)虽不是自由基,但也具有氧化性能[7]。因此,尿酸被认为是氧化应激的一个标志。然而,尿酸具有抗氧化作用,可作为自由基清除剂和过渡金属离子螯合剂(一种将金属离子转化为低活性状态的能力)起作用。
2 尿酸与心血管系统
活性氧(ROS)产生增强是导致血管内皮功能障碍的主要因素,主要机制是氧化应激引起一氧化氮(NO)生物利用度和/或信号的减少,从而影响血管张力,导致内皮功能障碍,ROS也会促使血管细胞增殖或迁移、炎症、细胞凋亡及细胞外基质的改变,所有这些与ROS相关的过程会导致高血压的发生[8]。ROS生成酶在血管组织中参与氧化应激,如NADPH氧化酶(NOX)、黄嘌呤氧化酶和线粒体呼吸链。超氧阴离子可直接与NO反应,从而促使NO与超氧阴离子反应产物过氧亚硝基阴离子(ONOO–)的生成,反过来使内皮型一氧化氮合酶(eNOS)解耦联,进而使一种抗动脉粥样硬化的NO生成酶变成一种ROS生成酶,加速动脉粥样硬化[9]。在内皮细胞中,尿酸抑制细胞增殖和诱导衰老与凋亡局部激活氧化应激和肾素-血管紧张素系统。
在血管系统中氧化应激的增加不仅发生在内皮细胞内,还发生在平滑肌细胞及外膜内。ROS产物增加对可溶性鸟苷酸环化酶和环磷酸鸟苷依赖性激酶I有重要影响,这些酶的活性和表达是由氧化还原敏感性调节的。当尿酸通过有机离子转运体进入血管平滑肌细胞后,会导致活性氧的生成,如过氧化氢、8异前列腺素[10],增加氧化应激和活化有丝分裂原活化蛋白激酶(ERK和p38),增加单核细胞趋化蛋白-1(MCP-1)的表达,导致促炎症效应[10]。
3 尿酸与脂肪组织
在脂肪细胞中,尿酸诱导氧化应激,刺激NADPH氧化酶或肾素-血管紧张素系统[11]。可溶性尿酸可促使ROS生成增加,刺激成熟的脂肪细胞中NADPH氧化酶使其活化,但对前脂肪细胞中的NADPH氧化酶无影响。近年有报道称肾素-血管紧张素系统抑制剂(氯沙坦、卡托普利)可防止尿酸诱导的活性氧的增加[11]。在3T3-L1脂肪细胞中,尿酸会导致活性氧生成增加,上调肾素-血管紧张素系统中相关蛋白(血管紧张素、血管紧张素转化酶-1、肾素、血管紧张素1受体、血管紧张素2受体)的表达以及导致血管紧张素II蛋白分泌增加[11]。尿酸刺激NADPH氧化酶产生ROS,活化丝裂原活化蛋白(MAP)激酶p38及细胞外信号调节激酶(ERK)1/2,降低NO的生物利用度,增加蛋白质亚硝基化和脂质氧化。最新的报道认为脂肪组织中氧化应激是导致与肥胖相关炎症和代谢综合征的主要致病因素,因此,由尿酸诱导的氧化修饰会导致脂肪组织功能障碍[12]。
超氧清除剂或NADPH氧化酶抑制剂可完全阻止脂肪细胞中尿酸诱导的MCP-1 mRNA表达的增加,这表明脂肪细胞中尿酸诱导的MCP-1蛋白表达和蛋白分泌的活化是由超氧依赖性ROS介导的,NADPH氧化酶也具有类似的作用[12]。18月龄的黄嘌呤氧化还原酶杂合基因敲除小鼠氧化应激水平增加,特征是产生丙二醛和过氧化氢,并伴随附睾脂肪组织中MCP-1 mRNA表达的增加[13]。
4 尿酸与免疫细胞
尿酸在免疫细胞(中性粒细胞、单核细胞、巨噬细胞)中通过氧化应激引发的一系列病理性改变是与炎症小体(主要是NLRP3炎症小体)息息相关的。炎症小体是一种大分子细胞内信号平台,包括细胞内的模式识别受体,如NOD样受体(nucleotidebinding oligomerization domain-like receptor,NLRs)[14]。在NLR炎症小体复合物中,对NLRP3炎症小体的报道最广泛,NLRP3是一个关键的信号节点,可控制两种促炎因子(IL-1β、IL-18)的成熟。模式识别受体的激活可招募适配器凋亡相关斑点样蛋白(C-terminal caspase recruitment domain,ASC),从而激活胱天蛋白酶-1(caspase-1)前体物转换成切割形式。caspase-1是一种众所熟知的炎性蛋白,能促进IL-1β和IL-18成熟体转变成活性细胞因子及通过自催化或活化导致细胞凋亡[15]。
尿酸盐晶体作为一种损伤相关分子模式信号(damage-associated molecular patterns,DAMPs)可激活NLRP3炎症小体。激活NLRP3炎症小体至少需要两种信号,信号I是启动信号,激活转录因子蛋白家族NF-κB通路,导致IL-1b前体物和NLRP3蛋白水平上调;信号II是由大量DAMP信号分子刺激介导,促使ASC和caspase-1前体物组装,激活NLRP3炎症小体复合物[15]。尿酸诱导ROS在巨噬细胞和单核细胞内生成,线粒体产生的ROS可引起NLRP3的激活;Toll样受体(Toll-like receptors,TLR)信号也伴随ROS的产生,但在缺乏第二种信号时不能激活NLRP3炎性小体。有研究表明线粒体产生的ROS会引起NF-κB介导NLRP3的上调和IL-1β前体物的表达但不会激活NLRP3炎症小体[15]。
尿酸盐晶体可以直接促使募集的中性粒细胞内的酪氨酸激酶产生磷酸化,进而产生大量超氧负离子,从而刺激中性粒细胞活化及炎症小体组装[16]。活化的中性粒细胞又可进一步通过自噬的发生及IL-1β等细胞因子的大量分泌而加剧尿酸盐沉积部位的炎性反应,最终导致炎性反应在机体中进一步放大[16]。巨噬细胞亦可直接吞噬尿酸盐晶体,同时产生大量ROS,直接促使炎症小体的活化。
5 尿酸与胰岛β细胞
高尿酸会在β细胞中诱导氧化应激的生成,从而导致细胞损伤,最终影响胰岛素的生成,主要机制是氧化应激会导致胰岛素基因表达必需转录因子的缺失,进而使得胰岛素生成和分泌减少[17]。此外,AMP活化蛋白激酶(AMPK)作为“代谢主开关”可通过抑制胰岛素原基因的表达参与β细胞中胰岛素的生成。尿酸会影响β细胞的增殖、胰岛素分泌、活性氧的水平、信号通路(AMPK和ERK)的激活[5]。
6 尿酸与神经系统
尿酸除了具有强大的促氧化作用,还具有一定的抗氧化作用。有文献报道高尿酸血症对神经退行性疾病的发生发展具有一定的保护作用,如帕金森综合症(Parkinson’s disease,PD)、多发性硬化症、阿尔茨海默症(老年痴呆症)。高尿酸水平会降低帕金森综合症发病风险及减缓疾病的进展[6]。尽管相关的机制有些复杂,但目前多数理论认为这与尿酸的抗氧化作用有关。
7 结语
随着高尿酸血症发生率的逐年上升,以及可诱导多种疾病发生发展,高尿酸的危害性逐渐受到各界人士关注。尿酸通过氧化应激使组织细胞产生大量的活性氧,导致内皮细胞、脂肪细胞、免疫细胞、胰岛β细胞等的损伤,最终引发诸如动脉粥样硬化、腹部肥胖、胰岛素抵抗等相关疾病。总之,由于血尿酸长期持续过高会引发多种危害,人们应及早重视高尿酸血症的发生,防患于未然。
参考文献
[1]Christian Kemmer. Self-sufficient control of urate homeostasis in mice by a synthetic circuit[J]. Nature Biotechnology,2010,28:4.
[2]Convento MS,Pessoa E,Dalboni MA,et al. Pro-inflammatory and oxidative effects of noncrystalline uric acid in human mesangial cells:contribution to hyperuricemic glomerular damage [J]. Urol. Res.,2011,39:21-27.
[3]Sautin YY,Nakagawa T,Zharikov S,et al. Adverse effects of the classic antioxidant uric acid in adipocytes:NADPH oxidasemediated oxidative/ nitrosativestress [J]. AmJ Physiol Cell Physiol,2007,293:C584-C596.
[4]Chao HH,Liu JC,Lin JW,et al. Uric acid stimulates endothelin-1 gene expression associated with NADPH oxidase in human aortic smooth muscle cells [J]. ActaPharmacol Sin,2008,29:1301-1312.
[5]Yongneng Zhang,et al.Uric acid induces oxidative stress and growth inhibition by activating adenosine monophosphate-activated protein kinase and extracellular signal -regulated kinase signal pathways in pancreatic b cells [J]. Molecular and Cellular Endocrinology,2013,375:89-96.
[6]Asim K Mandal,David B Mount.The Molecular Physiology of Uric Acid Homeostasis[J]. Annu. Rev. Physiol.,2015,77:323-345.
[7]Jacob George,et al. Role of urate,xanthine oxidase and the effects of allopurinol in vascular oxidative stress [J]. Vascular Health and Risk Management,2009:5:265-272.
[8]Eberhard Schulz,TommasoGori and Thomas Munzel. Oxidative stress and endothelial dysfunction in hypertension[J]. Hypertension Research,2011,34:665-673.
[9]Mollnau H,Wendt M,Szocs K,et al. Effects of angiotensin II infusion on the expression and function of NAD(P)H oxidase and components of nitric oxide/cGMP signaling[J]. Circ Res,2002,90:E58-E65.
[10]Yu MA,Sanchez Lozada LG,Johnson RJ,et al. Oxidative stress with an activa- tion of the renin-angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction[J]. J Hypertens,2010,28:123-142.
[11]JX Zhang,YP Zhang,QN Wu,et al. Uric acid induces oxidative stress via an activation of the renin -angiotensin system in 3T3-L1 adipocytes[J]. Endocrine,2015,48:135-142.
[12]W Baldwin,S McRae,GMarek,et al.Hyperuricemia as a mediator of the proinflammatory endocrine imbalance in the adipose tissue in a murine model of the metabolic syndrome [J]. Diabetes,2011,60(4):1258-1269.
[13]M Noboru,O Toshio,K Yasuo,et al. Mice heterozygous for the xanthine oxidoreductase gene facilitate lipid accumulation in adipocytes[J].Arterioscler. Thromb. Vasc. Biol.,2014,34(1):44-51.
[14]Mohamed Lamkanfi,and Vishva M Dixit. Inflammasomes and Their Roles in Health and Disease [J].Annu. Rev. Cell Dev. Biol.,2012,28:137-161.
[15]Eun -Kyeong Jo,Jin Kyung Kim,Dong -Min Shin,et al.
Molecular mechanisms regulating NLRP3 inflammasomeactivation [J]. Cellular & Molecular Immunology,2015:1-12.
[16]Mitroulis I,Kambas K,Chrysanthopoulou A,et al. Neutrophil extracellular trap formation is associated with IL-1 beta and autophagy -related signaling in gout [J]. PLoS One,2011,6(6):e29318.
[17]Matsuoka T,Kajimoto Y,Watada H,et al. Glycation-dependent,reactive oxygen species-mediated suppression of the insulin gene promoter activity in HIT cells [J]. J Clin Invest,1997,99:144-150.
对照组:给予阿莫西林,口服,2次/d,500mg/次,每日早、晚两餐后服用,1周为1个疗程。
1.5判定标准:症状程度分为0~Ⅲ级。无症状为0级;偶尔感觉到症状,不对正常生活造成影响为Ⅰ级;感到明显不适,对正常生活造成影响为Ⅱ级;不适感强烈,无法正常活动为Ⅲ级。
症状频度分为0~Ⅲ级。无症状发生为0级;偶发,持续时间短,仅数分钟为Ⅰ级;每天发生,但持续时间短,仅数分钟为Ⅱ级;频发,反复发作,持续时间>1h为Ⅲ级。
症状程度达到Ⅰ级同时症状频度达到Ⅰ级示为症状缓解。
1.6药敏试验:细菌鉴定和体外药敏试验采用VITEK全自动细菌分析仪严格按照操作说明书执行,药敏试验结果评价根据美国CLSI的抗微生物药物敏感性试验操作方法和判定标准[5]。
1.7统计学方法:数据采用SPSS20.00软件处理,计数资料用百分比表示,采用X2检验,计量资料用(±s)表示,采用t检验,P<0.05表示有显著差异。
2 结果
经过1个疗程的治疗,观察组有65例症状明显缓解,缓解率为95.6%,对照组有52例症状明显缓解,总缓解率为76.5%,观察组优于对照组,P<0.05,两组耐药性、HP根除率以及不良反应发生率见表1~2。
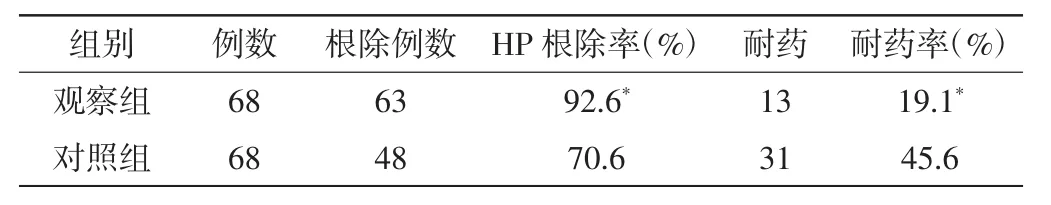
表1 两组耐药性和HP根除率比较(n)
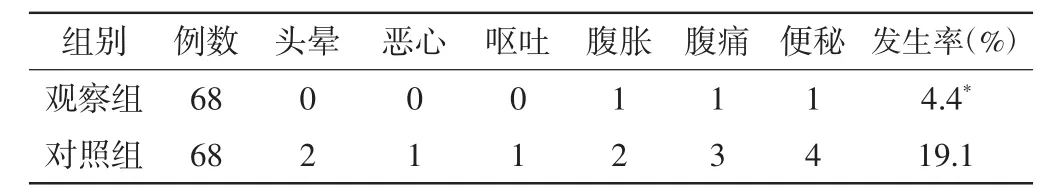
表2 两组不良反应发生率比较(n)
3 讨论
目前认为,治疗HP感染理想的方案为HP根除率>90%,溃疡能够迅速愈合,症状在短时间内消失,患者有良好的依从性,不会产生耐药性等[6]。针对HP感染引起的胃病,临床广泛采用阿莫西林、克拉霉素、呋喃唑酮等抗生素药物治疗,但随着药物的广泛应用,耐药性不断增高,不良反应增加,容易导致贫血或血小板减少,因此,阿莫西林等药物的使用尚存在局限性。
HP感染是导致胃病常见的原因,HP的侵入损害了胃的保护机制,胃酸侵袭胃壁而发病。HP是一种单极、多鞭毛、末端钝圆、螺旋形弯曲的微需氧菌,在胃黏膜上皮细胞表面常呈典型的螺旋状或弧形,环境氧的要求在5%~8%之间,所以在大气或绝对厌氧环境下是不能生长的。该细菌较易寄生在人体的胃部和十二直肠的黏膜组织中,会导致胃部pH值急剧下降,破坏人体胃部的正常胃酸环境[7]。除此之外,幽门螺旋杆菌还会在胃部不断繁衍,造成患者胃部胃黏膜损伤,进而导致胃的消化功能受到严重影响,形成胃炎,甚至发展成胃癌。
莫西沙星是一种为8-甲氧基氟喹诺酮类抗菌药物,也是第四代氟喹诺酮类广谱抗菌药物,这种药物的杀菌机制是通过DNA的螺旋酶和拓扑异构酶Ⅱ和Ⅳ达到抑制细菌生长的目的[8]。拓扑异构酶Ⅱ是解开DNA超螺旋的解旋酶,拓扑异构酶Ⅳ分离DNA复制过程中DNA分子的子链。莫西沙星抑制DNA的复制是通过与酶-DNA复合体相结合完成的,与其他氟喹诺酮类药物相比,其对革兰阳性菌、革兰阴性菌以及厌氧菌的抗菌活性非常强,该药物口服后吸收迅速、完全,首关消除不明显,在组织内的穿透性较好,从血浆中排除的平均半衰期为12h,且不受进食或空腹用药的影响,绝对生物利用度>90%。研究显示[9],以莫西沙星为基础的三联用药治疗明显优于质子泵抑制剂、阿莫西林、克拉霉素的标准三联用药,HP根除率较高,副作用小。莫西沙星的8-甲氧基部分可以提高对革兰氏阳性菌的活性,使其对厌氧菌的抗菌活性大大增强,同时还减少了耐药菌株的产生,使光素性大大降低。莫西沙星抗菌活性高,pk/pd参数良好,抗菌谱可覆盖全部呼吸道主要致病菌,杀菌作用快,过敏反应少。研究表明[10],莫西沙星不仅能够有效对人体微生菌起到良好的抗菌性,还对喹诺酮类药物的耐药性有良好的敏感作用。
综上所述,莫西沙星治疗HP感染胃病可有效清除HP,提高治疗效果,患者依从性良好,不良反应少。本组研究中,观察组缓解率为95.6%,对照组缓解率为76.5%,观察组优于对照组,P<0.05,观察组不良反应、HP根除率以及耐药率方面均优于对照组,均P<0.05,可见莫西沙星有良好的抗菌效果,治疗HP感染胃病疗效确切,效果较满意。
[1]陈清波,王洪波,郭银,等.慢性胃病伴肠上皮化生、胃癌与幽门螺旋杆菌感染的关系[J].实用癌症杂志,2010(2):169-171.
[2]刘爱群,葛莲英.幽门螺旋杆菌感染与胃癌变相关基因研究进展[J].现代肿瘤医学,2010(9):1860-1862.
[3]吴锡琛.消化道内镜术[M].南京:江苏科技出版社,1992.
[4]中华医学会消化病学分会.幽门螺杆菌若干问题的共识意见[J].胃肠病学,2000,5(1):5-7.
[5]杨启文,王辉.抗菌药物敏感性试验最新动向:2010年CLSIM100-S20主要更新内容[J].中华检验医学杂志,2010,33 (6):488-491.
[6]樊慧丽,陈玉梅,孙建顺,等.幽门螺旋杆菌感染与相关疾病发病机制的研究进展[J].中国医师杂志,2010(12):1726-1728.
[7] Tanigawa T,Ahluwalia A,Watanabe T,et al.Nerve growth factor injected into the gastric ulcer base incorporates into endothelial,neuronal,glial and epithelial cells: implications for angiogenesis,mucosal regeneration and ulcer healing [J].J Physiol Pharmacol,2015,66(4):617-621.
[8]黄道秋,李柏群.莫西沙星的药理作用特性与应用概况[J].中国医院用药评价与分析,2007(2):93-95.
[9]詹春光,李健.莫西沙星三联疗法根除幽门螺杆菌感染的临床研究[J].实用医学杂志,2010(6):1032-1033.
[10]杨俊,张春娟,高永贵.喹诺酮类抗菌药物——莫西沙星的临床应用[J].哈尔滨医药,2011(6):458-459.
·经验交流·
*通讯作者用,1周为1个疗程。
中图分类号:R363
文献标识码:B
文章编号:1672-8351(2016)04-0137-03

