不同剂量硼替佐米BDT方案治疗新诊断多发性骨髓瘤的近期疗效及安全性
罗文丰 赵攀 魏锦 娄世锋
【摘要】 目的:探讨不同剂量硼替佐米的BDT(硼替佐米/地塞米松/沙利度胺)方案治疗新诊断多发性骨髓瘤的近期疗效及安全性。方法:将2011年6月-2014年6月本院收治的40例新诊断多发性骨髓瘤患者用随机数字表法分为小剂量组和标准剂量组,每组20例。所有患者均采用BDT方案化疗,标准剂量组分别于第1、4、8、11天给予硼替佐米1.3 mg/m2皮下注射,第1~2、4~5、8~9、11~12天给予地塞米松40 mg,静脉滴注,沙利度胺100 mg,每晚睡前顿服。小剂量组将硼替佐米的剂量减少至1.0 mg/m2,其余同标准剂量组。3周为一疗程,治疗时间2~4疗程。所有患者在治疗前及每个疗程结束后进行血常规、肝肾功能、电解质、免疫球蛋白、β2-微球蛋白、血尿免疫固定电泳等常规检查,观察患者临床疗效及不良反应发生情况并及时进行记录。结果:化疗2个疗程及4个疗程后,两组患者整体疗效、总反应率(ORR)和完全反应率(CRR)比较,差异无统计学意义(P>0.05),小剂量组完成4个化疗疗程的患者所占比例高于标准剂量组,但比较差异无统计学意义(P>0.05)。小剂量组消化道反应、周围神经病变程度和血液系统毒性等不良反应发生率均低于标准剂量组,消化道反应、周围神经病变程度也较标准剂量组更轻微,但比较差异无统计学意义(P>0.05),且消化道反应程度、周围神经病变程度与硼替佐米剂量不存在明显的相关性(P>0.05)。小剂量组严重消化道反应(3~4级)发生率低于标准剂量组,比较差异有统计学意义(P<0.05)。结论:小剂量硼替佐米的BDT方案治疗新诊断多发性骨髓瘤近期疗效较为满意,同时一定程度上降低了消化道反应、周围神经病变及血液系统毒性等不良反应的发生率和严重程度,有利于提高治疗的依从性。
【关键词】 硼替佐米; 沙利度胺; 地塞米松; 多发性骨髓瘤
【Abstract】 Objective:To investigate the recent curative effect and security of newly diagnosed multiple myeloma treating with BDT(Bortezomib combined with Dexamethasone and Thalidomide) scheme of different doses of Bortezomib.Method:Forty patients with newly diagnosed multiple myeloma in our hospital from June 2011 to June 2014 were divided into small dose group and standard dose group according to the random number table,20 patients in each group.All the patients were treated with BDT scheme,the standard dose group was given 1.0 mg/m2 Bortezomib through subcutaneous injection at d 1,4,8,11,40 mg Dexamethasone through intravenous drip at d 1-2,4-5,8-9,11-12 and 100 mg Thalidomide taken before bedtime for treatment.The small dose group was given the same therapy as the standard dose group except reducing the dosage of Bortezomib to 1.0 mg/m2.The treatment time was 2-4 courses,3 weeks for each course.All the patients got tests of blood routine examination,hepatic and renal function,immune globulin,β2-microglobulin and immunofixation electrophoresis of hematuresis before treatment and after each course of treatment.The clinical efficacy and adverse reactions of all patients were observed and recorded.Result:After 2 and 4 coursed of chemotherapy,the overall effect, overall response rate(ORR) and complete response rate(CRR) of the two groups had no statistically significant difference(P>0.05),the proportion of patients who completed four courses of chemotherapy of the small dose group was higher than that of the standard dose group,but the difference was not statistically significant(P>0.05).The adverse reactions incidence of digestive tract reaction,peripheral neuropathy and blood system toxicity of the small dose group were lower than those of the standard dose group,and the degree of digestive tract reaction and peripheral neuropathy were more mild,but the differences were not statistically significant(P>0.05),and there was no obvious correlation between the digestive tract reaction,peripheral neuropathy and the doses of Bortezomib(P>0.05).The incidence of serious digestive tract reactions(3-4 degree) in the small dose group was lower than that in the standard dose group,the difference was statistically significant(P<0.05).Conclusion:The recent curative effect of newly diagnosed multiple myeloma treating with small doses of Bortezomib is satisfied,and it can partly reduce the incidence and severity of adverse reactions such as gastrointestinal tract reaction and peripheral neuropathy,it is conducive to improve treatment compliance.
【Key words】 Bortezomib; Thalidomide; Dexamethasone; Multiple myeloma
First-authors address: Chongqing Medical University,Chongqing 400016,China
doi:10.3969/j.issn.1674-4985.2016.07.003
多发性骨髓瘤(multiple myeloma,MM)约占血液系统恶性肿瘤的10%,多发生于中老年人群,以浆细胞异常克隆及增殖为特征[1]。其治疗手段主要包括造血干细胞移植(ASCT)和化疗,ASCT的完全缓解率可达25%~75%,且能明显延长无病存活及生存期,但由于其在患者年龄、体质、肾功能以及并发症等方面的限制,使其难以得到广泛开展和实施[2]。另外,适合ASCT治疗的患者在ASCT治疗前也常需进行化疗诱导治疗[3]。故临床上MM的早期治疗仍以化疗为主。近年来的研究发现,硼替佐米联合传统方案化疗对MM能起到相互协同作用,起效快,临床缓解率高[4]。但同时却增加了消化道反应、周围神经病变等不良反应的发生率,限制了硼替佐米的疗效发挥。本科将不同剂量硼替佐米的BDT方案应用于新诊断MM的治疗,现将近期疗效及不良反应发生情况进行对比分析,报道如下。
1 资料与方法
1.1 一般资料 选择2011年6月-2014年6月在本院接受化疗的40例新诊断MM患者为研究对象,所有患者经详细病史采集、查体及相关辅助检查明确诊断,均为新诊断的MM患者,预计生存期>6个月,且化疗时间≥2个疗程。采用随机数字表法将所有患者分为小剂量组和标准剂量组,每组20例。小剂量组男12例,女8例;年龄40~72岁,平均(51.3±8.8)岁,其中40~59岁11例,60~72岁9例;骨髓瘤类型:IgG型9例,IgA型6例,轻链型5例;ISS国际分期:Ⅰ期5例,ⅡA期6例,ⅢA期6例,ⅢB期3例。标准剂量组男13例,女7例;年龄38~71岁,平均(50.7±9.2)岁,其中40~59岁12例,60~71岁8例;骨髓瘤类型:IgG型10例,IgA型6例,轻链型4例;ISS国际分期:Ⅰ期6例,ⅡA期6例,ⅢA期5例,ⅢB期3例。两组患者在性别、年龄、骨髓瘤类型、临床分期等方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法 所有患者均采用BDT方案化疗,标准剂量组分别于第1、4、8、11天给予硼替佐米1.3 mg/m2皮下注射;第1~2、4~5、8~9、11~12天
给予地塞米松40 mg,静脉滴注;沙利度胺100 mg,每晚睡前顿服。小剂量组将硼替佐米剂量减少至
1.0 mg/m2,其余同标准剂量组。3周为一疗程,治疗时间2~4个疗程。所有患者在治疗前及每个疗程结束后进行血常规、肝肾功能、电解质、免疫球蛋白、β2-微球蛋白、血尿免疫固定电泳等常规检查,注意观察不良反应发生情况并及时进行记录。
1.3 评价标准
1.3.1 疗效评价 参考《中国多发性骨髓瘤诊治指南》中的疗效评价标准,于化疗2个疗程及4个疗程后分别对临床疗效进行评价。分为严格意义的完全缓解(sCR)、完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)[5]。总反应率(ORR)=(sCR例数+CR例数+VGPR例数+PR例数)/总例数×100%,完全反应率(CRR)=(sCR例数+CR例数+VGPR例数)/总例数×100%。
1.3.2 不良反应评价 按照国际癌症协会毒副反应统一命名标准(NCI CTCAE)对化疗过程中的不良反应进行判断和评价[6]。
1.4 统计学处理 采用SPSS 13.0 统计学软件对数据进行处理,计数资料以率(%)表示,比较采用 字2检验,计数资料的相关分析和等级资料的比较采用Ridit分析,以P<0.05为差异有统计学意义。
2 结果
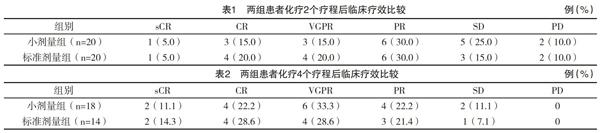
2.1 临床疗效 化疗2个疗程结束后,两组患者整体疗效经Ridit分析,比较差异无统计学意义(u=0.630,P=0.529);标准剂量组ORR、CRR(75.0%,45.0%)均略高于小剂量组(65.0%,35.0%),但差异比较均无统计学意义( 字2=0.476,P=0.490; 字2=0.417,P=0.519),见表1。因严重不良事件以及治疗依从性差等因素,标准剂量组和小剂量组分别有14例和18例患者完成了4个疗程的化疗,两组患者4个疗程的整体疗效比较,差异无统计学意义(u=0.502,P=0.616);标准剂量组ORR、CRR(92.9%,71.4%)均略高于小剂量组(88.9%,66.7%),但比较差异均无统计学意义( 字2=0.053,P=0.819; 字2=0.009,P=0.923),见表2。
2.2 不良反应
2.2.1 消化道反应 两组患者化疗过程中均出现不同程度的腹泻、食欲减退、恶心呕吐、便秘等,经对症处理后均缓解。标准剂量组出现消化道反应14例(70.0%),其中1级3例,2级5例,
3级5例,4级1例;小剂量组出现消化道反应10例(50.0%),其中1级5例,2级5例。小剂量组消化道反应发生率低于标准剂量组,但比较差异无统计学意义( 字2=1.667,P=0.197),而小剂量组严重消化道反应(3~4级)发生率明显低于标准剂量组,比较差异有统计学意义
( 字2=4.902,P=0.027)。另外,经计数资料的相关分析, 字2=6.000,P=0.112,Pearson列联系数=0.447,提示消化道反应程度与硼替佐米剂量不存在相关性。
2.2.2 周围神经病变 两组患者化疗过程中均出现周围神经病变,主要表现为肢体麻木、疼痛等,对出现2级及2级以上周围神经病变患者,适当降低沙利度胺和硼替佐米的剂量,直至周围神经病变消失或恢复至1级。标准剂量组出现周围神经病变12例(60.0%),其中1级5例,2级4例,3级3例;小剂量组出现周围神经病变10例(50.0%),其中1级7例,2级3例。小剂量组周围神经病变发生率略低于标准剂量组,但比较差异无统计学意义( 字2=0.404,P=0.525),而小剂量组严重周围神经病变(3~4级)发生率低于标准剂量组,但比较差异亦无统计学意义( 字2=1.441,P=0.230)。另外,经计数资料的相关分析, 字2=3.322,P=0.190,Pearson列联系数=0.362,提示周围神经病变程度与硼替佐米剂量不存在相关性。
2.2.3 血液系统毒性 化疗过程中,标准剂量组出现白细胞减少6例(30.0%),血小板减少7例(35.0%),小剂量组出现白细胞减少5例(25.0%),血小板减少5例(25.0%),均为1级或2级,程度较轻微,均未给予特殊处理。两组患者白细胞减少及血小板减少发生率比较,差异均无统计学意义
( 字2=0.125,P=0.723; 字2=0.476,P=0.490)。
2.2.4 其他不良反应 化疗过程中,两组均有个别患者出现感染,主要表现为发热和带状疱疹,经对症处理后均缓解。标准剂量组发热5例(25.0%),带状疱疹3例(15.0%);小剂量组发热4例(20.0%),带状疱疹2例(10.0%)。两组患者发热及带状疱疹发生率比较,差异均无统计学意义( 字2=0.143,P=0.705; 字2=0.000,P=1.000)。
3 讨论
多发性骨髓瘤常规的化疗方案可以使病情得到控制,但只有极少数的患者可获得完全缓解,如MP(马法兰/泼尼松)、MPT(马法兰/泼尼松/沙利度胺)、VAD(长春新碱/阿霉素/地塞米松)等方案治疗后,患者完全缓解率仅为3%~10%[7]。效果不够理想。另外,大剂量长时间应用烷化剂马法兰常会导致骨髓纤维化、骨髓功能衰竭而造成永久性造血干细胞损害,并且为减少风险,治疗时需有干细胞移植支持,而使存在肾功能损伤者产生用药禁忌[8];VAD方案起效较快,对造血干细胞抑制较轻,且无肾功能损害作用,但因其心脏毒性和对感染、末梢神经损伤的不可逆性影响,限制了其在临床的广泛应用[9]。
硼替佐米是第一种人工合成的可逆性蛋白酶体竞争性抑制剂,主要通过与酶活化位点的紧密结合选择性地抑制蛋白酶体活性,抑制泛素-蛋白酶体通路,从而抑制某些特异性蛋白的水解,抑制细胞生长和存活途径,诱导细胞凋亡[10-11];其还可通过抑制黏附分子的表达,减少肿瘤细胞迁移,抑制血管生成基因的表达,从而起到杀伤肿瘤细胞的作用,同时提高其他化疗药物的敏感性[12];另外,硼替佐米能抑制转录因子NF-κB的活化,降低破骨细胞活性,促进MM患者的新骨形成和骨质修复,同时诱导骨髓瘤细胞的凋亡[13-14];通过降低IL-6的分泌干扰骨髓微环境,从而达到治疗MM的目的[15]。Jagannath等[16]对初治MM患者给予1.3 mg/m2常规剂量的硼替佐米治疗2个疗程后,CR、接近CR(nCR)、PR分别为3%、9%和28%,总有效率达40%,而最终完成最长6个疗程的化疗后,总有效率达到88%。IFM进行的硼替佐米Ⅱ期临床实验结果显示,48例MM患者在接受4个疗程的BD方案化疗后,CR为21%,VGPR为10%,总有效率达66%,且治疗过程中未出现静脉血栓形成,血液学毒性也均低于2级[17]。IFM的Ⅲ期临床实验结果显示,与VAD方案相比,BD方案化疗能明显提高MM患者诱导后以及移植后的CR、nCR及VGPR,同时延长了无进展生存期[18]。Cavo等[19]关于移植前诱导治疗MM的研究显示,BDT方案治疗后CR、nCR、VGPR均明显高于TD方案治疗的对照组,而移植后进行原方案巩固治疗后BDT组CR、nCR、VGPR也均明显高于TD方案的对照组(40%、52%、79% vs 31%、41%、64%),但研究中BDT方案组中重度周围神经病变发生率也高于对照组。以上研究均表明,硼替佐米单用或联合传统化疗治疗MM具有较好的临床疗效,但同时却增加了不良反应发生率及严重程度。基于硼替佐米在MM治疗中的优缺点以及新诊断MM的特点,本研究分别采用标准剂量和小剂量硼替佐米的BDT方案进行治疗,化疗2或4个疗程后发现,两组整体疗效、ORR和CRR比较,差异均无统计学意义(P>0.05),而小剂量组完成4个疗程化疗患者所占比例更高,表明小剂量硼替佐米的BDT方案治疗MM同样具有良好的临床疗效,且治疗依从性更佳。小剂量组在消化道反应、周围神经病变、血液系统毒性等方面不良反应发生率均低于标准剂量组,且消化道反应、周围神经病变程度也较标准剂量组更轻微,虽然研究结果显示消化道反应、周围神经病变程度与硼替佐米剂量并不存在明显的相关性(P>0.05),但小剂量组严重消化道反应和周围神经病变发生率较标准剂量组均有较明显的降低,这与杜朝阳等[20]关于减低剂量的硼替佐米能明显降低3~4级周围神经病变发生率的研究结果基本一致。而分析不良反应与硼替佐米剂量相关性不明显的原因,可能与本研究样本量较小、样本选择较局限(仅为新诊断MM患者)且仅对近期不良反应进行评价等因素有关。但本研究结果和相关文献的总结,仍提示硼替佐米的剂量可能是诱发周围神经病变等不良事件的主要因素,而对于新诊断MM患者,小剂量硼替佐米可能在保证短期较好疗效的同时,降低化疗中的不良反应发生率及严重程度,提高患者治疗的依从性。
综上所述,小剂量硼替佐米的BDT方案治疗新诊断多发性骨髓瘤具有较好的近期疗效,同时一定程度上降低了消化道反应、周围神经病变等不良反应的发生率和严重程度,提高了治疗依从性。但由于样本量过小,治疗及随访时间较短,小剂量硼替佐米BDT方案治疗新诊断多发性骨髓瘤的远期疗效以及不良反应严重程度是否确与硼替佐米剂量存在相关性仍有待进一步的随机大样本研究加以证实。
参考文献
[1]刘志刚,牛挺.多发性骨髓瘤诊治进展[J].肿瘤预防与治疗,2009,22(4):447-451.
[2]钟玉萍,陈世伦,李新,等.硼替佐米为主的化疗方案治疗60例多发性骨髓瘤患者的临床分析[J].中国实验血液学杂志,2009,17(1):214-217.
[3] Moreau P,Attal M,Facon T.Frontline therapy of multiple myeloma[J].Blood,2015,125(20):3076-3084.
[4]钟玉萍,陈世伦,李新,等.硼替佐米联合其他药物治疗30例多发性骨髓瘤患者的临床观察[J].中华内科杂志,2008,47(2):137-138.
[5]中国医师协会血液科医师分会,中华医学会血液学分会,中国多发性骨髓瘤工作组.中国多发性骨髓瘤诊治指南(2011年修订)[J].中华内科杂志,2011,50(10):892-896.
[6] Cancer Therapy Evaluation Program.Common terminology criteria for adverse events v3.0(CTCAE),DCTD,NCI,NIH,DHHS[S].2003.
[7]徐丽丽,邱慧颖,胡晓霞,等.含硼替佐米的联合化疗方案治疗初诊多发性骨髓瘤患者的疗效比较[J].中华血液学杂志,2014,35(5):448-450.
[8] Tricot G,Jagannath S,Vesole D H,et al.Hemalopoietic stem cell transplants for multiple myeloma[J].Leuk Lymphoma,1996,22(1-2):25-36.
[9]潘敬新,吴传宗,吴顺荣,等.改良VAD联合马法兰治疗多发性骨髓瘤的临床研究[J].临床血液学杂志,2000,13(2):64-66.
[10]陈兵.蛋白酶体抑制剂-硼替佐米在侵袭性恶性淋巴瘤治疗中的应用[J].药物与临床研究,2010,18(2):104-106.
[11]陆世丰,陆化,沈文怡,等.蛋白酶体抑制剂硼替佐米对K562细胞株NF-κB活性及ICAM-1表达的影响[J].中国实验血液学杂志,2008,16(5):1006-1009.
[12]李迎春,王慧涵,李佳,等.硼替佐米增加耐药白血病细胞株K562/DNR对化疗药物的敏感性[J].现代肿瘤医学,2013,21(3):474-477.
[13]杨永健,钱震.硼替佐米为主化疗方案治疗多发性骨髓瘤12例疗效分析[J].兵团医学,2013,38(4):27-29.
[14]周伟民,金培英,平金良,等.硼替佐米抑制核因子-κB活化对LOVO细胞增殖的影响[J].温州医学院学报,2010,40(2):156-159,163.
[15] Hideshima T,Richardson P,Chauhan D,et al.The proteasome inhibitor PS-341 nihibits growth,niduces apoptosis,and overcomes drug resistance in human multiple myeloma cells[J].Cancer Res,2001,61(7):3071-3076.
[16] Jagannath S,Durie B G,Wolf J,et al.Bortezomib therapy alone and in combination with dexamethasone for previously untreated symptomatic multiple myeloma[J].Br J Haematol,2005,129(6):776-783.
[17] Harousseau J L,Attal M,Leleu X,et al.Bortezomib plus dexamethasone as induction treatment prior to autologous stem cell transplantation in patients with newly diagnosed multiple myeloma: results of an IFM phase Ⅱ study[J].Haematologica,2006,91(11):1498-1505.
[18] Harousseau J L,Attal M,Avet-Loiseau H,et al.Bortezomib plus dexamethasone is superior to vincristine plus doxorubicin plus dexamethasone as induction treatment prior to autologous stem-cell transplantation in newly diagnosed multiple myeloma: results of the IFM 2005-01 phase Ⅲ trial[J].J Clin Oncol,2010,28(30):4621-4629.
[19] Cavo M,Tacchetti P,Patriarca F,et al.Superior complete response rate and progression-free survival after autologous transplantation with up-front velcade-thalidomide-dexamethasone compared with thalidomide-dexamethasone in newly diagnosed multiple myeloma[J].Blood,2008,112(11):65.
[20]杜朝阳,杨如玉,李超,等.减低剂量及标准剂量硼替佐米联合疗法对不同类型多发性骨髓瘤的近期疗效对比[J].中国医师进修杂志,2014,37(7):43-45.
(收稿日期:2015-11-02) (本文编辑:王宇)

