中国沙棘和西藏沙棘叶中化学成分的UPLC/Q睺OF睲S快速分析
秦振娴 张瑜 齐梦蝶 张权 刘爽 李旻辉 刘永刚 刘勇

[摘要]基于UPLC/QTOFMS技术对中国沙棘和西藏沙棘叶中的化学成分进行定性分析,比较两沙棘叶中成分差异。采用Waters ACQUITY UPLCT3色谱柱(21 mm×100 mm,17 μm),以乙腈(A)水溶液(B)为流动相梯度洗脱,体积流量05 mL·min-1;在电喷雾负离子模式下采集数据。离子源相关参数:毛细管电压为2 000 V,锥孔电压为40 V,离子源温度为100 ℃,碰撞气体为氩气,鞘流气流量为900 L·h-1,鞘流气温度为450 ℃。结合质谱数据及文献数据,分析、推断出35个化合物,主要为黄酮类成分。其中,29个化合物为两沙棘共有成分,剩余的6个成分中,2个成分为中国沙棘特有,其余为西藏沙棘独有,研究表明两沙棘叶在成分组成上差异较小。采用UPLC/QTOFMS技术,可有效地对中国沙棘和西藏沙棘叶中成分进行快速分析,为今后合理开发利用沙棘资源提供科学依据。
[关键词]UPLC/QTOFMS;中国沙棘叶;西藏沙棘叶;黄酮类化合物
[Abstract]The study is aimed to analyze the chemical components in leaves of Chinese seabuckthorn and Tibetan seabuckthorn qualitatively and compare the differences between them by using ultra performance liquid chromatography coupled with quadrupoletimeofflight mass spectrometry (UPLC/QTOFMS)The chromatographic separation of the components was achieved ona Waters ACQUITY UPLCT3 column (21 mm×100 mm, 17 μm)using gradient mobile phase consisting of acetonitrile (A) and aqueous solution (B) The identification of the separated compounds was performed on atandem mass spectrometry (MS/MS)by fragmentation patterns under the negative electrospray ionization The parameters of ion source were as follows:capillary voltage, 2 000 V; Cone voltage, 40 V The ion source temperature, 100 ℃; collision gas argon; sheath gas flow rate, 900 L·h-1; sheath gas temperature, 450 ℃ Through the analysis of mass spectrometry data and with the help of literature data, a total of 35 compounds were detected and most of them were flavonoids Among these compounds, 29 were common components for the two species, two components were unique to Chinese seabuckthorn and 4 were characteristic components of Tibetan seabuckthorn The results indicated that the compositions of the two kinds of seabuckthorn leaves were quite similar It is also demonstrated that UPLC/QTOFMS method could be applied to rapidly and effectively analyze and speculate the compounds in leaves of Chinese seabuckthorn and Tibetan seabuckthorn
[Key words]UPLC/QTOFMS; Chinese seabuckthorn; Tibetan seabuckthorn; flavonoids
doi:10.4268/cjcmm20160816
沙棘Hippophae rhamnoides L,胡颓子科沙棘属植物,又名酸刺、沏其日干(蒙名)、达普(藏名)、吉汗(维吾尔名)等,《中国药典》中以果实入药,具有健脾消食,止咳祛痰,活血散瘀的功效[12]。沙棘作为一种药食同源植物,含有丰富的营养物质和生物活性成分,主要活性成分沙棘黄酮,在保护心血管系统、改善血液系统、增强免疫、抗氧化、抗癌、抗过敏、抑菌等方面均具有显著的药理活性,成为衡量沙棘产品质量和理化鉴别的重要指标[34]。近年来研究发现,沙棘叶中也含有大量活性成分,且具有产量大、易收集、采集周期长、生产工艺简单、易贮藏等优于果实的自然优势[5]。研究证实,紫外辐射、光照强度、温度等环境因素均可明显影响黄酮类成分的合成,从而导致化学成分变化(成分组成和含量变化)。本研究中所选用的2样品中国沙棘和西藏沙棘叶地理分布和生长环境不同,前者分布于海拔800~3 600 m温带地区向阳的山嵴、谷地、干涸河床地或山坡,后者一般植株矮小,分布在海拔5 000 m以上的高寒地区的植株[6]。综上所述,本实验基于UPLC/QTOFMS技术,建立中国沙棘H. rhamoides subsp sinensis Rousi和西藏沙棘H tibetana Schlechtend叶中化学成分快速鉴定的分析方法,分析、比较两沙棘叶中成分特征,不仅有利于阐明沙棘叶中的药效物质基础,也对今后科学开发沙棘资源和扩大沙棘原料来源有重要意义。
1材料
ACQUITY IClass 超高效液相色谱仪WatersXevoG2SQTOF MS质谱系统(美国Waters公司),数据采集与处理采用Masslynx 41软件;BSA224S型1/1万分析天平(德国Sartorius公司);Centrifuge 5415D型离心机(德国Eppendorf公司);SB800DTD型超声清洗机,超声功率500W(宁波新芝生物科技股份有限公司);Pacific TⅡ型超纯水仪(美国Thermo公司);022 μm hydrohpobic疏水PTFE微孔滤头(Millipor公司,美国)。
槲皮素(批号 117395,纯度≥98%)、芦丁(批号 153184,纯度≥98%)、槲皮苷(批号 522123,纯度≥98%)、异鼠李素3O葡萄糖苷(批号 5041827,纯度≥98%)对照品均购于上海源叶生物科技有限公司;山柰酚(批号 MUST13121112,纯度≥98%,购于成都曼思特生物科技有限公司);杨梅素(批号 529442,纯度≥98%)、异鼠李素(批号 480193,纯度≥98%)、异槲皮苷(批号21637252,纯度≥98%)、鞣花酸(批号 476664,纯度≥98%)对照品均购于北京四面体生物科技有限公司;水为超纯水,甲醇、乙腈为色谱纯(美国Fishier Scientific公司),其余试剂均为分析纯;沙棘叶采自内蒙古包头,经北京中医药大学生药系石晋丽教授鉴定其原植物为中国沙棘H. rhamoides subsp sinensis和西藏沙棘H tibetana。
2方法
21色谱条件超高效液相采用Waters ACQUITY UPLCT3色谱柱(21 mm×100 mm,17 μm,美国Waters公司);流动相A为乙腈、B为水溶液,梯度洗脱0~2 min,5%~11%A;2~9 min,11%~23%A;9~95 min,23%~40%A;95~105 min,40%~60%A;105~11 min,60%~98%A;11~13 min,98%~98%A;13~133 min,98%~5%A;柱温25 ℃;体积流量05 mL·min-1;进样体积1 μL;紫外检测波长190~400 nm。
22质谱条件质谱系统采用电喷雾离子源(ESI),负离子模式扫描;扫描范围m/z 50~1 500;离子源参数毛细管电压为2 000 V,锥孔电压为 40 V,离子源温度为 100 ℃,鞘流气为氮气,900 L·h-1,鞘流气温度为450 ℃,扫描时间为02 s,碰撞气体为氩气。低能量扫描时碰撞能量为6 eV,高能量扫描时碰撞能量为25~45 eV。
23供试品溶液制备沙棘叶经50 ℃减压干燥,粉碎,过50目筛,石油醚脱脂。称量沙棘叶粉末1 g,加入甲醇15 mL,加热回流2 h,放冷,滤过,残渣再分别加125 mL甲醇,加热回流2次,每次1 h,滤过,合并滤液,经微孔滤膜(022 μm)过滤,即得。
24对照品溶液制备精密称取槲皮素、杨梅素、异鼠李素、山柰酚、槲皮苷、异槲皮苷、芦丁、鞣花酸、异鼠李素3O葡萄糖苷各1 mg,分别置于10 mL量瓶中,用甲醇溶解并定容至刻度,摇匀,得相应的9个对照品溶液。精密量取各标准储备液适量,混匀,将此溶液用甲醇稀释质量浓度至1 mg·L-1,过022 μm微孔滤膜,备用。
3结果与分析
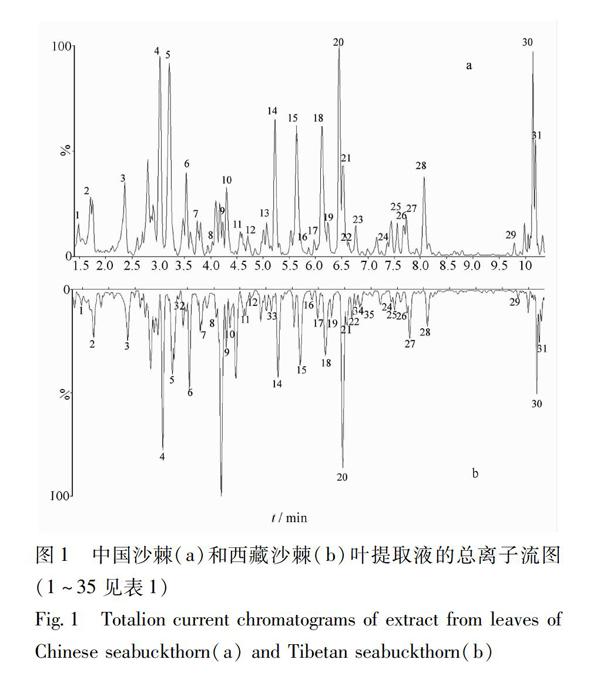
31中国沙棘叶中化合物的鉴别沙棘叶中化合物主要为黄酮类物质,因黄酮类化合物分子中的羟基易形成稳定的氧负离子,使用ESI 离子源,负离子模式检测所得总离子流图(图1)信噪比好,有较低的背景值,并且负离子模式形成的母离子通常为[M-H]-,比较单一,易于辨识[79]。所得总离子流图与紫外检测色谱图基本吻合。通过对色谱峰做二级质谱研究,35个化合物的准确相对分子质量和离子碎片信息(表1)。根据[M-H]-准分子离子峰计算出元素组成,结合保留时间及裂解碎片信息,与文献报道[1021]的化学成分及对照品进行分析比对,初步推断中国沙棘和西藏沙棘叶中成分的结构。
32中国沙棘和西藏沙棘叶中化合物的结构解析峰1:二鞣花酰基葡萄糖。质谱给出准分子离子峰m/z 783070 7 [M-H]-,推断其分子式为C34H24O22,以m/z 783070 7作为母离子进行二级质谱分析,所得二级质谱图中有明显的481,437,301,257,229,185 碎片离子信息。481 [M-H-302] -是[M-H]-丢失鞣花酰基(HHDP)形成的碎片离子,301 [M-H-302-180] -是继而丢失1个葡萄糖分子形成的碎片离子,437 [M-H-302-44] -是481丢失1个CO2分子形成的碎片离子,m/z 301失去1个CO2、继而失去1个CO或失去2分子CO2和1分子CO产生与标样鞣花酸相同的特征离子峰(m/z 257,229,185),表明其含有鞣花酰基。
峰2、峰3:二鞣花酰基葡萄糖。 两峰质谱均给出[M-H]-为783的准分子离子峰,对其做二级质谱分析,所得二级质谱图中碎片离子均有明显的481,301,257,229,185,依据此信息并结合文献,认定其同峰1,为二鞣花酰基葡萄糖,三者互为同分异构体。
峰4:没食子酰基鞣花酰基葡萄糖。 质谱准分子离子峰为m/z 633073 1[M-H]-,推断其分子式为C27H22O18,以m/z 633073 1作为母离子进行二级质谱分析,所得谱图中有明显的463,301,257,229,185碎片离子。463[M-H-170]-是母分子离子丢失没食子酸,301[M-H-332] -是母分子离子失去没食子酰基与葡萄糖组成的化合物形成的。m/z 301产生的碎片离子与标样鞣花酸的碎片离子相同。
峰5、峰12:鞣花酰基橡椀酰基葡萄糖。 两峰质谱均给出准分子离子峰m/z 935 [M-H]-,推断其分子式为C41H28O26,以m/z 935作为母离子进行二级质谱分析,得到891,783,633,481,301碎片离子。891[M-H-28]-是其母离子失去1分子CO;碎片783[M-H-152]-是其母离子失去1分子没食子酰基形成,相继丢失2分子没食子酰基分别形成碎片离子633和481,相当于其母分子离子丢失橡椀酰基;481丢失1分子葡萄糖得到碎片离子301;m/z 301产生与标样鞣花酸相同的碎片离子,表明其含有鞣花酰基。依据此信息并结合文献,峰5、峰12被认定为鞣花酰基橡椀酰基葡萄糖。
峰6:槲皮素7O鼠李糖苷。 质谱给出准分子离子峰m/z 447149 3[M-H]-,推断其分子式为C21H20O11,以m/z 447149 3作为母离子进行二级质谱分析,碎片301[M-H-146]-是母离子丢失1分子鼠李糖形成,m/z 301产生与标样槲皮素相同的特征离子峰271,179,151,表明母核是槲皮素。
峰7:槲皮素3O槐糖7O鼠李糖苷。质谱给出准分子离子峰m/z 771200 1 [M-H]-,推断其分子式为C33H40O21,以m/z 771200 1作为母离子进行二级质谱分析,所得谱图中有明显的625,447,301碎片离子信息。碎片625[M-H-146]-是母离子丢失1分子鼠李糖,相继丢失2分子葡糖糖,产生碎片离子301[M-H-146-162-162]-,m/z 301产生与标样槲皮素相同的特征离子峰271,179,151,化合物母核是槲皮素。
认定其为异槲皮苷。
峰22:异鼠李素3O槐糖O乙酰葡萄糖7O鼠李糖苷。质谱给出准分子离子峰m/z 991273 6 [M-H]-,推断其分子式为C42H55O27,以m/z 991273 6作为母离子进行二级质谱分析,所得谱图中有明显的845,785,639,461,460,315,313碎片离子。碎片845[M-H-146]-是母离子丢失1分子鼠李糖,785[M-H-146-60]-是母离子失去1分子CH3COOH,639是失去1分子乙酰化葡萄糖,639相继丢失2分子葡萄糖产生碎片离子315。
峰23:异鼠李素3O阿拉伯糖7O鼠李糖苷。其准分子离子峰m/z 593151 5 [M-H]-,推断其分子式为C27H30O15,以m/z 593151 5作为母离子进行二级质谱分析,所得谱图中有明显的461,460,447,315,313碎片离子信息。碎片461[M-H-132]-是母离子丢失1分子阿拉伯糖,447[M-H-146]-是母离子失去1分子鼠李糖,315[M-H-146-132]-产生与标样异鼠李素相同特征离子峰300,271,151,107,母核是异鼠李素。
峰24、峰29、峰30、峰31:山柰酚3O葡萄糖鼠李糖苷。质谱均给出593 [M-H]-的准分子离子峰,可推断其分子式为C27H30O15,以m/z 593作为母离子,对其进行二级质谱分析,所得谱图中有明显的284,285 [M-H-Rha-Glc]-碎片离子信息,是其母分子离子依次失去鼠李糖(146)和葡萄糖分子(162)分子产生的。
峰25:槲皮素7O鼠李糖苷。其准分子离子峰m/z 447055 3[M-H]-,推断其分子式为C21H20O11,和峰7互为同分异构体。以m/z 447055 3作为母离子进行二级质谱分析,碎片300,301[M-H-146]-是母离子丢失1分子鼠李糖形成。
峰26:山柰酚3O葡萄糖苷。质谱给出准分子离子峰m/z 447091 2[M-H]-,推断其分子式为C21H20O11,和峰24是同分异构体。以m/z 447091 2作为母离子进行二级质谱分析,碎片284,285[M-H-162]-是母离子丢失1分子葡萄糖形成。
峰27:异鼠李素3O芸香糖苷。质谱给出准分子离子峰m/z 623161 1[M-H]-,推断其分子式为C28H32O16,以m/z 623161 1作为母离子进行二级质谱分析,所得谱图中有明显的315 [M-H-Rha-Glc]-碎片离子信息,是其母分子离子依次失去鼠李糖(146)和葡萄糖分子(162)分子产生的。
峰28:异鼠李素3O葡萄糖苷。质谱给出准分子离子峰m/z 477102 7[M-H]-,推断其分子式为C22H22O12,以m/z 477102 7作为母离子进行二级质谱分析,碎片314,315[M-H-162]-是母离子丢失1分子葡萄糖形成。
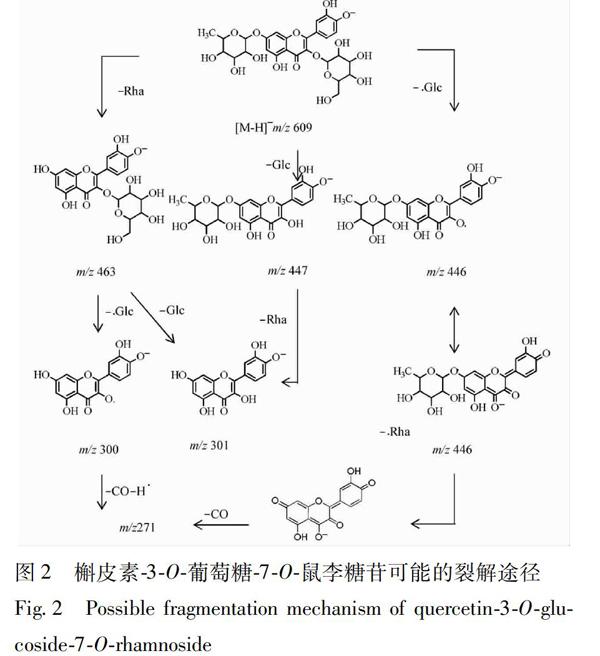
峰32:槲皮素3O芸香糖7O葡萄糖苷。质谱给出准分子离子峰m/z 771200 0 [M-H]-,推断其分子式为C33H40O21,以m/z 771200 0作为母离子进行二级质谱分析,所得谱图中有609,463,301,299碎片离子信息。碎片609 [M-H-162]-是母离子丢失1分子葡萄糖,相继丢失1分子鼠李糖产生463[M-H-162-146]-,丢失1分子葡萄糖产生碎片离子301[M-H-162-146-162]-,m/z 301产生与标样槲皮素相同的特征离子峰271,179,151。
峰33:槲皮素3O葡萄糖鼠李糖7O鼠李糖苷。质谱给出准分子离子峰m/z 755205 4[M-H]-,推断其分子式为C27H30O17,以m/z 755205 4作为母离子进行二级质谱分析,所得谱图中有明显的609,463,446,301,300碎片离子信息。碎片609 [M-H-146]-是母离子丢失1分子鼠李糖,继而失去1分子鼠李糖得到碎片463[M-H-146-146]-、再失去1分子葡萄糖得到碎片301[M-H-146-146-162]-。
峰34:山柰酚3O槐糖O葡萄糖醛酸7O鼠李糖苷。质谱给出准分子离子峰m/z 931254 5[M-H]-,推断其分子式为C39H48O26,以m/z 931254 5作为母离子进行二级质谱分析,所得谱图中有明显的785,609,285,284碎片离子信息。碎片785[M-H-146]-是母离子丢失1分子鼠李糖,继而母离子失去1分子葡萄糖醛酸得到609[M-H-176]-,609相继丢失2分子葡萄糖,即得碎片离子285。
峰35:异鼠李素3O槐糖O葡萄糖醛酸7O鼠李糖苷。质谱给出准分子离子峰961264 2[M-H]-,推断其分子式为C40H50O27,以m/z 961264 2作为母离子进行二级质谱分析,所得谱图中有明显的815,785,461,315碎片离子信息。碎片815[M-H-146]-是母离子丢失1分子鼠李糖;母离子失去1分子葡萄糖醛酸得到785[M-H-176]-,继而相继丢失2分子葡萄糖,即得碎片离子461。
4讨论
41测定方法的选择UPLC/QTOFMS分析具有速度快、灵敏度高、分离度高,可测得化合物精确相对分子质量等特点,适用于中药多组分、复杂成分的分离和定性鉴别[8]。本实验首次运用该技术,对中国沙棘和西藏沙棘叶中成分进行全面、快速的成分分析,为沙棘叶中化学物质基础研究提供了更为快速有效的手段。
42色谱和质谱条件的选择乙腈溶剂黏度较低,洗脱能力大于甲醇,作为有机溶剂,能够使色谱峰快速分离。实验结果表明,以乙腈水作为流动相得到的色谱峰形、分离效果和质谱信号响应最优[8]。因黄酮类化合物分子中的羟基易形成稳定的氧负离子,使用ESI离子源,负离子模式检测所得总离子流图信噪比好,有较低的背景值且负离子模式形成的母离子通常为[M-H]-,比较单一,易于辩识,故选择负离子模式采集数据。
43沙棘叶中黄酮类化合物的质谱裂解规律黄酮类化合物在ESI离子源下的裂解方式主要是产生脱去糖基的碎片离子。中国沙棘和西藏沙棘叶中的黄酮苷类主要含有葡萄糖和鼠李糖,因此主要产生丢失该糖基的[M-H-162]-和[M-H-146]-的碎片离子;对于黄酮母核,主要发生C环的RDA裂解和一些小分子碎片的丢失,如CO,CHO,C3O2,CO2等。
44中国沙棘和西藏沙棘叶中成分分析比较本实验基于UPLCQTOFMS技术对中国沙棘和西藏沙棘叶中成分进行了分离及结构鉴定。根据各个色谱峰在质谱中的精确相对分子质量、质谱碎片结构信息,与文献报道的相关成分作比对,成功鉴定出35个化合物。其中,鞣花酸、芦丁、异槲皮苷、异鼠李素3O葡萄糖苷与对照品对照后进行确认;其他峰则通过二级质谱扫描MS2,根据特征碎片离子峰进行确认。
分析本实验结果,在成分组成上,中国沙棘和西藏沙棘叶中成分大体一致,主要是以槲皮素、山柰酚、异鼠李素为苷元和糖结合形成的黄酮苷类物质。所鉴定的35个化合物中,29个成分为两沙棘叶所共有,而杨梅素3O鼠李葡萄糖苷和异鼠李素3O阿拉伯糖7O鼠李糖苷2成分为中国沙棘独有;余下4个成分槲皮素3O芸香糖7O葡萄糖苷、槲皮素3O葡萄糖鼠李糖7O鼠李糖苷、山柰酚3O槐糖O葡萄糖醛酸7O鼠李糖苷以及异鼠李素3O槐糖O葡萄糖醛酸7O鼠李糖苷为西藏沙棘独有;中国沙棘和西藏沙棘叶中成分在含量上也存在差异。利用Masslynx 41软件经去噪、基线校正、重叠峰解析及峰对齐获得了2种沙棘叶中35种化学成分的相对定量信息,结果表明,对于2沙棘叶的主要成分(例如,14,15,18,28以及30号峰等)而言,中国沙棘约为西藏沙棘含量的15倍,6个特异性成分含量相对主成分而言含量很低。但本实验是对2种沙棘叶单个产地的定性分析,对2沙棘叶中成分做后续研究时,可以化学成分含量变化为研究出发点,收集不同产地和批次的2种沙棘叶,进一步综合研究、分析2沙棘叶中成分特征。
本实验建立的沙棘叶中化学成分快速分析的方法,能够快速、有效地阐明沙棘叶中化学成分,对今后科学开发沙棘资源和扩大沙棘原料来源有重要意义。
[参考文献]
[1]刘勇,廉永善,王颖莉,等. 沙棘的研究开发评述及其重要意义[J]. 中国中药杂志,2014,39(9):1547.
[2]中国药典. 一部[S]. 2015.
[3]Kumar M S Y, Dutta R, Prasad D, et al. Subcritical water extraction of antioxidant compounds from Seabuckthorn (Hippophae rhamnoides) leaves for the comparative evaluation of antioxidant activity[J]. Food Chem, 2011, 127(3):1309.
[4]Wang J, Zhang W, Zhu D, et al. Hypolipidaemic and hypoglycaemic effects of total flavonoids from seed residues of Hippophae rhamnoides L. in mice fed a highfat diet[J]. J Sci Food Agr, 2011, 91(8):1446.
[5]杜蕾蕾,陈雏. 不同沙棘叶中槲皮素、山柰酚和异鼠李素的含量比较[J]. 成都医学院学报, 2015(1):28.
[6]廉永善,陈学林,于倬德,等. 沙棘属植物起源的研究[J]. 沙棘,1997(2):1.
[7]孙冬梅,董玉娟,胥爱丽,等. UPLCQTOFMS法快速筛查银杏磷脂软胶囊中12种黄酮类化合物[J]. 中成药,2015(2):320.
[8]孙冬梅,董玉娟,胥爱丽,等. 葛根枳椇软胶囊中黄酮类化合物的UPLC/QTOFMS快速分析[J]. 中草药, 2015(7):970.
[9]单鸣秋,钱雯,高静,等. UPLCMS分析侧柏叶中黄酮类化合物[J]. 中国中药杂志,2011,36(12):1626.
[10]王克建,杜明,胡小松,等. 核桃仁中多酚类物质的液相/电喷雾质谱分析[J]. 分析化学,2009(6):867.
[11]王克建,郝艳宾,齐建勋,等. 红色核桃仁种皮提取物紫外可见光谱和质谱分析[J]. 光谱学与光谱分析,2009(6):1668.
[12]芮雯,范贤,岑颖洲,等. 千斤拔中黄酮类成分的UPLC/QTOFMS分析[J]. 中成药,2012(3):509.
[13]Ablajan K, Abliz Z, Shang X Y, et al. Structural characterization of flavonol 3, 7diOglycosides and determination of the glycosylation position by using negative ion electrospray ionization tandem mass spectrometry[J]. J Mass Spectrom, 2006, 41(3):352.
[14]Guliyev V B, Gul M, Yildirim A. Hippophae rhamnoides L. :chromatographic methods to determine chemical composition, use in traditional medicine and pharmacological effects[J]. J Chromatogr B, 2004, 812(1):291.
[15]Chen C, Xu X M, Chen Y, et al. Identification, quantification and antioxidant activity of acylatedflavonol glycosides from sea buckthorn (Hippophae rhamnoides ssp. sinensis)[J]. Food Chem, 2013, 141(3):1573.
[16]马欣,孙毓庆. 高效液相色谱紫外电喷雾质谱法分析银杏叶中黄酮醇苷类化合物[J]. 沈阳药科大学学报,2003(4):275.
[17]赵琴琴,张玉峰,范骁辉. 高效液相色谱多级质谱联用法同时鉴定苦参中的两大类活性成分[J]. 中国中药杂志,2011,36(6):762.
[18]张语迟,刘春明,刘志强,等. 罗布麻叶黄酮类成分酶解前后的液相色谱质谱分析及活性比较[J]. 分析测试学报, 2010(10):1073.
[19]赵春艳. 沙葱中黄酮类化合物的分离纯化、结构鉴定及其对小鼠免疫抗氧化机能影响的研究[D]. 呼和浩特:内蒙古农业大学,2008.
[20]曹会凯. 山楂中黄酮类化合物的提取及成分分析[D]. 秦皇岛:河北科技师范学院, 2013.
[21]曹捷. 紫花地丁黄酮苷类成分的定性定量研究[D]. 上海:复旦大学,2013.
[责任编辑丁广治]

