胃间质瘤合并胃癌的临床分析及文献回顾
来集富 许文娜 王元宇 Sung Hoon Noh


[摘要] 目的 总结分析胃间质瘤合并胃癌的患者临床资料、病理特征以及随访资料。 方法 对韩国延世大学外科部1999年7月~2011年8月期间术后病理明确胃间质瘤合并胃癌的8例患者进行回顾性分析。 结果 8例胃间质瘤合并胃癌的患者中,男5例,女3例,中位年龄68.5岁。所有的患者均成功施行胃癌的根治切除,在32.8个月的中位随访期间,有6例患者(75.0%)保持无瘤生存状态,另2例患者(25.0%)出现胃癌远处转移。结论 在本组随访中,合并的胃间质瘤病理均未发现高恶性风险度,且随访期间无间质瘤复发,而胃癌的复发占据主要地位。因此,在这类胃间质瘤合并胃癌患者中,手术切除和后期治疗、随访观察主要依据胃癌来进行。
[关键词] 胃癌;胃间质瘤;随访;复发
[中图分类号] R735.2 [文献标识码] B [文章编号] 1673-9701(2016)09-0086-04
[Abstract] Objective To investigate the surgical outcome in patients who had synchronous occurrence of gastric adenocarcinoma (GC) and gastric stromal tumor(GST). Methods Eight patients with synchronous gastric adenocarcinoma and gastric stromal tumor were identified from our database. Patient characteristics, pathologic features, surgical outcomes were evaluated. Results Eight patients with synchronous GC and gastric GIST were identified from our database, including 5 men and 3 women, whose median age was 68.5 years. All the patients with gastric cancer were undernent radical gastrectomy. At a median follow-up of 32.8 months, 6 patients(75.0%) were alive without evidence of recurrence or distant metastases, whereas 2 (25.0%) had adenocarcinoma distant metastases. Conclusion In our study, there is no high risk grading in synchronous GSTs,and no patients have GST relapse. This indicates that GC may have a predominant influence in relapse. Decisions about surgical extent and further management should likely be made mainly according to GC in the occurrence of synchronous tumors.
[Key words] Gastric adenocarcinoma; Gastric stromal tumor; Follow up; Relapse
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是指以梭形细胞为主、缺乏明确肌性或神经分化特征的难以明确分化方向的间叶源性肿瘤,主要发生于胃肠道、肠系膜和腹膜[1]。其免疫学表现主要为CD117(80%~100%)和CD34(56%~83%)阳性,c-kit基因突变阳性对格列卫治疗有指导意义[2]。
胃间质瘤(gastric stromal tumor,GST)合并胃癌(gastric cancer,GC)的发生十分罕见,相关报道较少,均为病案报道[3-8]。目前,尚不明了这两种不同的病灶是偶然发生的还是基于某种原因而同时形成,也无从得知这类患者在接受手术治疗后,两种不同肿瘤的复发风险究竟哪个更高。本文将对8例胃间质瘤合并胃癌的患者进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选择1999年7月~2011年8月期间于韩国延世大学外科部接受手术治疗的胃间质瘤患者共130例,其中合并胃癌8例;对这8例患者的临床资料、病理特征及随访资料进行回顾分析。
1.2 研究方法
所有的患者均成功施行根治性的部分或者远端胃癌根治术联合D2淋巴结清扫,其中进展期胃癌均予以化疗,所有的胃间质瘤均未给予伊马替尼治疗。胃癌分期根据 AJCC (2001)版,胃间质瘤危险度分级则按照NIH标准,分成极低危、低危、中危和高危[9]。标本常规在4%的甲醛溶液中固定并石蜡包埋,通过苏木精-伊红染色对胃癌病灶常规病检,而对胃间质瘤病灶采用免疫组化方法对CD117单克隆抗体测定(1:50,Dako,Copenhagen,Denmark)以及CD34单克隆抗体测定(1:50,Dako,Copenhagen,Denmark),同时进行突变分析。
1.3 观察指标
胃癌病灶和胃间质瘤病灶的病理特征,包含外观大小、病灶分布情况和各自的分期、分级情况及胃间质瘤的免疫组化结果、突变分析结果;随访期间,胃癌和胃间质瘤病灶的复发情况。
1.4 统计方法
应用SPSS13.0统计学软件进行分析,两组数值变量资料采用Mann-Whitney U test,显著性检验水平为 0.05。
2 结果
2.1 病史资料
8例胃间质瘤合并胃癌患者中,男5例,女3例,中位年龄68.5岁(60~77岁)。其中病例2、3、8分别因消化不良、吞咽困难和呕血就诊,其余5例患者则因恶心感以及腹部不适感等模糊症状就诊。术前内镜检查中5例同时发现并活检证实胃癌、胃间质瘤双病灶,其余3例仅仅发现并活检证实胃癌存在,胃间质瘤病灶为术后病理发现。
2.2 病理资料
2.2.1 病理特征 见表2。8例患者中无一例是相邻的病灶。大体观检查显示在胃癌病灶中,进展期胃癌包括Borrman Ⅲ型25.0%(2/8)、Borrman Ⅱ型37.5%(3/8)以及早期胃癌37.5%(3/8)。胃间质瘤的大体观检查均未在病理报告中提及。胃癌以及胃间质瘤病灶的最大直径分别是 4.5(范围1.0~18.2) cm和2.5(范围2.0~4.8) cm,两者之间并无显著性差异(P=0.163,Mann-Whitney U=16.000,Z=-1.396)。胃癌病灶分布在胃体上1/3、中1/3和下1/3比例分别是37.5%(3/8)、12.5%(1/8)和50.0%(4/8);而胃间质瘤的分布分别是37.5%(3/8)、25.0%(2/8)和37.5%(3/8)。
组织学检查显示胃癌病灶中高分化腺癌占25%(2/8),中分化腺癌占12.5%(1/8),低分化腺癌占50.0%(4/8)以及不明确12.5%(1/8)。胃癌病灶有50%(4/8)肿瘤侵犯浆膜层,12.5%(1/8)侵出浆膜层累及横结肠,剩余37.5%(3/8)为早期胃癌;其中有25.0%(2/8)患者发现淋巴结转移情况。因此胃癌患者的TNM分期构成为Ⅲb期(25.0%,2/8)、Ⅱ期(37.5%,3/8)以及Ⅰ期 (37.5%,3/8)。胃间质瘤有丝分裂指数显示87.5%患者(7/8)核分裂象小于5/50HPF;只有12.5%患者(1/8)有相对较高的核分裂象,因此结合肿瘤大小以及有丝分裂指数,胃间质瘤的危险分级构成为极低危(12.5%,1/8)、低危(75.0%,6/8)和中危(12.5%,1/8)。
2.2.2 免疫组化特征 见表3。CD117阳性检出率为100%(8/8),而CD34阳性检出率为87.5%(7/8)。8例患者中有6例进行了突变分析,KIT 外显子11突变检出率为50.0%(4/8),KIT 外显子9和PDGFRA 外显子18 突变检出率均为12.5%(1/8)。
2.3 随访资料
见表1。通过32.8个月(范围0.4~95.2 个月)的中位随访时间观察后,6例患者保持无瘤生存状态,而其中病例1和病例5出现了胃癌的远处转移。病例1在随访32.9个月时发现腹膜转移和肝脏转移,并在施行减瘤手术6个月后死亡;病例5在随访32.7个月后发现脑膜转移,补救化疗后保持带瘤生存状态至今。所有的胃间质瘤术后随访无复发情况。
3 讨论
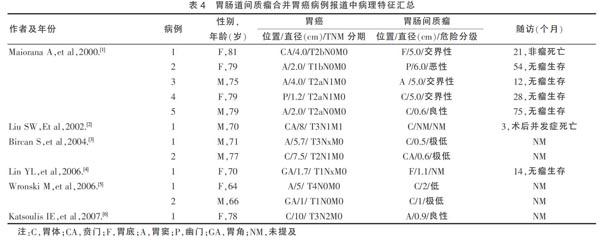
胃间质瘤合并胃癌非常罕见,发病率仅为0.53%[10],国际上多见有胃肠道间质瘤合并胃癌的病例报道[3-8],见表4。虽然国内也可见类似报道,但因未提供具体病例中的病理特征信息而未被纳入[11,12]。
其确切的病因不明,关于成因有着多种假说。从临床上看,胃间质瘤合并胃癌存在很多偶然性,但有些研究表明这种情况的发生可能与某些共同的致癌因素相关[13,14]。但是因为缺乏足够的证据,这个假说尚未被证实。Maiorana等[3]认为基因突变可能导致邻近的两种组织产生交互作用,间皮细胞和上皮细胞生长调控紊乱从而导致在同一器官上两种组织类型不同的肿瘤的发生。这一假说也得到其他学者赞同[8,15]。
胃间质瘤合并胃癌时胃间质瘤的诊断比较困难,可能原因:①胃间质瘤合并胃癌发病率低;②胃间质瘤瘤体较小,多为浆膜下、黏膜下或胃壁内的结节;③临床症状不典型,多被胃腺癌临床表现掩盖。术前常规内镜检查,彩超、CT等影像学检查,同时发现胃腺癌和胃间质瘤的情况相当少见,多于术中探查时发现。本文数据显示只有62.5%的患者能通过内镜发现两种不同类型的原发肿瘤,另外37.5%患者在内镜下只发现了胃癌病灶。提示医生通过仔细检查标本可能术中或术后发现在胃癌病灶以外的部位有另一种原发肿瘤。尽管胃癌合并胃间质瘤的发生率非常低,但是对于胃癌病灶以外的部位仍应该非常仔细的术前内镜检查和术中肉眼观察,因为合并肿瘤的存在极有可能影响手术切除范围。
胃肠道间质瘤合并胃癌的报道中,22例实施外科手术治疗的患者,其术后5年生存率为31.8%。平均存活时间仅为36个月。对于这些患者,应主要针对胃癌进行治疗。并且可通过对合并胃癌的预后评估预测疗效[9]。也有学者认为胃间质瘤患者无论危险分级如何,如果合并胃癌,则预后较差。因此,生存时间主要取决于合并胃癌的远期疗效[16]。本文数据中所有的复发都为胃癌复发,而胃间质瘤无一例复发,证实在胃间质瘤合并胃癌术后,主要复发危险来自于胃癌。而合并胃间质瘤的危险度分级也显示胃间质瘤病灶12.5%为极低危,75%为低危,12.5%为中危,与胃肠间质瘤合并胃癌的报道中患者GIST病灶病理特征相符[17-20]。提示合并胃间质瘤如果手术能完整切除,复发概率极低,无需行伊马替尼治疗。因此,尽管两个不同类型的病灶部位相距较远,仍应努力术前完善诊断,术中确定合适的切除范围,将两种肿瘤完整切除。
本文的研究存在一定的局限性,主要是发病率较低,病例数少。同时因为不完整的病历资料,无法获得胃间质瘤的大体观,使我们无法分析术前内镜漏诊3例胃间质瘤的原因。
在本文研究中,胃间质瘤病理均未发现高恶性风险度,随访期间无间质瘤复发,而胃癌的复发占据主要地位。因此,在这类胃间质瘤合并胃癌患者中,手术切除和后期治疗、随访观察应主要依据胃癌来进行。
[参考文献]
[1] Connolly EM,Gaffney E,Reynolds JV. Gastrointestinal stromal tumours[J]. Br J Surg,2003,90(10):1178-1186.
[2] Willmore-Payne C1,Layfield LJ,Holden JA. c-KIT mutation analysis for diagnosis of gastrointestinal stromal tumors in fine needle aspiration specimens[J]. Cancer,2005, 105(3):165-170.
[3] Maiorana A,Fante R,Maria Cesinaro A,et al. Synchronous occurrence of epithelial and stromal tumors in the stomach:A report of 6 cases[J]. Arch Pathol Lab Med,2000, 124(5):682-686.
[4] Liu SW,Chen GH,Hsieh PP. Collision tumor of the stomach:A case report of mixed gastrointestinal stromal tumor and adenocarcinoma[J]. J Clin Gastroenterol,2002,35(4):332-334.
[5] Bircan S,Candir O,Aydin S,et al. Synchronous primary adenocarcinoma and gastrointestinal stromal tumor in the stomach:A report of two cases[J]. Turk J Gastroenterol,2004,15(3):187-191.
[6] Lin YL,Tzeng JE,Wei CK,et al. Small gastrointestinal stromal tumor concomitant with early gastric cancer:A case report[J]. World J Gastroenterol,2006,12(5):815-817.
[7] Wronski M,Ziarkiewicz-Wroblewska B,Gornicka B,et al. Synchronous occurrence of gastrointestinal stromal tumors and other primary gastrointestinal neoplasms[J]. World J Gastroenterol,2006,12(33):5360-5362.
[8] Katsoulis IE,Bossi M,Richman PI,et al. Collision of adenocarcinoma and gastrointestinal stromal tumour(GIST) in the stomach:Report of a case[J]. Int Semin Surg Oncol,2007,4:2.
[9] Fletcher CD,Berman JJ,Corless C,et al. Diagnosis of gastrointestinal stromal tumors:A consensus approach[J]. Hum Pathol,2002,33(5):459-465.
[10] Liu YJ,Yang Z,Hao LS,et al. Synchronous incidental gastrointestinal stromal and epithelial malignant tumors[J]. World J Gastroenterol,2009,15(16):2027-2031.
[11] 杨君,舒敬德,方庆丰. 7例胃癌合并胃间质瘤临床分析[J]. 中国中西医结合外科杂志,2014,2(5):546-547.
[12] 卜君,钱昆,李小军,等. 胃间质瘤伴胃癌10例的临床分析[J]. 中华普通外科杂志,2007,22(3):226.
[13] Sugimura T,Fujimura S,Baba T. Tumor production in the glandular stomach and alimentary tract of the rat by N-methyl-N'-nitro-N-nitrosoguanidine[J]. Cancer Res,1970,30(2):455-465.
[14] Cohen A,Geller SA,Horowitz I,et al. Experimental models for gastric leiomyosarcoma. The effects of N-methyl-N'-nitro-N-nitrosoguanidine in combination with stress, aspirin, or sodium taurocholate[J]. Cancer,1984,53(5):1088-1092.
[15] Andea AA,Lucas C,Cheng JD,et al. Synchronous occurrence of epithelial and stromal tumors in the stomach[J]. Arch Pathol Lab Med,2001,125:318-319.
[16] Lee FY,Jan YJ,Wang J,et al. Synchronous gastric gastrointestinal stromal tumor and signet-ring cell adenocarcinoma:A case report[J]. Int J Surg Pathol,2007,15(4):397-400.
[17] 叶颖江,高志冬,王杉. 胃肠间质瘤同时合并胃肠癌的诊断与治疗[J]. 中国实用外科杂志,2010,30(4):272-275.
[18] 童锋,应佑华,赵伟. 23例胃肠道间质瘤诊治分析[J]. 中国医师进修杂志,2010,33(36):48-49.
[19] 刘斌,韩勇,龙闻. 24例胃癌合并胃肠间质瘤临床分析[J].中国医师进修杂志,2013,23:63-64.
[20] 刘秀丽,王家镔,黄昌明,等. 胃肠间质瘤合并胃癌患者的临床病理特点及预后影响因素[J]. 中华胃肠外科杂志,2012,15(3):247-250.
(收稿日期:2015-12-18)

