谷氨酸棒状杆菌新型诱导启动子的研究
范 荣,刘金雷,韩武洋,许湄雪,陆 浩,仪 宏,李天明
(河北科技大学 生物科学与工程学院,河北 石家庄 050018)
谷氨酸棒状杆菌新型诱导启动子的研究
范 荣,刘金雷,韩武洋,许湄雪,陆 浩,仪 宏,李天明*
(河北科技大学 生物科学与工程学院,河北 石家庄 050018)
以丰富和完善谷氨酸棒状杆菌的表达元件、筛选适合工业化应用的新型诱导启动子为研究目标,借助绿色荧光蛋白GFP为报告基因,构建启动子筛选工具质粒,在谷氨酸棒杆菌中表达,筛选出三种高效表达的诱导启动子.通过检测绿色荧光蛋白表达强度可知:丙酸启动子诱导表达强度最大,葡萄糖酸启动子次之,蔗糖启动子较弱;丙酸启动子最适诱导浓度为60 ug/mL、葡萄糖酸启动子2 mg/mL、蔗糖启动子2 mg/mL,表达强度比无诱导对照组分别增加4.39、3.86、2.74倍.
谷氨酸棒状杆菌;丙酸诱导启动子;葡萄糖酸诱导启动子;蔗糖诱导启动子
谷氨酸棒状杆菌是具有重大商业价值的食品安全级微生物,主要被用于生产氨基酸[1-2]、维生素[3]、有机酸[4-5]、高级醇[6-7]和多聚物[8].另外,谷氨酸棒状杆菌具有培养条件简单、生长速度快、较强的蛋白分泌能力[9]、无胞外水解活性[10]、非致病性以及完备的生产技术等优点,其作为异源蛋白的表达宿主有潜在的巨大优势,工业应用研究越来越受到重视.谷氨酸棒状杆菌全基因组测序结果的公布[11-12]极大地促进了其表达系统的研究和改造进程[13].Park等[14]报道了利用谷氨酸棒状杆菌热诱导启动子成功表达绿色荧光蛋白.Okibe等[15]报道了麦芽糖诱导启动子成功表达β-半乳糖苷酶报告基因;Plassmeier等[16]报道了利用丙酸诱导表达系统定向改变代谢流使三种目标氨基酸的浓度增加了2.5倍.LacI表达系统是最常用的诱导表达系统,在诱导剂IPTG的作用下,谷氨酸棒状杆菌中也能高效表达LacI系统.但是IPTG价格高昂,不能被细胞降解,易导致发酵产品纯化困难.上述缺点严格限制了其在发酵工业中的应用.诱导剂价格低廉、适合工业应用的谷氨酸棒状杆菌诱导表达系统的研究有待拓展和深入.
本文从解决上述关键技术问题出发,以绿色荧光蛋白为报告基因,构建了启动子筛选工具质粒,筛选出了3个高效的诱导启动子.研究成果丰富和完善了革兰氏阳性菌的表达元件库,为革兰氏阳性菌诱导表达系统的相关研究提供了理论指导,也为发展谷氨酸棒状杆菌高效的工业化表达系统奠定了基础.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究所用菌株、质粒如表1所示.
1.1.2 主要试剂
DNA聚合酶购自北京全式金生物技术有限公司;限制性内切酶购自NEB公司;T4 DNA连接酶、DNA分子量标准购自大连宝生物工程公司(TARAKA);DNA回收试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司;PCR引物由上海英俊生物技术有限公司合成;其他试剂均为分析纯产品,购自生工生物(上海)股份有限公司.

表1 实验所用的菌株及质粒Tab.1 Strains and plasmids used in this study
1.1.3 培养基
LB培养基组分浓度(W/V):1%胰蛋白胨,0.5%酵母提取物,1%NaCl;谷氨酸棒杆菌LBG培养基为添加了1%glucose的LB培养基.需要时加入氯霉素至终浓度10 ug/mL,卡那霉素至终浓度30 ug/mL.固体培养基添加2.2%琼脂.胰蛋白胨、酵母提取物为分析纯,购自北京奥博星生物技术有限责任公司;氯化钠为分析纯,购自天津化学试剂三厂;氯霉素、卡那霉素均为分析纯,购自上海生工生物工程有限公司.
1.2 方法
1.2.1 引物设计与启动子的扩增
根据GenBank公布的基因序列,查找启动子P+、Pgp、Psac基因序列,登陆http://www.fruitfly.org/ seq_tools/promoter.html在线软件Berkeley Drosophila Genome Project,输入相应启动子序列,选择原核生物类型,预测其保守序列,根据其保守序列设计扩增引物及其与gfp基因进行Overlapping PCR所需引物,引物序列如表2所示(下划线部分为酶切位点序列),由上海英俊生物技术有限公司合成.
1.2.2 重组载体的构建
分别以C.glutamicum基因组、Bacillus subtilis基因组和gfp-pEASY为模板,按照表2中的引物扩增出P+、Pgp、Psac启动子基因及gfp基因,通过overlapping PCR,获得融合基因片段P+gfp、Pgpgfp、Psacgfp,将基因片段P+gfp、Pgpgfp、Psacgfp和pXMJ19质粒分别用限制性内切酶HindⅢ和BamHI分别酶切,回收后经T4 DNA连接酶于16℃连接,转化至大肠杆菌Trans5a,经菌落PCR和质粒酶切验证,获得正确的重组质粒P+gfp-pXMJ19、Pgpgfp-pXMJ19和Psacgfp-pXMJ19.
1.2.3 C.glutamicum的转化及重组菌株的筛选
将上述三种重组质粒分别转化C.glutamicum ATCC 13032感受态细胞,并转化空质粒pXMJ19作为对照.谷氨酸棒杆菌感受态细胞制备与转化参考文献[17-18].以含10 ug/ml氯霉素抗性的固体LBG培养基筛选转化子,30℃培养48 h长出单菌落.经过菌落PCR验证,分别筛选出含有重组质粒的重组菌C.g-P+gfp-pXMJ19、C.g-Pgpgfp-pXMJ19、C.g-PsacgfppXMJ19.
1.2.4 重组质粒的表达及最佳诱导剂浓度的确定
将重组菌株C.g-P+gfp-pXMJ19以等OD值分别接种于6个三角瓶,30℃180 rpm培养,测定OD600至3.0时,分别加入终浓度分别为0、20、40、60、80、100 g/mL的丙酸进行诱导,每隔6 h取样待测;将重组菌株C.g-Pgpgfp-pXMJ19以等OD值接种于6个三角瓶,30℃180 rpm培养,测定OD600至3.0时,分别加入终浓度为0、0.5、1、1.5、2、2.5 mg/mL葡萄糖酸诱导,每隔6 h取样待测;将重组菌株C.g-Psacgfp-pXMJ19以等OD值接种于6个三角瓶,30℃180 rpm培养,测定OD600至3.0时,分别加入终浓度为0、0.5、1、1.5、2、2.5 mg/mL蔗糖诱导,每隔6 h取样待测.
1.2.5 绿色荧光蛋白GFP检测方法的建立
绿色荧光蛋白GFP在荧光显微镜下观测.取上述待检测发酵液1 mL,在4℃条件下,12000 rpm离心1 min,取上清液300 uL,加入特定96孔板,放在荧光显微镜下依次观察,比较荧光蛋白发光强弱,并拍摄图片.绿色荧光蛋白GFP的表达量通过酶标仪测定,取上清液300 uL,加入特定96孔板,在酶标仪上设置激发波长485 nm,接收波长528 nm,测定荧光蛋白的表达量.
1.2.6 三种启动子诱导表达强度的比较
为了研究三种不同的诱导型启动子强弱,将已获得的含不同启动子的重组菌株和对照样品C.glutamicum分别以等OD值接种于三角瓶中,30℃180 rpm培养,测定OD600至3.0时,分别加入相应最适诱导剂浓度进行诱导,每隔3h取样,离心后取上清液,利用酶标仪定量测定荧光蛋白表达量;选取三种启动子诱导表达GFP蛋白量最大时的样品,通过荧光显微镜观测比较荧光蛋白发光强弱.

表2 实验所用引物Tab.2 Primers in this study
2 结果与分析
2.1 丙酸诱导型启动子P+的研究
2.1.1 重组质粒P+gfp-pXMJ19的构建
以Corynebacterium glutamicum基因组为模版扩增出启动子P+基因,利用Overlaping PCR与gfp基因融合得到P+gfp片段,连接至pXMJ19质粒上,获得重组质粒P+gfp-pXMJ19.重组质粒经HindIII和BamH I双酶切验证(如图1所示),得到大小分别为5300bp和1100bp两条条带,与预期大小一致,证明重组质粒构建成功.
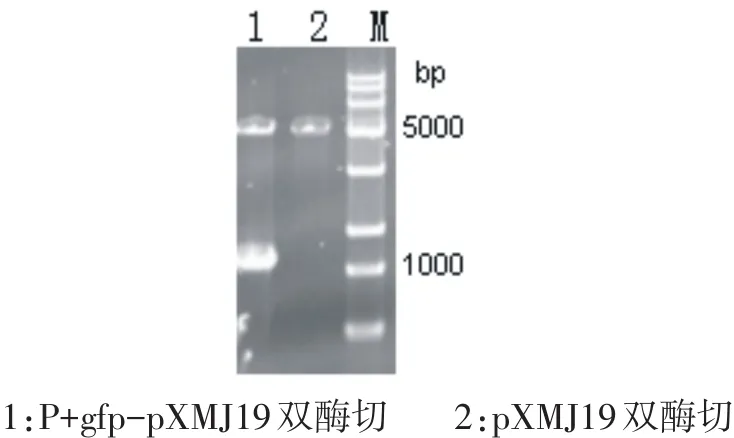
图1 重组质粒酶切验证图Fig.1Proof diagramof recombinant plasmid digestion
2.1.2 重组菌株C.g-P+gfp-pXMJ19最佳诱导剂浓度的确定
将验证正确的重组菌株C.g-P+gfp-pXMJ19摇瓶发酵培养,分别加入终浓度为0、20、40、60、80、100 μg/mL的丙酸进行诱导表达,利用酶标仪测定荧光值,做出变化曲线(如图2所示),不同诱导剂浓度所诱导表达的荧光蛋白GFP含量不同,诱导剂终浓度为60 μg/mL时,GFP的表达量已达到饱和状态,比非诱导条件分别增加4.39倍.表明丙酸诱导启动子P+的最佳诱导浓度为60 ug/ml.
资产证券化是指资金拥有人将一些流动性不强,但可能会有较好现金收益的资产进行资金重组,并将资金的所有权分配给特定的被委托人,从而达到融资的目的。资产证券化可以使缺乏流动性的资产在金融市场上自由流通,增加其流动性。
2.2 葡萄糖酸诱导型启动子Pgp的研究

图2 不同浓度的丙酸诱导下GFP表达情况Fig.2 Expressionof GFP in different concentrations of propionic acid induction
2.2.1 重组质粒Pgpgfp-pXMJ19的构建
以Corynebacterium glutamicum基因组为模版扩增出启动子Pgp基因,利用Overlaping PCR与gfp基因融合得到Pgpgfp片段,连接至pXMJ19质粒上,获得重组质粒Pgpgfp-pXMJ19.重组质粒经HindIII和BamH I双酶切验证,如图3所示得到大小分别为5300bp和900bp两条条带,与预期大小一致,证明重组质粒构建成功.
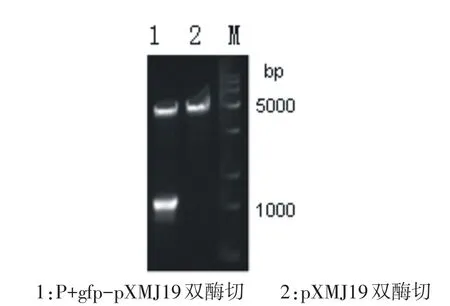
图3 重组质粒Pgpgfp-pXMJ19双酶切验证图Fig.3Proof diagram of Pgpgfp-pXMJ19recombinant plasmiddouble digestion
2.2.2 重组菌株C.g-Pgpgfp-pXMJ19最佳诱导剂浓度的确定
将验证正确的重组菌株C.g-Pgpgfp-pXMJ19摇瓶发酵培养,分别加入终浓度为0、0.5、1、1.5、2、2.5 mg/mL的葡萄糖酸进行诱导表达,利用酶标仪测定荧光值,做出变化曲线(如图4所示),不同诱导剂浓度所诱导表达的荧光蛋白GFP含量不同,诱导剂葡萄糖酸终浓度为2 mg/mL时,GFP的表达量达到饱和状态,比非诱导条件下增加3.86倍.表明葡萄糖酸诱导启动子Pgp的最佳诱导浓度为2 mg/mL.

图4 不同浓度的葡萄糖酸诱导下GFP表达情况Fig.4 Expressionof GFPin different concentrations of glucose acid induction
2.3 蔗糖诱导型启动子Psac的研究
2.3.1 重组质粒Psacgfp-pXMJ19的构建
以Bacillus subtilis基因组为模版扩增出启动子Psac基因,利用Overlaping PCR与gfp基因融合得到Psacgfp片段,连接至pXMJ19质粒上,获得重组质粒Psacgfp-pXMJ19.重组质粒经HindIII和BamH I双酶切验证(如图5所示),得到大小分别为5300bp和1200bp两条条带,与预期大小一致,证明重组质粒构建成功.
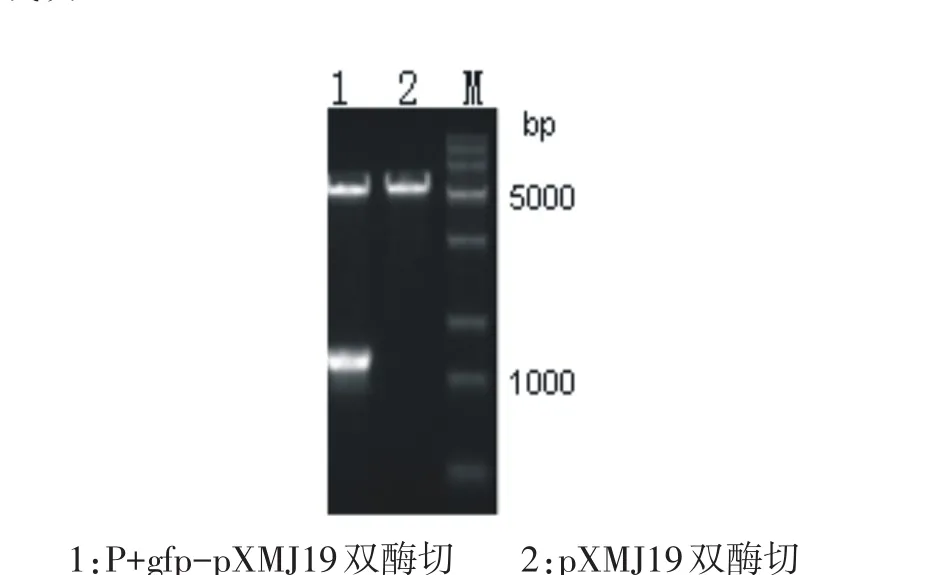
图5 重组质粒Psacgfp-pXMJ19酶切验证图Fig.5Proof diagram of digested plasmid Psacgfp-pXMJ19
2.3.2 重组菌株C.g-Psacgfp-pXMJ19最佳诱导剂浓度的确定
不同蔗糖浓度对启动子Psac的诱导强度不同,为得到最适蔗糖诱导浓度,将验证正确的重组菌株C.g-Psacgfp-pXMJ19摇瓶发酵培养,分别加入终浓度为0、0.5、1、1.5、2、2.5 mg/mL蔗糖进行诱导表达,利用酶标仪测定荧光值,做出变化曲线(如图6所示),不同诱导剂浓度所诱导表达的荧光蛋白GFP含量不同,诱导剂蔗糖终浓度为2 mg/mL时,GFP的表达量已经达到饱和状态,比非诱导条件分别增加2.74倍.表明蔗糖诱导启动子Psac的最佳诱导浓度为2 mg/mL.
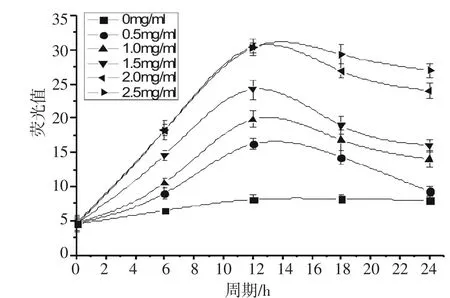
图6 不同浓度的蔗糖诱导下GFP表达情况Fig.6 Expression of GFPin different concentrations of sucrose-induction
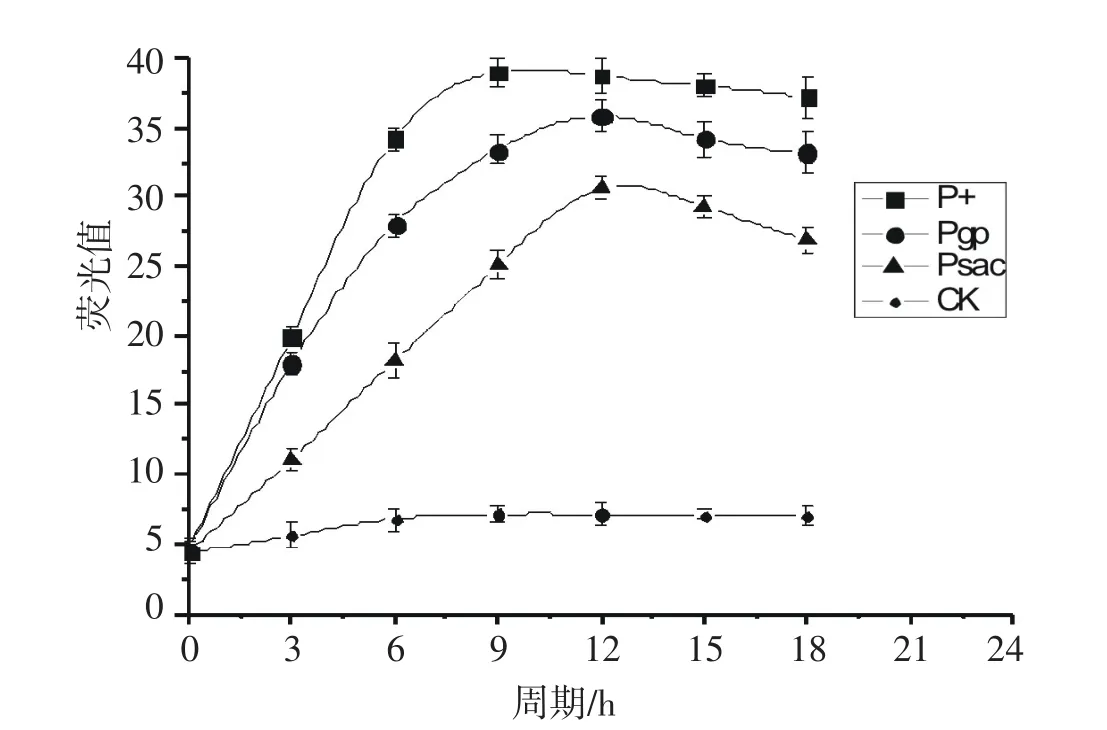
图7 三种诱导启动子GFP表达情况对比Fig.7 Expression contrast ofthree kindsof inducible promoter GFP
2.4 三种启动子表达强度的比较
为了研究三种不同的诱导型启动子强弱,将将三种重组菌株和原始菌株C.glutamicum ATCC 13032分别在最适诱导剂浓度下进行诱导,每隔3h取样离心后取上清液,利用酶标仪定量测定荧光蛋白表达量,如图7所示,丙酸诱导型启动子最强,表达速率最快,表达强度比非诱导状态增加4.39倍;葡萄糖酸诱导型启动子次之,表达强度比非诱导状态增加3.86倍,蔗糖诱导启动子较弱,表达强度比非诱导状态增加2.74倍.选取三种启动子诱导表达GFP蛋白量最大时的样品,通过荧光显微镜观测比较荧光蛋白发光强弱.通过图8可观测到,原始菌株C.glutamicum ATCC 13032无荧光,而三株重组菌株C.g-P+ gfp-pXMJ19、C.g-Pgpgfp-pXMJ19、C.g-Psacgfp-pXMJ19发光亮度依次减弱,这也就证明了丙酸诱导型启动子最强,葡萄糖诱导型启动子次之,而蔗糖诱导型启动子最弱.
3 讨论与结论
葡萄糖酸诱导启动子的基因表达原理目前尚不清楚,但它不属于GPH途径.葡萄糖酸基因可能涉及不同于已知的糖转运系统,葡萄糖酸蛋白的功能有待继续研究.在大肠杆菌中,当穿梭质粒表达的基因产品对细胞有毒害作用时,葡萄糖酸诱导启动子的活性会被葡萄糖抑制,这是葡萄糖酸诱导启动子在大肠杆菌中的一大优势.Okibe等[15]通过葡萄糖酸诱导作用,表达了来源于食纤维梭菌的xynA基因,可以在谷氨酸棒杆菌中顺利表达.通过酶活性测定,其诱导速率增加了4.2倍.本研究利用內源的葡萄糖酸诱导启动子,成功表达了绿色荧光蛋白,当葡萄糖酸的添加浓度达到2 mg/mL时,绿色荧光蛋白表达强度达到稳定状态,荧光强度达到最大35.6,表达强度比非诱导状态下增加3.86倍.

图8 工程菌株C.g-P+gfp-pXMJ19、C.g-Pgpgfp-pXMJ19、C.g-Psacgfp-pXMJ19 GFP表达照片Fig.8 GFP expression Photos ofengineering strain C.g-P+gfp-pXMJ19,C.g-Pgp Gfp-pXMJ19,C.g-Psacgfp-pXMJ19
蔗糖诱导启动子编码基因是枯草芽孢杆菌基因组上受蔗糖诱导调控的基因,编码外分泌的蔗糖果聚糖酶(Levansucrase)[19-20].实验发现,来源于枯草芽孢杆菌的蔗糖诱导启动子表达系统也可以表达绿色荧光蛋白.当蔗糖的诱导浓度达到2 mg/mL时,绿色荧光蛋白表达强度达到稳定状态,荧光强度达到30.3,表达强度比非诱导状态下增加2.74倍.蔗糖诱导启动子的转录强度相对较弱,属于弱诱导性启动子,适用于弱化代谢过程中不能阻断但需要降低通量的代谢途径.
丙酸诱导启动子蛋白表达系统成功表达了绿色荧光蛋白,当丙酸的浓度达到60 μg/mL时,诱导强度达到饱和稳定状态,荧光强度达到38.6,表达强度增加4.39倍.这三种诱导剂的浓度不会产生更高的诱导强度,但是会延长诱导表达的时间.由此证明该系统是非常灵敏的,可以通过控制诱导剂的浓度来调控诱导时间.通过平行试验发现,添加足够的丙酸,诱导表达的稳定性很好,并且与另两种启动子相比较表达强度相比较高,表达速率最快.丙酸作为化工平台产品,价格低廉易得,因此丙酸诱导启动子是适合于大规模工业生产应用的较理想的启动子.
本实验筛选出了适用于谷氨酸棒状杆菌表达系统的诱导启动子,后续将从信号肽、核糖体结合位点等方面进行更深入的研究,建立谷氨酸棒杆菌表达元件库,发展新型谷氨酸棒杆菌表达系统.
[1]Kelle R,Herrmann T,Bathe B.Handbook of Corynebacterium glutamicum[M].Taylor&Francis Group,Boca Raton,FL,2005:465-485.
[2]Kimura E.Handbook of Corynebacterium glutamicum[M]. Taylor&Francis Group,Boca Raton,FL,2005:439-464.
[3]Hänssler E,Müller T,Palumbo K,et al.A game with many players:control of gdh transcription in Corynebacterium glutamicum[J].Journal of Biotechnology,2009,142:114-122.
[4]Litsanov B,Brocker M,Bott M.Toward homosuccinate fermentation:metabolic engineering of Corynebacterium glutamicum for anaerobic production of succinate from glucose and formate[J].Applied and Environment Microbiology,2012,78:3325-3337.
[5]Wieschalka S,Blombach B,Eikmanns B J.Engineering Corynebacterium glutamicum for the production of pyruvate[J].Applied Microbiology and Biotechnology,2012,94:449-459.
[6]Blombach B,Riester T,Wieschalka S,et al.Corynebacterium glutamicum tailored for efficient isobutanol production[J].Applied and Environment Microbiology,2011,77,3300-3310.
[7]Niimi S,Suzuki N,Inui M,et al.Metabolic engineering of 1,2-propanediol pathways in Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology,2011,90:1721-1729.
[8]Song Y,Matsumoto K,Yamada M,et al.Engineered Corynebacterium glutamicum as an endotoxin-free platform strain for lactate-based polyester production[J].Applied Microbiology and Biotechnology,2012,93:1917-1925.
[9]Kikuchi Y,Date M,Itaya H,et al.Functional analysis of the twin-arginine translocation pathway in Corynebacterium glutamicum ATCC 13869[J].Applied and Environmental Microbiology,2006,72:7183-7192.
[10]Date M,Itaya H,Matsui H,et al.Secretion of human epidermal growth factor by Corynebacterium glutamicum[J]. Lett Appl Microbiol,2006,42:66-70.
[11]Ikeda M,Nakagawa S.The Corynebacterium glutamicum genome:features and impacts on biotechnological processes[J].Applied Microbiology and Biotechnology,2003,62:99-109.
[12]Kalinowski J,Bathe B,Bartels D,et al.The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of l-aspartate-derived amino acids and vitamins[J].Journal of Biotechnology,2003,104:5-25.
[13]Ohnishi J,Mitsuhashi S,Hayashi M,et al.A novel methodology employing Corynebacterium glutamicum genome information to generate a new l-lysine-producing mutant[J].Applied Microbiology and Biotechnology,2002,58:217-223.
[14]Park J U,Jo J H,Kim Y J,et al.Construction of heat-inducible expression vector of Corynebacterium glutamicum and C.ammoniagenes:fusion of lambda operator with promoters isolated from C.ammoniagenes[J].Journal of Microbiology and Biotechnology,2008,18:639-647.
[15]Okibe N,Suzuki N,Inui M,et al.Isolation,evaluation and use of two strong,carbon source-inducible promoters from Corynebacterium glutamicum[J].Letters in Applied Microbiology,2010,50:173-180.
[16]Plassmeier J K,Busche T,Molck S,et al.A propionate-inducible expression system based on the Corynebacterium glutamicum prpD2 promoter and PrpR activator and its application for the redirection of amino acid biosynthesis pathways[J].Journal of Biotechnology,2013,163:225-232.
[17]Kröger B,Zelder O,Klopprogge C,et al.PEF-TU expression units[P].US 7785779 B2,2010,1-122.
[18]余秉琦,沈微,诸葛健,等.适用于异源DNA高效整合转化的谷氨酸棒杆菌电转化法[J].中国生物工程杂志,2005,25(2):78-81.
[19]Rebekka Biedendiecka,Martin Gamera,Lothar Jaenschb,et al.A sucrose-inducible promoter system for the intraand extracellular protein production in Bacillus megaterium[J].Journal of Biotechnology,2007,132:426-430.
[20]余小霞,田健,刘晓青,等.枯草芽孢杆菌表达系统及其启动子研究进展[J].生物技术通报,2015,31(2):35-44.
Study of the New Inducible Promoter in Corynebacterium Glutamicum
FAN Rong,LIU Jinlei,HAN Wuyang,XU Meixue,LU Hao,YI Hong,LI Tianming*
(School of Biological Science and Engineering,Hebei University of Science and Technology,Shijiazhuang 050018,China)
To enrich the expression elements of Corynebacterium glutamicumand screen out new available inducible promoters in industrial application,the article usesGreen fluorescent protein(GFP)as report system to construct promoter selecting articles and expresses them in Corynebacterium glutamicum.Three highly expressed inducible promoters are selected.By measuring expression levelof Green fluorescent protein,we demonstrate that propionate promoter is the highest of all in induction intensity,gluconate promoter comes the second,and sucrose promoter is the lowest.The propionate concentration of only 60 ug/mL is found to be sufficient for full induction(increasing 4.39 fold)of its native target.Adding 2mg/mL gluconate and sucrose respectively,the expression intensity reaches its maximal induction,increasing 3.86 fold and 2.74 fold than its native target respectively.
Corynebacterium glutamicum ATCC 13032;propionate inducible promoter;gluconate inducible promoters;sucrose inducible promoter
Q 78
A
1674-4942(2016)02-0154-06
2016-02-27
国家科技支撑计划(2015BAD15B05)
*通讯作者

