CXCL12及其受体CXCR7在非小细胞肺癌中的表达①
赵 洋,朱晓峰,杨成鹏,张浩业,邹志田
(佳木斯大学附属第一医院胸外科,黑龙江佳木斯154003)
CXCL12及其受体CXCR7在非小细胞肺癌中的表达①
赵洋,朱晓峰,杨成鹏,张浩业,邹志田
(佳木斯大学附属第一医院胸外科,黑龙江佳木斯154003)
摘要:目的:探讨趋化因子12(C-X-C chemokine ligand 12,CXCL12/SDF-1)及其特异性受体CXCR7在非小细胞肺癌(NSCLC)中的表达与临床病理特征的关系。方法:运用免疫组化法观察52例NSCLC患者癌组织和癌旁肺组织中CXCL12、CXCR7的表达情况。结果: NSCLC标本中CXCL12/CXCR7的高表达率(67.31%、57.69%)显著高于正常肺组织,CXCL12、CXCR7高表达与淋巴结的转移、TNM分期联系紧密,差异有统计学意义(P<0.05)。CXCL12与CXCR7阳性高表达率具有一致性(r = 0.57,P<0.05)。结论: CXCL12、CXCL7高表达和NSCLC临床分期及其淋巴结转移密切相关,二者表达具有相关性,选择性阻断受体CXCR7的作用对控制非小细胞肺癌发展可能具有一定的价值。
关键词:非小细胞肺癌; CXCL12; CXCL7;淋巴结转移;免疫组化
目前肺癌的发病率和死亡率明显上升,已经成为我国死亡率最高的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)占80%以上,虽然现在提倡个体化方案的整体治疗,但肺癌病人总5年生存率仅仅约20%,而肿瘤的复发和转移依然是导致死亡的主要因素。研究发现[1],趋化因子及其受体在许多生理、病理,胚胎发生、炎症、肿瘤转移的过程中起着重要作用。CXCR7被认定为CXCL12的第二受体,同时肯定CXCR7在CXCL12的调控机制中发挥了至关重要的作用,从而打破了过去认为CXCR4是CXCL12唯一受体的观点,为趋化因子/受体的研究开辟了新的空间。本实验通过观察CXCL12、CXCR7蛋白在NSCLC及癌旁肺组织中的表达情况,探讨CXCL12/CXCR7与NSCLC临床病理特征的关系,从而指导临床实践评估患者预后情况。
1 材料与方法
1.1材料
收集佳木斯大学附属第一医院2013-10~2015-09 NSCLC患者手术切除标本52例,手术前未经放化疗,所有患者中男29例,女23例,年龄42 ~65岁,平均56岁;肺腺癌29例,鳞状上皮细胞癌23例,伴有淋巴结转移的36例,未见转移的16例; 按WHO肺癌TNM标准分级、分期:低分化21例,中分化19例,高分化12例;Ⅰ期16例,Ⅱ期11例,Ⅲ期25例。取癌旁肺组织(距癌周边至少5cm)作为对照组。
1.2方法
1.2.1免疫组织化学染色
采用免疫组织化学染色SP法,所获标本经甲醛溶液固定,进行石蜡包埋后切片,厚度为5μm。常规脱蜡至水,高压抗原修复(CXCL12行柠檬酸盐修复,CXCR7行EDTA修复),加入3%双氧水,血清封闭,室温1h,1: 100兔抗人多克隆抗体,4℃过夜,PBS冲洗,滴加二抗工作液,室温孵育30min,PBS冲洗;滴加DBA工作液,最后苏木素复染2~3min,梯度酒精脱水后置于二甲苯,封片胶封固。
1.2.2染色结果判断
判定标准以细胞质和(或)细胞膜出现黄色或棕黄色颗粒为阳性。阳性细胞数与观察细胞数之比值记为细胞染色阳性率。细胞染色阳性率小于5% 记0分,6%~25%记1分,26%~50%记2分,51% ~75%记3分,大于75%记4分。染色结果:无着色0分,淡黄色1分,棕黄色2分,棕褐色3分。两项结果相乘: 0分为阴性(-),1~2分为弱阳性(+ ),3~6分为中度阳性(),大于6分为强阳性()。(-)和(+ )为低表达,)和()为高表达。
1.3统计学方法
采用软件SPSS17.0对数据结果进行统计分析,运用四格表的χ2和行×列表资料的χ2检验分别对两样本率和多样本率进行比较。P<0.05时,为有显著性差异。
2 结果
2.1 CXCL12、CXCR7在NSCLC和癌旁肺组织中的表达及二者相互关系
免疫组化分析52个NSCLC组织,CXCL12高表达35个,高表达率为67.31% (35/52),染色呈淡黄色和棕黄色主要集中于细胞质(图1)。CXCL12在癌旁肺标本中高表达率仅38.46% (20/52),余正常肺标本均呈低表达(图2),差异具有统计学意义(χ2= 8.68,P<0.01)。
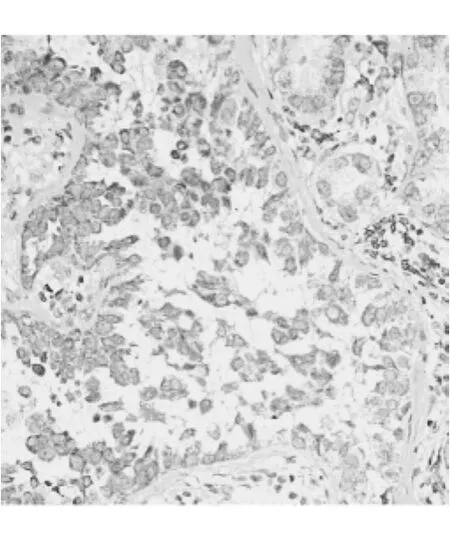
图1 NSCLC组织中CXCL12高表达(×400)

图2 癌旁肺组织中CXCL12低表达(×400)

图3 NSCLC组织中CXCR7高表达(×400)
CXCR7在52个NSCLC标本中皆出现不同程度染色,高表达率是57.69% (30/52),棕黄色和棕褐色染色主要集中在细胞质和细胞膜(图3)。在对照组癌旁肺组织中CXCR7大部分呈低表达(图4),高表达率仅为26.92%(14/52),差异具有统计学意义(χ2= 10.09,P<0.01)。
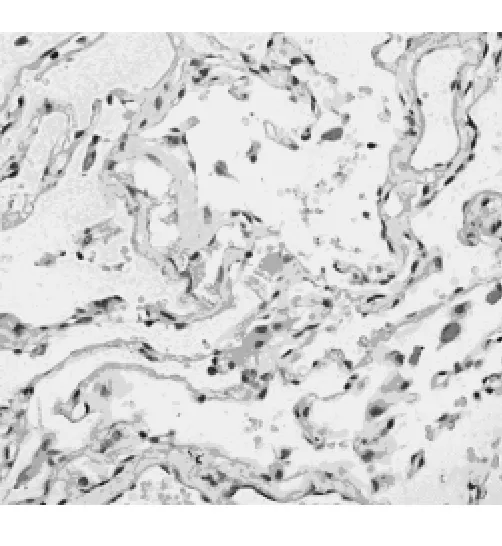
图4 癌旁肺组织中CXCR7低表达(×400)
NSCLC组织中CXCL12与CXCR7高表达呈现一致性(r = 0.57,P<0.05 )。见表1。
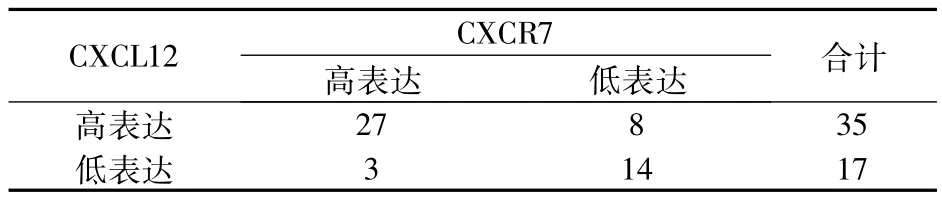
表1 NSCLC组织中CXCL12与CXCR7高表达的相关性
2.2 CXCL12、CXCR7在NSCLC中的表达情况与临
床病理特征的关系
在NSCLC中CXCL12、CXCR7高表达与淋巴结转移、TNM分期关系密切(P<0.05),随着TNM的分期增高,CXCL12、CXCR7蛋白表达水平也升高,Ⅱ、Ⅲ期明显高于Ⅰ期,差异具有统计学意义(P<0.05)。CXCL12、CXCR7高表达率和NSCLC病人的性别、年龄大小、组织学分型、分化程度等无关(P>0.05),见表2。

表2 CXCL12、CXCR7的蛋白表达与NSCLC临床病理特征的关系
3 讨论
趋化因子是具有趋化作用的一类小分子多肽,能趋化免疫细胞定向移动参与机体的调节反应。趋化因子与其受体特异性结合,在肿瘤的转移中发挥重要作用,与肝癌、乳腺癌、鼻内翻性乳头状瘤、胰腺癌等密切相关[2,3]。最新研究[4]发现一种新的受体CXCR7,打破了过去认为CXCR4是CXCL12唯一受体的观点。CXCR7是RDC1编码七次跨膜受体,也可与CXCL12相结合,在正常细胞不表达或仅微弱表达,但是在肿瘤细胞表面的表达明显上调,提示CXCR7高表达与肿瘤细胞的迁移、血管的新生密切相关。
Yamada K等[5]实验结果发现在肿瘤细胞中通过ERK1/2的磷酸化反应使CXCR7的表达水平明显上升,从而促进肿瘤的血管生成,同时ELISA实验表明在正常细胞中CXCR7受体未见明显表达。Monnier J等[6]实验研究表明多种类型的肿瘤组织如肺癌、肾癌、前列腺癌、食管癌、子宫颈癌等与正常组织相比较,CXCR7的表达显著上调。本组实验应用免疫组织化学染色法,结果统计显示,在NSCLC标本中CXCR7、CXCL12的高表达率是57.69%、67.31%,均高于正常肺组织(26.92%、38.46%),且两者成正相关,差异具有统计学意义(P<0.05 ),表明CXCR7、CXCL12高表达和NSCLC的发生及进展关系紧密。
乳腺癌的研究发现[7],CXCR7、CXCL12的高表达率在有淋巴结转移的样本中明显增高,表明CXCR7、CXCL12是促进乳腺癌患者淋巴结转移的关键因素。本组实验显示,CXCR7、CXCL12蛋白在淋巴结转移患者中的高表达率是69.44%、77.78%,在无淋巴结转移患者是31.25%、43.75%,差异具有统计学意义(P<0.05),CXCR7、CXCL12高表达和患者年龄、性别、组织学分型、分化程度无关,和淋巴结转移有关。本组实验还发现CXCR7、CXCL12高表达率也和非小细胞肺癌的临床分期关系紧密,随着TNM的分期增高,CXCR7、CXCL12蛋白表达水平也升高,Ⅱ、Ⅲ期明显高于Ⅰ期,差异具有统计学意义(P<0.05)。其作用机制可能是CXCR7与CXCL12结合形成异源二聚体,从而促进CXCL12介导的、依赖β-抑制蛋白-2通路的下游信号转导,包括P38MAPK、EPK1/2、SAPK路径,调控刺激肿瘤细胞增殖与转移[8]。Yu Y等[9]应用siRNA干扰技术来抑制卵巢癌中CXCR7蛋白表达,肿瘤细胞中CXCR7表达明显减少,肿瘤生长明显减缓,进一步表明CXCL12/CXCR7在癌细胞黏附及迁移中起到关键作用。
本实验结果提示CXCL12/CXCR7高表达可能与NSCLC的恶性行为密切相关,在Wang L等[10]研究中发现,CXCR7阳性患者与阴性患者比较,5年生存率明显降低,CXCR7高表达预示生存时间缩短,提示CXCR7作为独立的预后因素,有望成为评估NSCLC进展及预后的重要指标。同时针对CXCL12/CXCR7生物靶点的干扰治疗将为肿瘤的治疗开辟新途径。
参考文献:
[1]Maksym R B,Tarnowski M,Grymula K,et al.The role of stromalderived factor-1–CXCR7 axis in development and cancer[J].European Journal of Pharmacology,2009,625,31-40
[2]Raman D,Baugher PJ,Yee MT,et al.Role of chemokines in tumor growth[J].Cancer Lett,2007,256(2) : 137
[3]任凤伟,范宗宪.CXCL12及CXCR7在鼻内翻性乳头状瘤中的表达及意义[J].黑龙江医药科学,2015,38(2) : 44-46
[4]Xue T C,Chen R X,Han D,et al.Down-regulation of CXCR7 inhibits the groeth and lung metastasis of human hepatocellular carcinoma cells with highly metastatic potential[J].Exp Ther Med,2012,3 (1) : 117-123
[5]Yamada K,Maishi N,Akiyama K,et al.CXCL12-CXCR7 axis is important for tumor endothelial cell angiogenic property[J].International journal of cancer,2015,137 (12) : 2825-2836
[6]Monnier J,Boissan M,L Helgouale A,et al.CXCR7 is upregulated in human and murune hepatocellular carcinoma and is specifically expressed by endothelial cells[J].European Journal of Cancer,2012,48(1) : 138-148
[7]赵凤辉,王金穗,刘凤磊,等.CXCR7/CXCL12与乳腺癌淋巴结转移的关系[J].实用癌症杂志,2012,3,27(2) : 126-128
[8]Decaillot FM,Kazmi MA,Lin Y,et al.CXCR7/CXCR4 heterodimer constitutively recruits β-arrestin to enhance cell migration[J].Journal of Biological Chemistry,2011,286(37) : 32188-32197
[9]Yu Y,Li H,Xue B,et al.SDF-1/CXCR7 axis enhances ovarian cancer cell invasion by MMP-9 expression through p38 MAPK pathway[J].DNA and cell biology,2014,33(8) : 543-549
[10]Wang L,Chen W,Gao L,et al.High expression of CXCR4,CXCR7 and SDF-1 predicts poor survival in renal cell carcinoma[J].World Journal of Surgical Oncology,2012,10: 212
(收稿日期:2015-11-30)
通讯作者:邹志田(1962~)男,黑龙江佳木斯人,博士,主任医师,硕士研究生导师。E-mail: zxf700105@ sina.com。
作者简介:赵洋(1990~)男,山东威海人,在读硕士研究生。
基金项目:①佳木斯大学研究生科技创新项目,编号: LM2015_040。
中图分类号:R734.2
文献标识码:A
文章编号:1008-0104(2016) 02-0044-03

