高糖环境对胃癌组织、胃癌SGC7901细胞株P-糖蛋白表达及5-Fu敏感性的影响
张全武,刘芮菡,娄欣
(郑州大学附属郑州中心医院,郑州450007)
高糖环境对胃癌组织、胃癌SGC7901细胞株P-糖蛋白表达及5-Fu敏感性的影响
张全武,刘芮菡,娄欣
(郑州大学附属郑州中心医院,郑州450007)
目的 探讨高糖环境对胃癌组织、胃癌SGC7901细胞株P-糖蛋白(P-gp)表达及5-氟尿嘧啶(5-Fu)敏感性的影响。方法 选择胃癌患者40例、2型糖尿病合并胃癌患者30例,取手术切除的胃癌组织标本,采用免疫组化法观察胃癌组织中P-gp表达情况;取人胃癌SGC7901细胞株,体外培养,并给予1 000、4 500、9 000 mg/L葡萄糖干预(分别设为低、中、高浓度组)。收集各组细胞的总蛋白,Western blotting法检测各组细胞中P-gp表达;MTT法检测各组细胞对5-Fu的敏感性。结果 40例胃癌组织中P-gp的平均光密度值为0.014 6,30例2型糖尿病合并胃癌组织中P-gp的平均光密度值为0.021 5,二者比较P<0.01。高浓度组P-gp的相对表达量为2.92±0.09,中浓度组为2.53±0.09,低浓度组为1.56±0.09,组间两两比较P均<0.01。随着葡萄糖浓度的升高,5-Fu对胃癌SGC7901细胞的增殖抑制率逐渐下降,尤其以高浓度组效果最明显(P<0.01)。结论 高糖环境可提高胃癌组织及胃癌SGC7901细胞株P-gp表达,从而降低胃癌细胞对5-Fu的敏感性。
胃癌;高糖环境;P-糖蛋白;5-氟尿嘧啶
化疗是晚期胃癌的主要治疗手段,多药耐药(MDR)是导致化疗失败的主要原因。胃癌的化疗耐药以MDR为主,P-糖蛋白(P-gp)介导的耐药途径是其经典的耐药途径[1,2]。P-gp是MDR的基因产物,可作为药泵将化疗药物排出癌细胞,继而产生化疗耐药[3,4]。临床研究发现,合并2型糖尿病的胃癌患者化疗效果较差[5]。因此推测,高血糖可能影响化疗药物的敏感性。本研究观察高糖环境对胃癌
组织、胃癌SGC7901细胞株P-gp表达及5-氟尿嘧啶(5-Fu)敏感性的影响,旨在探究2型糖尿病合并胃癌化疗效果较差的原因。
1 材料与方法
1.1 材料 选择2004年1月~2008年12月在郑州大学附属郑州中心医院行手术治疗的胃癌患者70例,均经术后组织病理检查明确诊断。患者随访至2010年10月,临床及病理资料完整。其中单纯胃癌患者40例,男27例、女13例,平均年龄59岁;2型糖尿病合并胃癌患者30例,男19例、女11例,平均年龄57岁。糖尿病诊断采用1999年WHO制定的糖尿病诊断标准,即空腹血糖≥7.0 mmol/L和(或)餐后2 h血糖≥11.1 mmol/L;2型糖尿病合并胃癌:确诊2型糖尿病半年以上发现胃癌,糖尿病病程0.5~4年。排除标准:①合并其他器官恶性肿瘤者;②术前进行放化疗者;③合并垂体、甲状腺、肾上腺等其他内分泌器官功能失调者;④合并严重心、脑、肾等重要器官功能障碍者。
1.2 胃癌组织P-gp表达检测 取40例单纯胃癌患者、30例2型糖尿病合并胃癌患者手术切除的胃癌组织标本,中性甲醛固定,石蜡包埋,4 μm厚切片;采用罗氏GX全自动免疫组化染色机自动染色,P-gp鼠抗人单克隆抗体工作浓度为1∶100,PBS代替一抗作为阴性对照。P-gp阳性染色主要定位于细胞膜,呈棕黄色颗粒。所有切片在光镜(400倍)下随机取5个视野,由IPP-6图像分析系统分析每张图片的P-gp阳性细胞的光密度值。
1.3 葡萄糖对胃癌SGC7901细胞P-gp表达及5-Fu敏感性影响的观察
1.3.1 细胞培养及葡萄糖干预 取胃癌SGC7901细胞株,置于37 ℃、5% CO2饱和湿度的细胞培养箱中培养。待细胞生长至整个培养皿的85%~90%时,弃去培养基,无菌PBS洗涤2~3次,0.25%胰酶消化,倒置显微镜下观察到细胞脱壁后,吹打成细胞悬液,1 000 r/min离心5 min,弃去上清液。收集细胞,并置于3个培养皿中,分别给予1 000 g/L葡萄糖,使葡萄糖终浓度为1 000、4 500、9 000 mg/L(分别设为低、中、高浓度组)[2,3],加入完全培养基继续培养24 h。
1.3.2 胃癌细胞P-gp表达检测 采用Western blotting法。收集各组对数生长期细胞,使用蛋白裂解液冰上裂解10 min,12 000 r/min离心15 min,取上清。BCA试剂盒检测蛋白浓度后按照蛋白样品∶5×SDS为4∶1煮沸变性。取30 μg样品上样于SDS-PAGE,电泳至溴酚蓝跑到胶底部。转至PVDF膜,5%脱脂奶粉4 ℃过夜封闭,P-gp(1∶200)及β-actin(1∶1 000)一抗37 ℃摇床孵育2 h,TBST洗膜3×10 min。二抗(1∶5 000)37 ℃摇床孵育2 h,TBST洗膜3×10 min,最后TBS洗膜10 min,ECL发光,UVP图像采集,重复6次,IPP-6图像分析系统分析P-gp阳性细胞光密度值,计算其相对表达量。
1.3.3 胃癌细胞对5-Fu敏感性的影响观察 采用MTT法。收集各组细胞,调整细胞密度至1×105/孔接种于96孔板,置于37 ℃、5% CO2培养箱内培养。培养4 h更换为无血清培养基,饥饿处理20 h。按终浓度为5、10、15、20、25、30、35 μg/mL加入用培养基稀释好的5-Fu。继续培养72 h,加入MTT 20 μL,孵育4 h,弃去培养基,加入DMSO 150 μL,振荡10 min,酶标仪检测490 nm波长处的吸光度(A)值。计算细胞增殖抑制率。细胞增殖抑制率=1-(试验孔A值-空白孔A值)/(对照空A值-空白孔A值)。

2 结果
2.1 单纯胃癌组织及糖尿病合并胃癌组织P-gp表达比较 单纯胃癌组织P-gp的平均光密度值为0.014 6,糖尿病合并胃癌组织P-gp的平均光密度值为0.021 5,二者比较P<0.01。
2.2 不同浓度葡萄糖干预后胃癌细胞P-gp表达比较 高浓度组P-gp的相对表达量为2.92±0.09,中浓度组为2.53±0.09,低浓度组为1.56±0.09。组间两两比较P均<0.01。
2.3 不同浓度葡萄糖干预后胃癌细胞对5-Fu敏感性的影响 随着葡萄糖浓度升高,5-Fu对胃癌细胞的增殖抑制率逐渐降低(P均<0.05)。见表1。
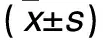
表1 不同浓度5-Fu对葡萄糖干预后胃癌细胞增殖抑制率的影响
注:与同浓度5-Fu下低浓度组比较,*P<0.05。
3 讨论
肿瘤的耐药机制包括药物泵出增多、药物敏感性降低、药物解毒能力增强等[5]。研究发现,P-gp高表达是MDR发生的原因之一,而超过50%的胃癌患者癌组织过表达P-gp[6~8]。P-gp是一种分子量为170 kD的跨膜蛋白,主要存在于细胞膜,是MDR-1基因编码的一种蛋白产物,具有能量依赖性药物排出泵的功能,既可与ATP结合,也可与抗癌药分子结合。P-gp利用ATP水解释放的能量将抗癌药物从细胞内转运到细胞外,使细胞内药物浓度降低,从而导致耐药性的产生。因此,P-gp/MDR-1过度表达是肿瘤产生MDR的分子基础[1],其在正常组织中具有排除异物的作用,而在肿瘤细胞中主要以此排斥化疗药物[9~11]。
近年研究发现,2型糖尿病是胃癌的危险因素之一[3,12]。糖尿病合并胃癌患者存在明显的代谢紊乱状态,胃癌临床分期、淋巴结及远处转移、浸润程度与糖代谢紊乱呈正相关,这类患者化疗效果往往较单纯胃癌患者更差[4]。因此推测,高血糖可能促进胃癌的进展,其机制可能与肿瘤细胞的能量代谢有关,高血糖可促进NAD+依赖的沉默信息调节因子1(Sirt1)蛋白的表达继而促进胃癌的进展[13,14]。本研究结果显示,合并糖尿病的胃癌组织P-gp表达明显高于单纯胃癌组织,经过高糖干预的胃癌SGC7901细胞也观察到同样结果,说明高糖环境可促进胃癌组织P-gp的表达。有研究发现,在胃癌组织中Sirt1、尼克酰胺磷酸核糖转移酶(Nampt)、p53与P-gp表达有一定相关性[12,13]。Bi等[15]研究发现,内源性Nampt能促进胃癌的进展,且与胃癌的化疗耐药密切相关。高糖环境可促进癌细胞中Nampt和Sirt1的表达,继而升高突变型p53的表达,使癌细胞中P-gp的表达升高[13]。Sirt1是能量代谢的中枢蛋白,参与NAD+、NADPH、ADP等能量代谢过程,其高表达能够促进肿瘤细胞代谢增加和ATP含量增加,从而使ATP依赖蛋白P-gp的活性和表达量相应升高[16]。P-gp与抗癌药物结合后再与ATP结合,通过ATP供能,将细胞内药物泵出细胞外,使细胞内药物浓度降低,从而导致化疗耐药;P-gp对天然疏水类抗肿瘤药物有较强的外泵作用,是肿瘤细胞适应、转化、增殖与进展的一种自身保护方式,而这种保护作用的负效应则是肿瘤MDR的重要机制[17]。
本研究还发现,随着葡萄糖浓度的升高,5-Fu对胃癌SGC7901细胞的增殖抑制率呈明显下降趋势,尤其以高浓度组下降最明显;说明高糖环境下胃癌细胞对5-Fu的敏感性下降,产生了化疗耐药。
综上所述,我们认为高糖环境可提高胃癌组织及胃癌SGC7901细胞中P-gp的表达,从而使胃癌细胞对5-Fu的敏感性下降,产生化疗耐药;抑制胃癌组织中P-gp的表达有可能成为高血糖合并胃癌患者的治疗靶点。
[1] Miura JT, Johnston FM, Thomas J, et al. Molecular profiling in gastric cancer: examining potential targets for chemotherapy[J]. J Surg Oncol, 2014,110(3):302-306.
[2] Zhao YY, Yu L, Liu BL, et al. Downregulation of P-gp, Ras and p-ERK1/2 contributes to the arsenic trioxide-induced reduction in drug resistance towards doxorubicin ingastric cancer cell lines[J]. Mol Med Rep, 2015,12(5):7335-7343.
[3] Sekikawa A, Fukui H, Maruo T, et al. Diabetes mellitus increases the risk of early gastric cancer development[J]. Eur J Cancer, 2014,50(12):2065-2071.
[4] 于海燕,张志勇,王凯,等.下调RPL23对胃癌耐药细胞SGC7901/ADR药物敏感性的影响[J].现代肿瘤医学,2015,23(10):1340-1343.
[5] Chowdhury TA. Diabetes and cancer[J]. QJM, 2010,103(12):905-915.
[6] 李世俊,庞华.针对多药耐药肿瘤的潜力性治疗策略——CIK细胞[J].山东医药,2012,52(1):104-106.
[7] Yin Y, Li W, Deng M, et al. Extracellular high mobility group box chromosomal protein 1 promotes drug resistance by increasing the expression of Pglycoprotein expression in gastric adenocarcinoma cells[J]. Mol Med Rep, 2014,9(4):1439-1443.
[8] Chen J, Mao L, Liu S, et al. Effects of a novel porphyrin-based photosensitizer on sensitive and multidrug-resistant human gastric cancer cell lines[J]. J Photochem Photobiol B, 2015(151):186-193.
[9] 孙晓春,朱伟金,吴乐乐,等.COX-2、EGFR和PgP在胃癌组织中的表达及其临床意义[J].江苏医药,2013,39(1):24-26.
[10] Xie X, Tang B, Zhou J, et al. Inhibition of the PI3K/Akt pathway increases the chemosensitivity of gastric cancer to vincristine[J]. Oncol Rep, 2013,30(2):773-782.
[11] Mangia A, Caldarola L, Dell'Endice S, et al. The potential predictive role of nuclear NHERF1 expression in advanced gastric cancer patients treated with epirubicin/oxaliplatin/capecitabine first line chemotherapy[J]. Cancer Biol Ther, 2015,16(8):1140-1147.
[12] Ikeda F, Kiyohara Y. Helicobacter pylori infection and hyperglycemia/diabetes are associated with an increased risk of gastric cance[J]. Gan To Kagaku Ryoho, 2015,42(5):529-533.
[13] Zhao W, Chen R, Zhao M, et al. High glucose promotes gastric cancer chemoresistance in vivoand in vitro[J]. Mol Med Rep, 2015,12(1):843-850.
[14] 耿苗,唐修文.Nrf2/ARE信号通路与胃癌耐药关系的研究进展[J].中国细胞生物学学报,2012,34(11):1129-1133.
[15] Bi TQ, Che XM, Liao XH, et al. Overexpression of Nampt in gastric cancer and chemopotentiating effects of the Nampt inhibitor FK866 in combination with fluorouracil[J]. Oncol Rep, 2011,26(5):1251-1257.
[16] 樊林,陈锐,赵伟,等.Sirt1、p53及P-gp在胃癌中的表达及其临床意义[J].西安交通大学学报(医学版),2013,34(5):642-646.
[17] 周丽荣,潘燕,付汉东.胃癌合并糖尿病患者的代谢情况与胃癌临床特征的相关性[J].现代肿瘤医学,2015,23(11):1572-1574.
Effects of high glucose on expression of p-glycoprotein and 5-Fu sensitivity in gastric cancer tissues and gastric cancer cell line SGC7901
ZHANGQuanwu,LIURuihan,LOUXin
(ZhengzhouCentralHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450007,China)
Objective To investigate the effects of high glucose on the expression of P-glycoprotein (P-gp) and 5-Fu sensitivity in gastric cancer tissues and gastric cancer cell line SGC7901. Methods The expression of P-gp from the gastric cancer tissues in 40 cases of patients with gastric cancer and 30 case of patients with type 2 diabetes mellitus combined with gastric cancer was detected by immunohistochemistry. Human gastric cancer cell line SGC7901 was cultured and intervened by 1 000, 4 500 and 9 000 mg/L glucose (low-dose, medium-dose and high-dose glucose group). The cell total protein of each group was collected, the expression of P-gp protein in each group was detected by Western blotting, and the sensitivity of cells to 5-Fu was detected by MTT assay. Results The average optical density of P-gp in 40 cases of gastric cancer and 30 case of type 2 diabetes mellitus combined with gastric cancer was 0.0146 and 0.021 5 respectively (P<0.01). The expression of P-gp in high-dose, medium-dose and low-dose glucose groups was 2.92±0.09, 2.53±0.09 and 1.56±0.09, respectively. Meanwhile, significant difference was found between every two groups (allP<0.01). MTT results showed that the sensitivity of gastric cancer cells to 5-Fu was decreased as the increased concentrations of glucose, especially in high-dose glucose group (P<0.01). Conclusion High glucose may promote the expression of P-gp protein in gastric cancer and gastric cancer cell line SGC7901, thus reduce the sensitivity of gastric cancer cells to 5-Fu.
gastric carcinoma; high glucose; P-glycoprotein; 5-fluorouracil
河南省科技发展计划(142102310461)。
张全武(1972-),男,副主任医师,研究方向为肿瘤的病理诊断,曾获郑州市科技进步二等奖两项。E-mail: zxyyzqw@163.com
10.3969/j.issn.1002-266X.2016.24.006
R735.2
A
1002-266X(2016)24-0020-03
2015-12-04)

