食管癌淋巴结转移影响因素及不同淋巴结切除术临床疗效研究
赖鸿章
·论著·
食管癌淋巴结转移影响因素及不同淋巴结切除术临床疗效研究
赖鸿章
目的 探讨食管癌淋巴结转移影响因素及不同淋巴结切除术临床疗效研究。方法 选择2010年6月至2012年1月收治的食管癌患者74例作为研究对象,根据不同手术方式分为颈部—右胸—腹部三切口组(n=39)和左胸切口组(n=35),比较2组患者淋巴结清扫数目、淋巴结转移率等相关指标,并对淋巴结转移的危险因素进行多因素Logistic回归分析。结果 三切口组患者淋巴结清扫数目为(21.53±6.07)个,显著高于左胸切口组的(13.04±4.28)个,差异有统计学意义(P<0.05);2组围术期死亡及并发症发生率比较差异无统计学意义(P>0.05);TNM分期、肿瘤分化程度、肿瘤直径、浸润深度对食管癌患者淋巴结转移有显著影响(P<0.05);多因素Logistic回归分析结果显示,TNM分期、肿瘤分化程度、肿瘤直径、浸润深度是淋巴结转移的独立危险因素(P<0.05);三切口组术后生存率为69.23%,高于左胸切口组的42.86%,差异有统计学意义(P<0.05)。结论 TNM分期、肿瘤分化程度、肿瘤直径、浸润深度是食管癌淋巴结转移的重要危险因素,食管癌行颈部—右胸—腹部三切口术式可提高淋巴结清扫数目,改善患者预后,值得临床重视。
食管癌;经颈部—右胸—腹部三切口;淋巴结清扫术;淋巴结转移;影响因素
食管癌是临床中比较常见的一种恶性肿瘤,目前手术是治疗食管癌的主要手段。不过食管癌早期时就容易出现淋巴结转移,从而对患者的预后造成不良影响[1]。因此,在行手术治疗时最大程度提高淋巴结清扫数目,对减少淋巴结转移,改善患者预后具有重要意义。本研究分析了颈部—右胸—腹部三切口术式与左胸切口术式对食管癌患者预后的影响,旨在为临床治疗提供参考依据。报告如下。
1 资料与方法
1.1 一般资料 选择2011年6月至2013年1月我院收治的食管癌患者74例作为研究对象,均经术后病理报告证实,排除远处转移、病理资料不完整、术前接受过化疗或放疗等患者。根据不同手术方式将74例患者分为颈部—右胸—腹部三切口组(n=39)和左胸切口组(n=35),2组患者在性别比、年龄、TNM分期、发病部位等一般资料上比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组患者一般资料比较 例
1.2 方法 颈部—右胸—腹部三切口在右胸后外侧第5肋间取切口进胸,将肿瘤及全部胸段食管切除,然后关闭胸腔,患者取仰卧位,于上腹部正中取切口,将胃体游离出,在颈部进行胃-食管吻合,将术野淋巴结进行仔细清扫。左胸单切口在左胸后外侧第6肋间取切口进胸,将大部分胸内食管切除,在同侧切开膈肌后进入腹腔,将术野淋巴结进行仔细清扫,然后行左胸膜顶胃-食管吻合。
1.3 观察指标 比较2组患者的淋巴结清扫数目、围术期病死率、并发症发生率,并对淋巴结转移进行单因素和多因素分析,对患者进行3~36个月随访,观察2
组患者1年、3年生存率。

2 结果
2.1 2组患者淋巴结清扫数目及淋巴结转移比较 三切口组患者共切除淋巴结682个,平均(21.53±6.07)个,左胸切口组共切除淋巴结421个,平均(13.04±4.28)个,三切口组淋巴结清扫数目显著高于左胸切口组,差异有统计学意义(t=6.879,P<0.05);病理报告显示,74例患者中出现淋巴结转移39例,占52.70%,其中上段11例,占52.38%,中段16例,占53.33%,下段12例,占52.17%。
2.2 2组患者围术期死亡及并发症发生率比较 2组患者围术期死亡及并发症发生率比较差异无统计学意义(P>0.05)。见表2。

表2 2组患者围术期死亡及并发症发生率比较 例(%)
2.3 淋巴结转移单因素分析 单因素分析结果显示,TNM分期、肿瘤分化程度、肿瘤直径、浸润深度对食管癌患者淋巴结转移有显著影响(P<0.05)。见表3。

表3 淋巴结转移单因素分析 例(%)
2.4 淋巴结转移多因素Logistic回归分析 将TNM分期、肿瘤分化程度、肿瘤直径≥2 cm、浸润深度进行赋值并纳入多因素Logistic回归分析方程并作为作为自变量,淋巴结转移作为因变量,多因素Logistic回归分析结果显示,TNM分期、肿瘤分化程度、肿瘤直径、浸润深度是淋巴结转移的独立危险因素(P<0.05)。见表4。
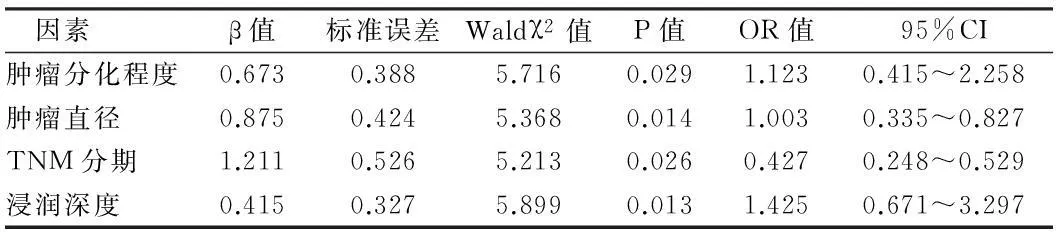
表4 淋巴结转移多因素Logistic回归分析
2.5 2组患者生存率比较 经过6~36个月随访,三切口组生存率69.23%(27/35),左胸切口组生存率为42.86%(15/35),观察组生存率高于对照组,差异有统计学意义(P<0.05)。见图1。

图1 2组患者Kaplan-Meier生存曲线图
3 讨论
近几年,食管癌淋患者巴结转移受到越来越多的关注。本研究中,39例患者出现淋巴结转移,占52.70%,其中Ⅰ+Ⅱ期有11例患者,占28.12%,Ⅲ+Ⅳ期有28例患者,占71.79%。从本组患者来看,食管癌在早期时就会出现淋巴结转移。因此,在进行淋巴结清扫术时必须要充分重视。
对于食管癌淋巴结转移的危险因素临床研究较多,在伍宁等[2]的研究中发现,大体病理类型、肿瘤直径、分化程度和浸润程度是食管癌患者淋巴结转移的主要危险因素。国外研究显示,TNM分期、肿瘤分化程度、肿瘤直径、浸润深度对食管癌淋巴结转移有显著影响[3]。在本研究中,TNM分期、肿瘤分化程度是淋巴结转移的独立危险因素。肿瘤分化程度包括高分化、中分化、低分化和未分化,高分化肿瘤的瘤细胞分化程度比较高,与来源组织的成熟形态较接近,此时癌细胞生长缓慢,转移较晚,恶性程度低;而低分化癌细胞来源组织的不成熟形态较接近,此时癌细胞生长极快,转移较早,恶性程度高,治疗难度大。在淋巴交通网这种易于转移的情况下,低分化瘤细胞极易出现淋巴结转移。TNM分期是大多数恶性肿瘤预后、远处转移等的影响因素,如国外研究发现,术后化疗、TNM分期、恶性肿瘤分化程度及远处转移是直肠癌患者远期预后的重要因素,其中TNM分期是最重要的影响因素[4]。因此,随着分期增加,食管癌淋巴结转移率出现上升趋势。
本研究中,多因素Logistic回归分析发现OR值最高,提示浸润深度对食管癌患者淋巴结转移影响最为显著。主要原因可能与食管癌生理解剖结构有关,食管黏膜下淋巴交通网呈密集分布,在病情进展过程中,癌细胞能够通过密集的淋巴网向淋巴结以及颈部、腹部、胸部转移,甚至出现跳跃性转移,从而增加了转移发生率。因此,浸润程度越深,食管癌淋巴结转移率就越高。不过,肿瘤直径与食管癌患者淋巴结转移之间的关系目前尚存在争议。大多数学者认为随着肿瘤直径增加,淋巴结转移率也随之升高,少数学者则认为食管癌淋巴结转移与肿瘤直径无明显关系[5]。本研究中,通过比较不同肿瘤直径患者淋巴结转移率发现,≥2 cm患者淋巴结转移率为70.97%,显著高于<2 cm患者,且经过多因素Logistic回归分析发现,肿瘤直径为淋巴结转移的独立危险因素。与临床相关研究结果较为接近[6]。
淋巴结彻底清扫是提高食管癌患者生存率和改善预后的重要治疗手段,由于生理结构影响,有必要对颈部、腹部和胸部的淋巴结进行清扫。临床研究显示,食管癌患者淋巴结切除数目越多,根治程度也就越高[7]。多数研究发现,经颈部—右胸—腹部三切口能够明显增加食管癌患者淋巴结切除数量[8]。本研究中,共切除淋巴结1103枚,其中三切口组每例患者平均切除(21.53±6.07)个,显著高于左胸切口组的(13.04±4.28)个。与临床研究[9]基本一致。虽然淋巴结切除数量较多,但该术式在国内的应用并未普及,可能与手术操作时间较长、术式复杂程度高、围术期死亡率及术后并发症发生率较高等原因有关。本研究中,两组患者均无一例围术期死亡发生,且术后并发症发生率较为接近。但三切口组喉返神经损伤率要高于左胸切口,主要原因为双侧喉返神经为淋巴结清扫重点区域,在清扫该区域淋巴结时较易损伤喉返神经,导致咳嗽无力、声音嘶哑等发生。因此,在行颈部—右胸—腹部三切口术式时,要选择熟练程度高、经验丰富的术者进行操作,以减轻对病灶临近神经组织的损伤程度。
通过对本组患者进行为期3~36个月的随访发现,三切口组患者生存率为69.23%,显著高于左胸切口组的42.86%。表明颈部—右胸—腹部三切口术式可以显著提高食管癌患者预后,与临床研究结果[10]基本一致。不过也有国外学者研究发现,各段食管癌转移部位并不相同,下段食管癌以上腹部区域、中下纵隔多见,中段食管癌以上腹部、胸部及颈部多见,上段食管癌以颈部、中上纵隔多见,导致不同部位食管癌行颈部—右胸—腹部三切口术式治疗时预后差异较大,颈部—右胸—腹部三切口术式并没有显著提高下段食管癌患者远期生存率[11]。因此,部分学者认为,中、上段食管癌行颈部—右胸—腹部三切口术式较为适宜,而下段食管癌则可选择左胸切口术式[12]。不过由于下段食管癌也存在颈部淋巴结转移情况,所以在临床中应重视肿瘤大小与淋巴结转移的关系,并结合患者浸润深度、分化程度、TNM分期等重要病理因素,从而更加准确地评估患者病情,为淋巴结清扫术选择提供针对性依据。
综上所述,TNM分期、肿瘤分化程度、肿瘤直径、浸润深度是食管癌淋巴结转移的重要危险因素,食管癌行颈部—右胸—腹部三切口术式可提高淋巴结清扫数目,改善了患者预后,值得临床重视。
1 Li SM,Jiang P,Xiang Y,et al.Protease-activated receptor (PAR)1,PAR2 and PAR4 expressions in esophageal squamous cell carcinoma.Dongwuxue Yanjiu,2014,35:420-425.
2 伍宁,陈志明,庞烈文,等.左胸单切口和颈一右胸—腹三切口在食管癌淋巴结清扫中的应用.肿瘤研究与临床,2013,25:77-79.
3 Kunisaki C,Makino H,Kimura J,et al.Impact of lymph-node metastasis site in patients with thoracic esophageal cancer.J Surg Oncol,2010,101:36-42.
4 Suzuki G,Yamazaki H,Ogo E,et al.Multimodal approach for cervical esophageal carcinoma: role of neoadjuvant chemotherapy.Anticancer Res,2014,34:1989-1992.
5 Lee JM,Yang SY,Yang PW,et al.Polymorphism in epidermal growth factor receptor intron 1 predicts prognosis of patients with esophageal cancer after chemoradiation and surgery.Ann Surg Oncol,2011,18:2066-2073.
6 Li B,Chen H,Xiang J,et al.Pattern of lymphatic spread in thoracic esophageal squamous cell carcinoma: A single-institution experience.J Thorac Cardiovasc Surg,2012,144:778-785.
7 Twine CP,Roberts SA,Rawlinson CE,et al.Prognostic significance of the endoscopic ultrasound defined lymph node metastasis count in esophageal cancer.Dis Esophagus,2010,23:652-659.
8 吴建兵,洪瑞,方伟群.经左胸单切口和经右胸—腹部—颈部三切口治疗中段食管癌的手术疗效比较.中国伤残医学,2013,21:28-29.
9 张康,张广敬,崔宏伟,等.胸中段食管癌经颈胸腹三野淋巴结清扫与经胸单切口二野淋巴结清扫的效果比较.山东医药,2014,54:52-54.
10 Zhang DH,Chen JY,Hong CQ,et al.High-risk human papillomavirus infection associated with telomere elongation in patients with esophageal squamous cell carcinoma with poor prognosis.Cancer,2014,120:2673-2683.
11 Song ZB,Lin BC,Li B,et al.Preoperative elevation of serum C-reactive protein as an indicator of poor prognosis for early-stage esophageal squamous cell carcinoma.Kaohsiung J Med Sci,2013,29:662-666.
12 Feng JF,Huang Y,Liu JS.Combination of neutrophil lymphocyte ratio and platelet lymphocyte ratio is a useful predictor of postoperative survival in patients with esophageal squamous cell carcinoma.Onco Targets Ther,2013,6:1605-1612.
10.3969/j.issn.1002-7386.2016.08.015
523100 广东省东莞东华医院
R 735.1
A
1002-7386(2016)08-1170-03
2015-11-20)

