罗非鱼无乳链球菌EsxA基因克隆与原核表达
马艳平, 梁志凌, 马江耀, 刘振兴, 郝 乐,柯 浩
(广东省农业科学院动物卫生研究所/广东省兽医公共卫生公共实验室,广东广州 510640)
罗非鱼无乳链球菌EsxA基因克隆与原核表达
马艳平, 梁志凌, 马江耀, 刘振兴, 郝乐,柯浩*
(广东省农业科学院动物卫生研究所/广东省兽医公共卫生公共实验室,广东广州 510640)
摘要:Ⅶ型分泌系统(T7SS)是近年来发现的分泌系统,分泌两种胞外蛋白,EsxA基因编码的ESAT6蛋白和EsxB基因编码的CFP-10蛋白。分泌蛋白具有良好的免疫原性,促进细菌从巨噬细胞吞噬体逃逸、影响巨噬细胞凋亡及裂解细胞等生物学功能,与致病性密切相关。以罗非鱼源无乳链球菌为模板,克隆到294 bp的EsxA基因,将目的序列克隆到pMD18-T载体,经测序,目的序列与无乳链球菌EsxA基因同源率在99%以上。EsxA基因克隆到pET32a载体中,重组载体在28℃、0.5 mmol/L IPTG诱导条件下表达量最大,可溶性表达。将纯化的ESAT6蛋白免疫Balb/c鼠,成功制备ESAT6蛋白鼠多克隆抗体,经Western blot,ESAT6蛋白具有良好的反应原性。研究结果为进一步进行无乳链球菌ESAT6蛋白的免疫学功能研究奠定了基础。
关键词:Ⅶ型分泌系统;无乳链球菌;EsxA基因;克隆与表达
Ⅶ型分泌系统(type Ⅶ secretion system, T7SS)由多种组分构成,分泌两种具有免疫原性的胞外蛋白,即EsxA基因编码的早期分泌抗原靶6(earlier secreted antigen target 6,ESAT6)和EsxB基因编码的培养滤液蛋白10(culture filter protein 10, CFP-10)。它们具有良好的免疫原性,能改变宿主细胞信号传导、促进细菌从巨噬细胞吞噬体逃逸、影响细胞凋亡及裂解细胞等生物学功能,与致病性密切相关。分支杆菌属细菌、金黄色葡萄球菌、炭疽杆菌等细菌Ⅶ型分泌系统分泌蛋白功能已有文献报道[1-4]。
对结核分支杆菌ESAT6和CFP-10的研究最为深入。ESAT6和CFP-10 是结核分支杆菌重要的T细胞抗原,可被感染结核分支杆菌的动物或人的T淋巴细胞识别,并可诱导其产生高水平的IFN-γ[5],同时它也具有刺激B细胞反应的抗原决定簇[6]。近年的研究中,用ESAT6和CFP-10基础的亚单位疫苗或DNA疫苗,都在动物试验中显示出很好的免疫保护性[7-8]。
无乳链球菌属于B群链球菌,是重要的人畜共患细菌性疫病致病原。鱼类包括罗非鱼在内的多种鱼类均可受到无乳链球菌的感染,死亡率很高[9-15]。近年来我国罗非鱼养殖业受到无乳链球菌的严重威胁。疫苗是防控链球菌有效的方法,关于罗非鱼链球菌亚单位疫苗的研究是近年来的一个热点[16-18],但未见无乳链球菌Ⅶ型分泌系统分泌蛋白ESAT6基础的疫苗研究。近期学者对无乳链球菌ESAT6样蛋白进行生物信息学分析,认为ESAT6蛋白和CFP-10以同源二聚体的形式发挥作用。分子C端具有特征性的色氨酸-X-甘氨酸(WXG)序列,ESAT6蛋白与结核分支杆菌ESAT6有14.9%相似度,与金黄色葡萄球菌ESAT6有22.7%的相似度。晶体结构衍射试验预测无乳链球菌ESAT6蛋白可作为细菌的黏附素参与细菌对宿主细胞的黏附与入侵[19-20]。因此,本试验对罗非鱼无乳链球菌ESAT6蛋白进行克隆与表达,分析其分子特征,进一步为无乳链球菌ESAT6蛋白的免疫学功能研究提供基础数据。
1材料与方法
1.1材料
无乳链球菌广东中新株(ZX1),由广东省农业科学院动物卫生研究所水产病害室分离鉴定并保存;大肠埃希菌Dpα、BL21(DE3)菌株、pET32a质粒,广东省农业科学院动物卫生研究所水产病害室保存;Taq酶、dNTP、pMD-18T载体、内切酶、T4DNA连接酶、DNA Maker,TaKaRa公司产品;质粒DNA提取试剂盒、胶回收试剂盒、PCR纯化试剂盒,Axygen公司产品;蛋白Maker,Fermentas公司产品;细菌基因组提取试剂盒,天根公司产品;其他试剂均为国产分析纯。
1.2方法
1.2.1引物的设计与合成根据GenBank公布的无乳链球菌基因组 (GenBank No.CP003810.1)EsxA基因序列,分别设计引物(表1),其中,EsxA-1基因下划线为BamHⅠ酶切位点,EsxA-2基因下划线为HindⅢ酶切位点。扩增EsxA基因的完整读码框,引物由上海生工生物工程技术服务有限公司合成。

表1 EsxA基因扩增引物序列
1.2.2EsxA基因的克隆与序列分析使用细菌基因组DNA提取试剂盒提取无乳链球菌ZX1株基因组DNA,以提取的基因组DNA为模板,以EsxA-F/EsxA-R为引物进行PCR扩增,扩增产物用胶回收试剂盒回收,回收产物与pMD18-T载体16℃连接2 h后,连接产物转化至大肠埃希菌Dpα菌株,涂布Amp+抗性LA平板,37℃培养过夜,挑取单克隆进行PCR鉴定,鉴定为阳性的重组质粒pMD18T-EsxA送上海生工生物工程技术服务有限公司测序。利用BlastT程序、ExPASy程序、Swiss-PDBviewer和Lasergene软件对目的基因进行序列分析和编码氨基酸序列活性位点、抗原性分析。
1.2.3重组质粒pET32a-EsxA的构建利用质粒提取试剂盒提取pMD18T-EsxA,用EsxA-1/EsxA-2引物进行PCR扩增,扩增产物用胶回收试剂盒回收,将回收产物和pET32a质粒用限制性内切酶进行双酶切,将酶切产物进行PCR纯化后,将目的片段酶切产物和pET32a酶切产物用T4DNA连接酶16℃连接过夜,转化大肠埃希菌Dpα,挑取单克隆菌株进行PCR鉴定和酶切鉴定,阳性重组质粒pET32a-EsxA送上海生工生物工程技术服务有限公司测序。
1.2.4ESAT6蛋白表达、纯化用质粒提取试剂盒提取pET32a-EsxA重组质粒,取1 μL重组质粒转化大肠埃希菌感受态BL21(DE3)菌株。将含有重组质粒pET32a-EsxA的大肠埃希菌BL21(DE3)接种于10 mL Amp抗性的LB培养基中活化培养过夜,再按1∶100比例接种于100 mL无抗性LB培养基中,37℃、220 r/min摇床2 h~3 h,待菌液OD值达到0.4~0.5时,分别加入0.2、0.5、1 mmol/L IPTG,分别于28℃、37℃诱导24 h。离心收集菌体,ddH2O洗涤菌体2次后,再用20 mL ddH2O悬浮菌体,用超声波破碎30 min,破碎后分别收集上清和沉淀,沉淀用1 mL ddH2O悬浮,分别取20 μL上清和沉淀,进行SDS-PAGE电泳。选取最佳表达条件的上清液,采用Novagen His Bind 蛋白纯化试剂盒进行纯化。
1.2.5ESAT6蛋白鼠多克隆抗体的制备将纯化蛋白进行BCA蛋白定量,按50 μg ESAT6纯化蛋白与等体积的完全弗氏佐剂混合,充分乳化后在鼠尾根部进行多点免疫注射,按相同的剂量与等体积的不完全弗氏佐剂混合,间隔14 d进行第2次、第3次以及第4次免疫。4次免疫后第10天,对小鼠断尾小量采血测定效价。效价达到要求后,用纯化的50 μg ESAT6纯化蛋白加强免疫,2 d~4 d内进行眼球采血,收集、分离得到含有抗ESAT6蛋白的鼠多克隆抗体的血清。
1.2.6Western blot检测ESAT6蛋白免疫原性纯化蛋白经SDS-PAGE后,经160 mA、3 h转膜至硝酸纤维素薄膜上,将转移后的硝酸纤维素薄膜用50 g/L脱脂奶粉封闭液封闭2 h后,先后以鼠抗ESAT6抗体(1∶1 000稀释)、HRP标记的羊抗鼠抗体(1∶2 000稀释)在室温下各孵育1 h后,用DAB显色试剂盒显色后检测。
2结果
2.1EsxA基因的克隆、序列、活性位点及抗原表位分析
以无乳链球菌ZX1菌株的基因组DNA为模板,引物EsxA-F/EsxA-R进行PCR扩增,克隆、测序获得294 bp的目的序列,该序列含有EsxA基因的完整开放阅读框,将目的片段克隆到pMD-18T载体上,经测序,Blast显示目的序列与GenBank上已登录的罗非鱼源无乳链球菌EsxA基因序列(No.CP003810.1)高度同源(100%)。利用ExPASy蛋白质翻译软件,该基因编码蛋白ESAT6具有98个氨基酸,具有WXG 特征性序列(图1), 与结核分支杆菌ESAT6有14.9%的相似度,与金黄色葡萄球菌ESAT6有22.7%的相似度。利用Lasergene软件对ESAT6抗原性进行分析,ESAT6氨基酸序列中可形成符合亲水性>0,抗原指数>0, 表面可及性>1条件的抗原表位共有9个。

图1 无乳链球菌ZX1菌株ESAT6蛋白Clustal W比对结果
2.2重组表达载体的构建、表达与纯化
以测序正确的pMD18T-EsxA重组质粒为模板,经PCR扩增、胶回收。目的片段和pET32a质粒分别经双酶切后进行连接,转化大肠埃希菌BL21。挑取阳性克隆菌株,经PCR和酶切鉴定,测序证实插入序列正确(图2),重组载体命名为pET32a-EsxA。
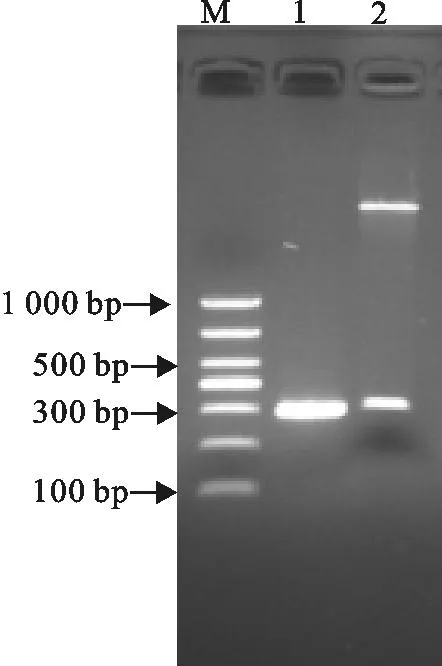
M.DNA 标准DL 1 000;1.pET32a-EsxA重组质粒PCR鉴定结果;2.pET32a-EsxA重组质粒双酶切鉴定结果
M.DNA Marker DL 1 000;1.PCR results of recombinant plasmid pET32a-EsxA;2.Enzyme digestion result of recombinant plasmid pET32a-EsxA
图2pET32a-EsxA重组质粒鉴定结果
Fig.2The identification results of recombinant
plasmid pET32a-EsxA
重组表达菌株经不同IPTG浓度、不同诱导温度诱导表达,诱导表达后的菌体经超声波破碎,分别收集上清和沉淀,经SDS-PAGE电泳检测,显示目的蛋白仅存在于上清中,表明目的蛋白主要以可溶性形式表达,在28℃、0.5 mmol/L IPTG诱导条件下,表达量最大。表达产物经His-Bind蛋白纯化试剂盒纯化,经SDS-PAGE分析显示,获得大小约为28 ku的蛋白条带(图3),与预期大小一致。
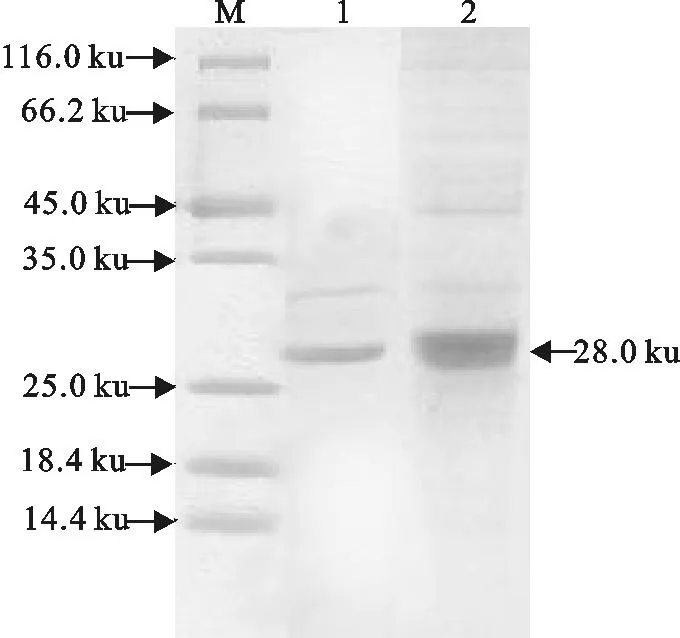
M.蛋白分子质量标准;1.纯化的重组ESAT6蛋白;2.诱导的pET32a-ESAT6
M.Protein molecular weight Marker;1.Purified ESAT6 protein; 2.Induced pET32a-ESAT6
图3重组ESAT6蛋白的SDS-PAGE分析
Fig.3SDS-PAGE analysis of ESAT6 protein
2.3鼠抗ESAT6蛋白多克隆抗体的制备与效价测定
以纯化后的蛋白为免疫原,经过4次免疫,眼球采血,用间接ELISA方法测定制备的鼠抗血清效价,如表2所示,鼠抗ESAT6蛋白血清的最终效价为1∶160 000。
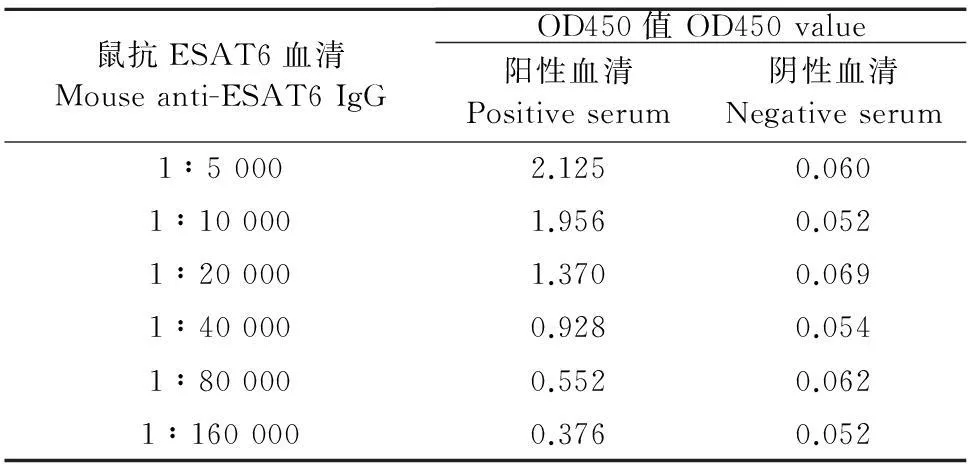
表2 4次免后间接ELISA方法测定鼠抗
2.4Western blot检测纯化蛋白免疫原性
Westem blot检测结果表明,鼠抗ESAT6血清在28 ku处重链有一明显的杂交条带,与预期的重组蛋白ESAT6分子质量大小相符(图4),说明ESAT6蛋白具有良好的反应原性。
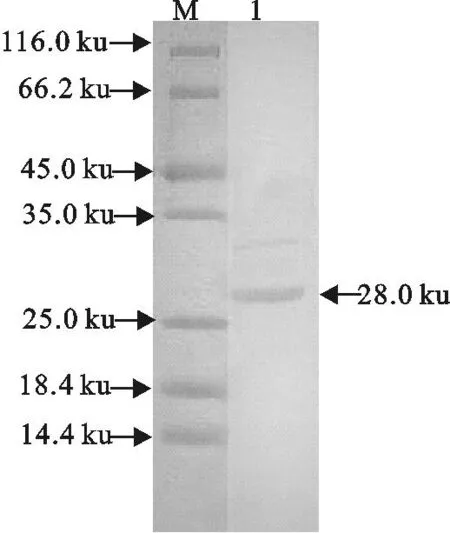
M.蛋白分子质量标准;1.纯化重组蛋白ESAT6
M.Protein molecular weight Marker;1.Purified ESAT6 protein
图4重组蛋白ESAT6 Western blot分析
Fig.4Western blot analysis of ESAT6 protein
3讨论
EsxA基因编码的早期分泌抗原6,具有良好的免疫原性。而在无乳链球菌中发现,两种分泌蛋白以同源二聚体的形式发挥作用,统称为ESAT6蛋白。生物信息学分析认为ESAT6、CFP-10异源二聚体是由同源二聚体进化变异而来[20],我们预测无乳链球菌ESAT6同源二聚体也与致病性密切相关,目前对无乳链球菌Ⅶ型分泌系统研究还未报道,其分泌蛋白ESAT6是否具有免疫原性,是否具有致病力呢?我们期望通过研究,明确ESAT6蛋白的生物学功能。
本研究克隆了罗非鱼源无乳链球菌ZX1菌株的EsxA基因,Blast显示EsxA基因具有高度保守性。用ExPAsy软件预测分析,含有WXG活性位点。据文献报道,当亲水性>0,抗原指数>0,表面可及性>1时,形成表位的可能性较大[21]。用Lasgene预测EsxA基因编码的ESAT6蛋白的抗原性,EsxA编码ESAT6蛋白可形成9个抗原表位,推测该蛋白具有较强的免疫原性。
本研究将EsxA基因插入到pET32a表达载体中,在原核表达系统中成功获得重组蛋白,利用原核表达系统表达的重组蛋白以可溶性表达或包涵体的形式存在,可溶性表达存在于上清里,蛋白纯化较为方便。包涵体存在于离心沉淀中,这种表达蛋白需经过溶解、变性、复性等处理, 蛋白纯化步骤繁琐,本研究获得了可溶性表达的重组蛋白,为后续的试验提供了便利,重组蛋白利用His标签经His-Bind纯化柱纯化,重组蛋白纯度达到95%以上,经透析后可直接用于免疫试验。
本研究制备的抗ESAT6蛋白鼠多抗效价达到1∶160 000。并将其用于ESAT6重组蛋白Western blot鉴定,证实制备的ESAT6重组蛋白具有较好的反应原性。这就为EsxA基因免疫功能的研究奠定了良好的基础,EsxA基因可作为新型无乳链球菌亚单位疫苗的候选基因,并为罗非鱼无乳链球菌病的基因工程亚单位疫苗的研究提供基础数据和试验材料。
参考文献:
[1]Guinn K I,Hickey M J,Mathur S K,et al.Individual RD1-region genes are required for export of ESAT-6/CFP-10 and for virulence ofMycobacteriumtuberculosis[J][J].Mol Microbiol,2004,51:359-370.
[2]Abdallah A M,Gey Van Pittius N C,Vhampion P A,et al.VII secretion-mycobacteria show the way[J].Nat Rev Microbiol,2007,5(11): 883-891.
[3]Burts M L,Williams W A,DeBord K,et al.EsxA and EsxB are secreted by an ESAT-6-like system that is required for the pathogenesis ofStaphylococcusaureusinfections[J].Proc Natl Acad Sci USA,2005,102(4):1169-1174.
[4]Garufi G,Butler E,Missiakas D.ESAT-6-like protein secretion inBacillusanthracis[J].J Bacteriol,2008,190(21):7004-7011.
[5]Stanley S A,Johndrow J E,Manzanillo P,et al.The Type Ⅰ IFN response to infection withMycobacteriumtuberculosisrequires ESX-1-mediated secretion and contributes to pathogenesis[J].J Immunol,2007,178(5):3143-3152.
[6]Henao-Tamayo M,Palaniswamy G S,Smith E E,et al.Post-exposure vaccination againstMycobacteriumtuberculosis[J].Tuberculosis,2009,89(2):142-148.
[7]Zhang H,Peng P,Miao S,et al.RecombinantMycobacteriumsmegmatisexpressing an ESAT6-CFP10 fusion protein induces anti-mycobacterial immune responses and protects againstMycobacteriumtuberculosischallenge in mice[J].Scand J Immunol,2010,72(4):349-357.
[8]Li W,Deng G,Li M,et al.A recombinant adenovirus expressing CFP10, ESAT6, Ag85A and Ag85B ofMycobacteriumtuberculosiselicits strong antigen-specific immune responses in mice [J].Mol Immunol,2014,62(1):86-95.
[9]Evans J J,Pasnik D J,Klesius P H,et al.First report ofStreptococcusagalactiaeandLactococcusgarvieaefrom a wild bottlenose dolphin (Tursiopstruncatus) [J].J Wildlife Dis,2006,42(3):561-569.
[10]Robinson J A,Meyer F P.Streptococcal fish pathogen [J].J Bacteriol,1966,92(2):512.
[11]Plumb J A,Schachte J H,Gaines J L,et al.Streptococcussp.from marine fishes along the Alabama and northwest Floridacoast of the gulf of Mexico [J].Transact Am Fish Soc,1974,103(2):358-361.
[12]Evans J J,Klesius P H,Glibert P M,et al.Characterization of beta-haemolytic Group BStreptococcusagalactiaein cultured seabream,SparusauratusL.,and wild mullet,Lizaklunzingeri (Day),in Kuwait [J].J Fish Dis,2002,25(9):505-513.
[13]Mian G F,Godoy D T,Leal C A.Aspects of the natural history and virulence ofS.agalactiaeinfection in Nile tilapia[J].Vet Microbiol,2009,136(1-2):180-183.
[14]张新艳.罗非鱼无乳链球菌的分子鉴定[J].福建水产, 2007,4(4):5-8.
[15]Pereira U P,Mian G F,Oliveira I C,et al.Genotyping ofStreptococcusagalactiaestrains isolated from fish,human and cattle and their virulence potential in Nile tilapia [J].Vet Microbiol,2010,140(1-2):186-192.
[16]黎炯,叶星,可小丽,等.罗非鱼无乳链球菌Sip 基因的克隆、表达及免疫原性分析[J].水生生物学报,2012,36(4):626-633.
[17]Evans J J,Klesius P H,Shoemaker C A.Efficacy ofStreptococcusagalactiae(group B) vaccine in tilapia (Oreochromisniloticus) by intraperitoneal and bath immersion administration[J].Vaccine,2004,22( 27/28):3769-3773.
[18]王蓓,李桂欢,鲁义善,等.吉富罗非鱼源无乳链球菌Sip-GAPDH融合基因的构建及其原核表达[J].生物技术通报,2014(7):137-142.
[19]Shukla A,Pallen M,Anthony M,et al.The homodimeric GBS1074 fromStreptococcusagalactiae[J].Acta Crystallogr Sect F Struct Biol Cryst Commun, 2010,66(Pt11):1421-1425.
[20]Poulsen C,Panjikar S,Holton S J,et al.WXG 100 protein superfamily consists of three subfamilies and exhibits an α-helical C-terminal conserved residue pattern[J].PLoS One,2014,26(2):e89313.
[21]Kvte J,Doolittle R F.A simple method for displaying the hydropathic character of a protein [J].J Molecular Biol,1982,157(1):105-137.
Clonging and Protokaryon Expression of EsxA Gene ofStreptococcusagalactiaein Tilapia
MA Yan-ping, LIANG Zhi-ling, MA Jiang-yao, LIU Zhen-xing, HAO Le, KE Hao
(GuangdongPublicLabofVeterinaryPublicHealth,InstituteofVeterinaryMedicine,GuangdongAcademyofAgriculturalSciences,Guangzhou,Guangdong,510640,China)
Abstract:New discovered type Ⅶ secretion system (T7SS) secrets two extracellular proteins including EsxA coded ESAT6 and EsxB coded CFP-10, which is related to pathogenicity closely. ESAT6 and CFP-10 proteins have diverse functions such as promoting bacteria from phagosome of macrophage,impacting macrophage apoptosis and lysis. The two secreted proteins in T7SS of Streptococcus agalactiae form the homologous dimmers,collectively known as ESAT6 protein,may be bacterial adhesion protein showing important for host-cell attachment and invasion in S.agalactiae through bioinformatics analysis.But ESAT6 protein whether has the virulence and its pathogenesis is not clear,therefore it is necessary to study on it.We cloned 294 bp sequence from tilapia Streptococcus agalactiae.And the sequence was cloned into pMD18-T vector,the homology is 99% with tilapia Streptococcus agalactiae EsxA gene.EsxA gene was cloned into pET32a vector.The best solouble expression was under 0.5 mmol/L IPTG,28℃.In addition,the purified protein was used to immunize Balb/c mice to prepare mouse anti-ESAT6 protein antibody.ESAT6 protein had sastisfied reactogenicity through Western blot test.These results encouraged further research for the immunological function of S.agalactiae ESAT6 protein.
Key words:type Ⅶ secretion system;Streptococcus agalactiae; EsxA gene;clonging and expression
文章编号:1007-5038(2016)04-0035-05
中图分类号:S852.4;Q789
文献标识码:A
作者简介:马艳平(1984-), 女, 山东德州人,硕士, 主要从事水产病害学研究。*通讯作者
基金项目:广东省海洋渔业局科技与产业发展专项(A201401C06);广州市农业科技攻关项目(GZCQC1202FG04002-01);广州市科技攻关项目(2014J4100229)
收稿日期:2015-09-21

