鸡三种天然免疫相关受体和配体荧光定量PCR检测方法的建立及应用
黄艳艳,高丹丹,许传田,朱曼玲,杨少华,黄庆华,张 琳,张秀美,吴家强*
(1.山东省农业科学院畜牧兽医研究所,山东济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;3.山东农业大学动物科技学院, 山东泰安 271018)
鸡三种天然免疫相关受体和配体荧光定量PCR检测方法的建立及应用
黄艳艳1,2,高丹丹3,许传田1,2,朱曼玲1,2,杨少华1,2,黄庆华1,2,张琳1,2,张秀美1,2,吴家强1,2*
(1.山东省农业科学院畜牧兽医研究所,山东济南 250100;2.山东省畜禽疫病防治与繁育重点实验室,山东济南 250100;3.山东农业大学动物科技学院, 山东泰安 271018)
摘要:为建立检测鸡天然免疫相关受体(Ch-MDA5、Ch-TLR3和Ch-TLR7)及其相应配体(MAVS、TRIF和MyD88)的荧光定量PCR方法并评价其应用效果,设计和筛选特异性PCR引物,制备各基因的质粒标准品,绘制荧光定量PCR的标准曲线,并对方法的灵敏度、重复性和特异性进行检验。结果表明,所建立的检测方法敏感度高、特异性强、检测线性范围广、重复性好。应用建立的方法检测新城疫油乳剂灭活苗免疫SPF鸡后上述基因表达的变化,发现免疫后6 h各基因的表达水平达到峰值,表明疫苗免疫迅速有效地激活了机体的天然免疫应答。建立了与鸡抗病毒感染天然免疫相关的3种细胞受体和相应配体的定量检测方法,可应用于病毒致病机制、鸡用新型疫苗、免疫增强剂以及抗病毒药物的研究与开发。
关键词:鸡;天然免疫;受体与配体;检测;实时荧光定量PCR
天然免疫已逐渐成为兽医免疫学研究中一个活跃的领域。研究表明,鸡黑色素瘤分化相关抗原5(chicken melanoma differentiation-associated protein 5,Ch-MDA5)[1]、鸡Toll样受体3(chicken Toll-like receptor 3,Ch-TLR3)[2]和鸡Toll样受体7(chicken toll-like receptor 7,Ch-TLR7)[3]是鸡体识别RNA病毒感染的主要模式识别受体(pattern recognition receptor,PRR)。Ch-TLR3和Ch-MDA5可以识别病毒复制过程中产生的双链RNA(dsRNA),而Ch-TLR7则识别单链RNA(ssRNA)[4]。上述天然免疫受体与其特异性配体结合后,启动鸡体天然免疫的信号级联传导:起始转录因子的活化,诱导细胞分泌细胞因子、趋化因子及干扰素,并最终促进抗病毒物质的产生[5-6]。其中,Ch-MDA5依赖于线粒体抗病毒蛋白(mitochondrial antiviral signaling protein,MAVS)介导的信号通路发挥作用,Ch-TLR3通过TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon B,TRIF)依赖的信号传导通路发挥作用,而Ch-TLR7通过髓样分化因子88 (myeloid differentiation primary response gene 88,MyD88)依赖的信号通路起作用[7]。
检测病毒感染或疫苗免疫对鸡天然免疫信号通路相关分子的影响,对于深入了解病毒的致病机制,研究开发鸡用新型疫苗、免疫增强剂以及抗病毒药物,均具有非常重要的意义。荧光定量PCR(qPCR)方法具有敏感、快速、实时和所需检测样品少等优点,是目前对基因表达进行定量检测的金标准[8]。此类方法用于鸡天然免疫信号通路中相关受体、配体、细胞因子及效应分子的标准化检测, 将为相关的科学研究带来极大的便利。本研究旨在建立检测Ch-MDA5、Ch-TLR3、Ch-TLR7、MAVS、TRIF和MyD88转录水平的荧光定量PCR(qPCR)方法,并将其用于检测疫苗免疫SPF鸡后相应基因的表达变化,以验证所建立的方法的实际应用效果。
1材料与方法
1.1材料
1.1.1毒株及疫苗新城疫病毒弱毒疫苗株(La Sota),山东省畜禽疫病防治与繁育重点实验室保存;新城疫油乳剂疫苗,齐鲁制药有限公司产品。
1.1.2主要试剂Trizol、TE缓冲液、反转录试剂盒、高保真酶PCR试剂盒,Invitrogen公司产品;胶回收试剂盒、质粒提取试剂盒,Qiagen公司产品;pUC57载体、Dpα感受态细胞,荧光定量PCR预混液(Master Mix)和缓冲液(buffer),上海生工生物工程技术服务有限公司产品;一次性蝶形采血针、EDTA抗凝真空采血管,北京美科美加生物科技有限公司产品;鸡外周血淋巴细胞(peripheral blood lymphocyte,PBL)分离试剂盒,天津市灏洋生物制品科技有限公司(TBD)产品。
1.1.3实验动物3周龄SPF白色来航鸡,购自山东省农业科学院家禽研究所SPF鸡研究中心,经环境适应5 d后(30日龄)用于试验。
1.2方法
1.2.1引物设计下载Ch-MDA5,Ch-TLR3,Ch-TLR7,MAVS,TRIF和MyD88的基因序列,其GenBank序列号分别为:AB371640、KM486593、KM486601、M-001012893、NM-001030962和NM-001081506。以这些参考基因序列作为引物设计的模板,使用Primer Premier 5.0设计多对特异性PCR引物,引物长度在18 bp~22 bp之间,扩增产物长度小于300 bp。
1.2.2引物筛选和各基因质粒标准品的制备用新城疫病毒弱毒疫苗株(La Sota)感染11日龄的SPF鸡胚。在病毒感染24 h后收取鸡胚尿囊液,应用Trizol法提取其总RNA。溶解于20 μL的TE缓冲液。用核酸/蛋白紫外检测仪测定RNA的纯度(OD 260 mm/OD 280 nm=2.0左右为高纯度RNA)。使用随机引物将RNA反转录为cDNA,保存于-20℃备用。
以上述cDNA为模板,分别使用6个基因的多对特异性引物进行PCR,扩增相应的基因片段。将PCR产物进行琼脂糖凝胶电泳。选取条带单一、亮度高而且产物大小与预期一致的PCR反应中使用的引物,作为各基因的优化引物,用于后续试验。将PCR产物做胶回收,然后与pUC57载体连接。将重组载体转化大肠埃希菌Dpα感受态细胞,进行细菌培养并提取质粒。阳性质粒的鉴定采用PCR鉴定和序列测定验证的方法进行。测序结果分别与GenBank中的参考序列进行比对。用核酸/蛋白紫外检测仪测定质粒的纯度(OD 260 nm/OD 280 nm=1.8左右为高纯度DNA)和浓度,并换算为质粒拷贝数,置于-20 ℃保存。质粒拷贝数计算公式为:
拷贝数(拷贝/μL)=6.02×1023×质粒浓度(g/μL)/MW;
MW(g/mol)=质粒大小(bp)×660 g/mol·bp。
1.2.3qPCR反应条件的优化首先使用不同的退火温度,进行上述6个基因的PCR扩增,确定各基因扩增反应共同的最佳退火温度,从而达到一次qPCR操作可同时检测6个基因的目标。然后,使用最佳退火温度及不同的引物浓度进行qPCR,优化qPCR的引物使用量。将指数扩增期出现最早(即Ct 值最小)、扩增曲线最佳(即典型的 S 型曲线)以及扩增产物最多(即荧光增量值最高)的qPCR引物浓度,作为最佳引物浓度。试验使用了上海生工生物工程技术服务有限公司的荧光定量PCR预混液(Master Mix)和缓冲液(buffer),仪器为Roche LightCycler480 Real-time PCR Machine。
1.2.4qPCR标准曲线的制作和回归方程的建立标准曲线的绘制是qPCR方法进行基因定量检测的基础。本研究分别以8个浓度梯度的Ch-MDA5、Ch-TLR3、Ch-TLR7、MAVS、TRIF和MyD88质粒标准品为模板,使用上述优化的反应体系和循环参数进行qPCR,绘制反应的标准曲线,建立回归方程。
1.2.5特异性试验qPCR的特异性通过以下两个方面进行验证:①对扩增产物进行熔解曲线的分析,单一产物表现为单个熔解曲线峰值;②用建立的qPCR方法扩增对照基因,若无扩增则表明方法的特异性强。研究中使用的对照基因包括本实验室制备和保存的多种天然免疫信号通路信号分子(IL-1β、IL-2、IL-6、IL-17、IFN-α、IFN-β、IFN-γ、IFIT5、Mx、OASL和PKR)的质粒标准品。
1.2.6敏感性试验将各基因的质粒标准品进行10倍梯度稀释进行qPCR扩增,检测所建立的qPCR方法的敏感性。
1.2.7重复性试验批内重复试验:取5个不同浓度梯度的各质粒标准品,分别设3个重复同时进行qPCR;批间重复试验:取5个不同浓度梯度的各质粒标准品,在同一条件下不同时间点重复进行3次qPCR。
1.2.8qPCR方法的应用
1.2.8.1动物免疫及外周血淋巴细胞样品的采集30日龄的SPF白色来航鸡8只,经颈部皮下多点注射新城疫油乳剂疫苗各0.3 mL。分别在免疫前和免疫后6、12、24、36 h经翅静脉采集EDTA抗凝血。每次采集4只鸡的血液各0.8 mL,并合并为一份样品(3.2 mL)。血液在采集后2 h内使用鸡外周血淋巴细胞(peripheral blood lymphocyte,PBL)分离试剂盒(TBD,天津)分离淋巴细胞备用。
1.2.8.2天然免疫相关基因的检测 提取鸡淋巴细胞样品的总RNA(Trizol法),溶解于20 μL的TE缓冲液。使用随机引物及反转录试剂盒将RNA反转录合成cDNA,保存于-20℃备用。以建立的qPCR方法检测Ch-MDA5,Ch-TLR3,Ch-TLR7,MAVS,TRIF和MyD88的基因转录水平,每个样品设置3个重复。试验以细胞肌动蛋白(actin)作为内参照基因,其引物序列(表1)来自参考文献[9]。通过相对定量法(2-△△Ct)分析免疫后不同时间各基因的转录水平变化[10-11]。
2结果
2.1引物及质粒标准品
优化的6个基因引物序列及扩增片段的长度见表1。各基因的重组质粒的测序结果均与GenBank中的参考序列100%符合。
2.2qPCR体系、循环参数及结果判定
各基因优化的qPCR反应体系(20 μL)如下:qPCR Master Mix(2 ) 10 μL,qPCR buffer 2 μL,上游引物 1 μL,下游引物1 μL,模板DNA 2 μL,双蒸水 4 μL。反应程序均为:95℃预变性2.5 min;95℃ 7 s,55 ℃ 10 s,72℃ 15 s扩增45个循环;每个循环结束时检测荧光;熔解曲线分析为95℃ 15 s,60 ℃ 50 s,95℃;最后37 ℃ 30 s结束。
调整荧光定量PCR的扩增基线和阈值设定,以阈值线不低于正常阴性对照扩增曲线的最高点为准。在阳性对照(质粒标准品)为有效扩增,无模板对照(Non-template control,NTC)无扩增的前提下,读取待测样品的Ct值,进行结果判定:Ct 值大于40 的样本为阴性结果;Ct 值小于或等于40的样本为阳性结果。
2.3qPCR的标准曲线及回归方程
由qPCR的扩增曲线(图1A)可见,各基因在广泛的浓度范围内均表现为明显的指数扩增。各基因的qPCR的标准曲线见图1B。详情如下:
对于浓度梯度为7.4×101~108个拷贝的Ch-MDA5基因,其qPCR的Ct值在8.70~31.46之间,回归方程为y=38.43-3.301x(扩增效率为100%); 浓度梯度为1×102~1×109个拷贝的Ch-TLR3基因,其反应的Ct值在9.22~33.06之间,回归方程:y=40.91-3.449x(扩增效率95%);浓度梯度为1×102~1×109个拷贝的Ch-TLR7基因,qPCR的Ct值在4.67~28.15之间,回归方程为y=36.03-3.465x(扩增效率94%);浓度梯度为9.2×102~108个拷贝的鸡MAVS基因,反应的Ct值在9.38~28.55之间,回归方程为y=38.50-3.219x(扩增效率为100%);浓度梯度为102~109个拷贝的鸡TRIF基因,其qPCR的Ct值在7.51~30.65之间,回归方程为:y=41.45-3.757x(扩增效率95%);1.4×103~109个拷贝的鸡MyD88基因,其反应的Ct值在7.88~29.03之间,回归方程为y=39.69-3.494x(扩增效率96%)。
2.4特异性试验结果
各基因qPCR扩增产物的Tm值见表1,其熔解曲线均为单一峰值(图略)。此外,这6种基因的引物对多种与天然免疫相关的对照基因均无扩增,表明本研究建立的qPCR方法的特异性强。

A.扩增曲线(A1-A6);B.标准曲线(B1-B6);1. MDA5;2. TLR3;3. TLR7;4. MAVS;5. TRIF;6. MyD88
A.Amplification curves(A1-A6);B.Standard curves(B1-B6); 1.MDA5; 2.TLR3; 3.TLR7; 4.MAVS; 5.TRIF; 6.MyD88
图1qPCR检测结果
Fig.1Detection results of qPCR
2.5灵敏度试验结果
本研究建立的qPCR方法灵敏度高。当使用建立的方法分别扩增10个拷贝数的Ch-MDA5、Ch-TLR3、Ch-TLR7、MAVS、TRIF和MyD88基因时,反应的Ct值分别为34.96、37.14、32.19、35.16、37.45和36.12。
2.6重复性试验结果
建立的qPCR方法在批内、批间检测中的Ct值变异系数均在合理范围内(5%),表明方法的重复性好。
2.7qPCR方法的应用
用新城疫油乳剂疫苗免疫后,鸡外周血淋巴细胞中6个天然免疫相关基因的表达均迅速上调。以
Ch-TLR3为例,表2显示了免疫后不同时间该基因及参考基因(Actin)的qPCR检测的Ct值,并据此计算得到了Ch-TLR3表达水平的倍数变化值。可见,在病毒性油乳剂疫苗免疫后6 h,Ch-TLR3的表达水平较之免疫前提高了139倍,随后逐渐下降。在免疫后24 h和36 h时,Ch-TLR3的表达水平仍然比免疫前分别高出17倍和16倍。由图2可见,Ch-MDA5、Ch-TLR7、TRIF和MyD88的表达量均在免疫后6 h达到高峰,与Ch-TLR3类似。与之对比,MAVS基因的高水平表达持续到免疫后12 h(图2)。可见该疫苗在接种后迅速启动了鸡体的天然免疫信号通路的应答。

表2 免疫后外周血淋巴细胞中Ch-TLR3表达水平的变化
注:表中的Ct值是3次重复反应的平均值±标准差;△Ct = Ct (TLR3)-Ct (Actin);△△Ct = △Ct (xh) - △Ct (0h), 其中x= 6、12、24、36(h) 。
Note:The Ct value in the table is the mean value of three repetitions with the standard deviation;△Ct = Ct (TLR3)-Ct (Actin);△△Ct = △Ct (xh) - △Ct (0h), x = 6, 12, 24 or 36 hours.
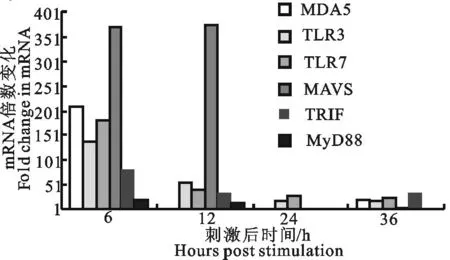
图2 疫苗免疫后SPF鸡天然免疫受体和
3讨论
本研究建立了检测鸡天然免疫3种细胞受体Ch-MDA5、Ch-TLR3和Ch-TLR7及其配体MAVS、TRIF和MyD88基因的SYBR Green Ⅰ荧光定量PCR方法,可用于相应基因的绝对(质粒标准曲线法)或相对定量(内参法)检测。相比检测单一受体或配体,可以为相应的研究提供更加系统和全面的资料。本研究通过引物的筛选和qPCR反应条件的优化,保证了建立的方法具有灵敏度高、特异性强、检测基因的线性浓度范围广、重复性好、操作简便及省时等优点。
应用该方法检测新城疫油乳剂灭活疫苗免疫后鸡体天然免疫系统的反应,表明疫苗可有效地激活Ch-MDA5、Ch-TLR3和Ch-TLR7,以及其相应的配体MAVS、TRIF和MyD88,从而启动天然免疫信号通路信号的传导。本研究仅列举了所建立的qPCR方法在鸡外周血淋巴细胞中相应基因检测中的应用。除此之外,本实验室还使用建立的qPCR方法测定了经疫苗免疫或免疫增强剂刺激后,鸡脾脏淋巴细胞以及鸡胚尿囊液样品中相应基因表达水平的变化(另文发表),初步表明所建立的qPCR方法不仅可用于鸡外周血淋巴细胞样品的检测,也可用于鸡脾脏淋巴细胞以及鸡胚尿囊液样品的检测。在后续的研究中会继续积累相关研究数据,从而更客观的评价所建立的qPCR方法用于多种样品检测的实际应用效果。
本研究所建立的系列qPCR方法,可用于检测病毒感染或者疫苗、药物作用后,鸡体固有免疫系统的应答变化,从而有助于阐明病毒的致病机制,在鸡用新型疫苗、免疫增强剂以及抗病毒药物的研究与开发中发挥作用。
参考文献:
[1]Karpala A J,Stewart C,Mckay J,et al.Characterization of chicken Mda5 activity:regulation of IFN-beta in the absence of RIG-I functionality[J].J Immunol,2011,186(9):5397-5405.
[2]Schwarz H,Schneider K,Ohnemus A,et al.Chicken Toll-like receptor 3 recognizes its cognate ligand when ectopically expressed in human cells[J].J Interferon Cytokine Res,2007,27(2):97-101.
[3]Philbin V J,Iqbal M,Boyd Y,et al.Identification and characterization of a functional,alternatively spliced Toll-like receptor 7 (TLR7) and genomic disruption of TLR8 in chickens[J].Immunology,2005,114(4):507-521.
[4]Kato H,Takeuchi O,Mikamo-Satoh E,et al.Length-dependent recognition of double-stranded ribonucleic acids by retinoic acid-inducible gene-I and melanoma differentiation-associated gene 5[J].J Exp Med,2008,205(7):1601-1610.
[5]Boukhvalova M S,Sotomayor T B,Point R C,et al.Activation of interferon response through Toll-like receptor 3 impacts viral pathogenesis and pulmonary Toll-like receptor expression during respiratory syncytial virus and influenza infections in the cotton ratSigmodonhispidusmodel[J].J Interferon Cytokine Res,2010,30(4):229-242.
[6]Weber M,Weber F.RIG-I-like receptors and negative-strand RNA viruses:RLRly bird catches some worms[J].Cytokine Growth Factor Rev,2014,25(5):621-628.
[7]O'neill L A,Bowie A G.Sensing and signaling in antiviral innate immunity[J].Curr Biol,2010,20(7):R328-333.
[8]Saunders N A.Real-time PCR[J].Meth Mol Biol,2004,266:191-211.
[9]Huang Z,Fang D,Lv P,et al.Differential cellular immune responses between chickens and ducks to H9N2 avian influenza virus infection[J].Vet Immunol Immunopathol,2012,150(3-4):169-180.
[10]Schmittgen T D,Livak K J.Analyzing real-time PCR data by the comparative C(T) method[J].Nat Protoc,2008,3(6):1101-1108.
[11]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
Development and Application of Quantitative PCR Assay for Detection of Three Innate Immunity-related Cellular Receptors and Ligands in Chickens
HUANG Yan-yan1,2,GAO Dan-dan3,XU Chuan-tian1,2, ZHU Man-ling1,2,YANG Shao-hua1,2,HUANG Qing-hua1,2,ZHANG Lin1,2,ZHANG Xiu-mei1,2,WU Jia-qiang1,2
(1.InstituteofAnimalHusbandryandVeterinaryMedicine,ShandongAcademyofAgriculturalSciences,Jinan,Shandong,250100,China;2.ShandongKeyLaboratoryofAnimalDiseaseControlandBreeding,Jinan,Shandong,250100,China;
3.CollegeofAnimalScienceandTechnology,ShandongAgriculturalUniversity,Tai'anShandong,271018,China)
Abstract:The main purpose of this study is to establish quantitative PCR (qPCR) for the detection of three pattern recognition receptors (chicken Toll-like receptor 3,Toll-like receptor 7,and melanoma differentiation-associated protein 5) and their respective ligands (TRIF,MyD88 and MAVS) in chickens.We designed and screened PCR primers for the 6 genes.Specific PCR products of the genes were utilized to construct recombinant plasmids,which served as template standards to establish standard curves for the assays.The assays developed in this study were sensitive,specific and could stably detect related genes of wide concentration ranges.Further,the assays were applied in the analysis of related gene expression in specific-pathogen-free (SPF) chickens after immunization with oil-emulsion vaccine against Newcastle disease virus.The up-regulations of expression of all 6 genes were peeked at six hours post vaccination, and at the same time,the mRNA level of IFN-β increased to 252 times.This indicated the efficacy of innate immunity signaling after vaccination.In conclusion,the qPCR developed in this study may be applied in viral pathogenesis research,and novel vaccine,immnopotentiator and anti-viral drug development.
Key words:chicken;innate immunity;receptor and ligand;detection;quantitative PCR
文章编号:1007-5038(2016)04-0012-06
中图分类号:S852.42
文献标识码:A
作者简介:黄艳艳(1977-),女,山东肥城人,助理研究员,博士,主要从事动物病毒学与免疫学研究。*通讯作者
基金项目:山东省畜禽疫病防治与繁育重点实验室主任基金项目(2015SYSZR04);十二五国家科技支撑计划项目(2015BAD12B03);公益性行业(农业)科研专项(201303033);现代农业产业技术体系建设专项资金(CARS-42-Z12)
收稿日期:2015-08-19

