质子泵抑制剂引发小肠细菌过度生长的风险及症状评估
450003 新乡医学院附属郑州人民医院消化科 郑州消化疾病研究所
·临床研究·
质子泵抑制剂引发小肠细菌过度生长的风险及症状评估
高晓魏新朋马英杰韩际奥韩丽杨丽秦宝山
450003新乡医学院附属郑州人民医院消化科郑州消化疾病研究所
质子泵抑制剂(PPI)因其强大的抑酸作用及低毒性的特点,被广泛应用于酸相关性疾病的临床治疗及预防非类固醇类抗炎药相关的胃肠出血风险防范,产生了良好效果。但随着临床应用的日益广泛以及对其药物特性和安全性的进一步认识,其可能的潜在风险也受到了关注。本研究对长期服用PPI是否会增加小肠细菌过度生长(SIBO)的风险进行观察研究,报道如下。
1资料与方法
1.1研究对象
观察组选取2013年6月至2014年6月在郑州人民医院消化科就诊需要服用常规剂量PPI的患者(包括胃食管反流病、长期与非类固醇类抗炎药联合用药的心脑血管疾病患者)38例,其中男20例、女18例,年龄31~78岁,平均年龄(42.25±10.81)岁。38例服用PPI疗程均达8周以上(短疗程);其中21例持续用药24周以上(长疗程),其中男12例、女9例,年龄40~69岁,平均年龄(44.2±8.95)岁。对照组为20位同期该院消化科健康体检志愿者,其中男10例、女10例,年龄29~73岁,平均年龄(39.5±11.85)岁。两组的年龄、性别差异均无统计学意义(P>0.05),具有可比性。
观察组和对照组在入选前8周内均未使用过任何抗生素、微生态制剂及胃肠动力调节药,既往均无胃肠道及腹部手术史。试验过程中观察组仅服用PPI制剂或与非类固醇类抗炎药联合应用,对照组患者不使用任何药物。观察对象每例检测2~3次,分别是试验开始(0周)、8周、24周。所有试验对象均签署知情同意书。
1.2主要仪器及试剂
气体检测设备为英国Bedfont公司生产的Gastrolyze,型号为EC60 Gastrolyzer,氢气(H2)浓度以百万分率表示,检测范围为0~500×10-6,灵敏度为1×10-6,精度为±5%。连接仪器的为新型D型接口。底物为荷兰苏威制药公司生产的乳果糖口服液(商品名为杜密克)。
1.3检测方法
1.3.1试验前的准备要求 (1)试验前1天禁食牛奶等乳制品,豆腐、豆浆等豆制品,粗纤维食物以及葱、姜、辣椒等辛辣刺激性食物,要求患者晚餐以淀粉类食物为主,辅以少量蛋白质。(2)患者前1天晚餐至第2天接受检查之间的空腹时间约14 h,可饮用白水,禁止饮用其他饮料。(3)晨起排便,刷牙后服温水1杯(约200 mL)以恢复肠蠕动。(4)试验前2 h及试验中不得吸烟和剧烈运动。(5)试验中密切观察患者有无头晕及胃肠道反应等不适,若有不适症状,立即停止检测。1.3.2检测过程检测时,将D型接口与呼气仪相连,并行校准工作,校准无误后患者先进行基础呼气的H2浓度检测,之后服乳果糖10 g及温水250 mL。自口服乳果糖的时间点算起,每隔15 min让患者对准D型接口吹气,连续检测至少2 h。吹气时尽可能保证每次均匀缓慢呼出,且每次胸廓扩张程度尽可能保持一致,如此重复9次。
1.4评估标准
正常情况下乳果糖不被小肠水解吸收,口服乳果糖在抵达结肠后才被细菌酵解产生H2,当SIBO存在时部分乳果糖被小肠内过度生长的细菌酵解产生H2,另一部分进入结肠酵解产生H2。本实验规定H2浓度的本底值为0~12×10-6。SIBO的判断标准为:(1)空腹(基础)及间隔30 min检测呼气中H2浓度均>12×10-6;(2)双峰图形,第一峰出现在服用乳果糖后90 min内,H2浓度的增值至少12×10-6,第二峰H2浓度的增值至少20×10-6;(3)曲线无波峰波谷持续,但60 min以内出现高于基础呼气中H2浓度12×10-6的数值,且随着时间的推移,数值持续升高,直至结肠峰的出现。
1.5胃肠症状评估
记录服用PPI组患者呼气检查时的消化道症状,胃肠症状评估(GSRS)采用自评表形式。主要针对SIBO有关症状进行评估,包括腹痛、腹胀、腹泻、便秘。评分范围为0~6分:0分为无症状,1分为轻微症状,2分为轻度症状,3分为中等症状,4分为中等偏重症状,5分为严重症状,6分为非常严重症状。
1.6统计学分析
2结果
2.1PPI与SIBO发生的相关性
开始时观察组38例中有5例SIBO阳性(阳性率13.15%),对照组20例中SIBO阳性2例(阳性率10%),两组差异无统计学意义(χ2=0,P=1)。8周、24周后观察组SIBO阳性率分别为42.10%(16/38)、71.42%(15/21),对照组SIBO阳性率分别为15%(3/20)、10%(2/20),两组在8周(χ2=4.370,P<0.05)、24周(χ2=15.926,P<0.001)的差异有统计学意义。观察组用Spearman等级相关分析用药时间与SIBO阳性率的相关性:rs=1.000,P<0.001,即PPI使用时间长短与SIBO阳性率呈正相关。两组0、8、24周时SIBO阳性率及乳果糖氢呼气试验(LHBT)各时间点的检测均值,见表1。
2.2观察组的GSRS评估
观察组0、8、24周GSRS平均总分分别是(8.1±2.1)(n=38)、(4.9±1.2)(n=38)、(2.5±0.7)(n=21),3个时间点比较显示分值显著下降(t=8.156、9.699、14.996,P<0.05)。观察组中有无SIBO组比较,发生SIBO者腹胀、腹泻评分明显高于无SIBO者(P<0.05),提示长期PPI治疗。腹胀、腹泻的GSRS与SIBO发生有关联性。见表2。
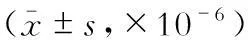
表1 两组各时间点检测均值
注:观察组内分别与0周比较,aP<0.05;观察组与对照组对应时间比较,bP<0.05
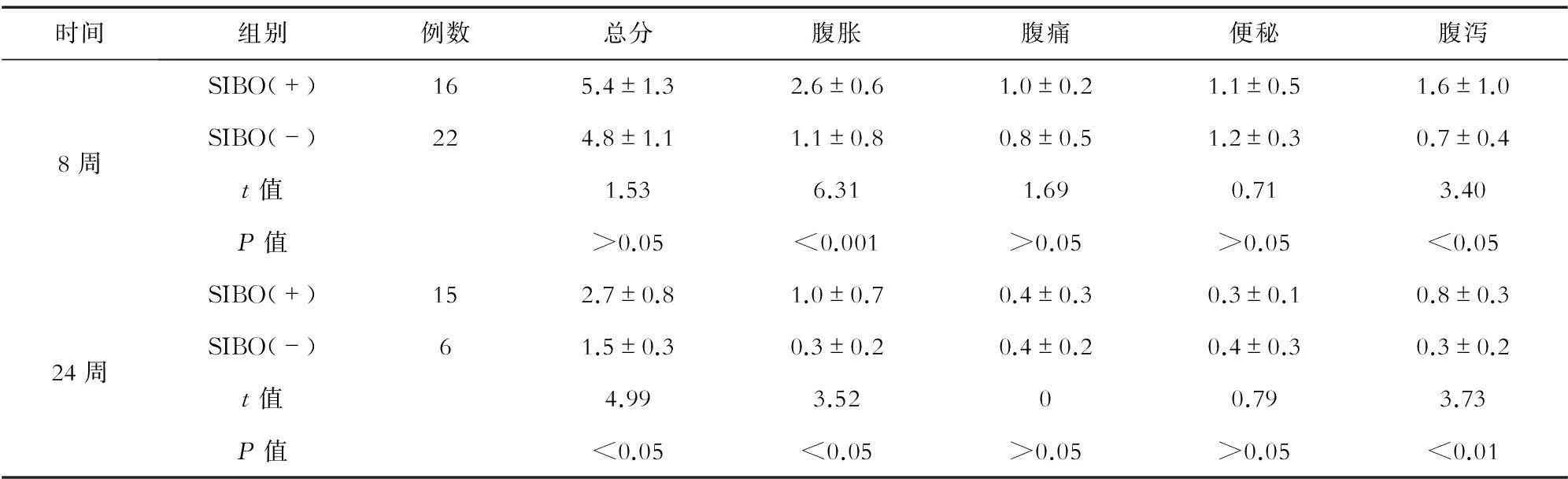
表2 观察组中有无SIBO组的GSRS评估
3讨论
人体肠道内栖息着大量微生物,这个包括细菌、真菌及其他微生物体的肠道微生态系统与宿主产生物质流、能量流及基因流,形成了共生关系,是人体内环境中不可缺少的组成部分。肠道微生物的数量、种类、栖息部位与人体健康密切相关。消化道细菌主要位于末端回肠和结肠,而胃、十二指肠、空肠及近端回肠等部位极少,且主要为革兰阳性需氧菌[1]。当宿主及外环境影响使肠道菌群的种类、数量及活性发生异常或定位转移时,可使宿主患病。
正常小肠肠道菌群受到胃酸、胆酸、胆盐、胃肠道的节律运动、黏膜分泌、黏液流动、肠腔电位等调节,仅有极少量的革兰阴性厌氧菌存在并维持着小肠生态的相对稳定[2]。这些防御因素的变化均会导致小肠肠道菌群结构和数量改变。SIBO以近端小肠细菌过度生长(主要为革兰阴性需氧菌和厌氧菌)相关的营养吸收不良为特征,这与肠腔内细菌与宿主之间的营养竞争有关,而肠腔内细菌分解营养物质产生有毒代谢产物,进而损伤肠上皮细胞,随之出现腹胀、腹痛、腹泻、恶心、体质量下降等一系列临床症状,通常发生于胃肠动力障碍、慢性胰腺炎、肝硬化等的老年患者[3]。引起SIBO的病因较多,成人被报道较多的病因有胃酸减少或胃酸缺乏症、小肠动力障碍、肠道免疫屏障破坏、回盲瓣功能不全、胰腺疾病等[4-6]。目前诊断SIBO有多种方式,氢呼气试验(HBT)由于具有安全、无创、无污染及敏感性高等优势,故被普遍采用[7]。
PPI强效抑酸导致的胃酸分泌低下可能引起的不良反应受到关注。Husebye等[8]的研究发现,小肠内pH升高1相当于小肠内微生物数量增加了13.8% 。目前对PPI治疗引起SIBO的可能性、可能发病的时间、患病概率等问题还了解得较少,对其进行深入探讨十分重要。Ratuapli等[9]对566例服用 PPI的患者进行葡萄糖氢呼气试验(GHBT),发现服用PPI组的SIBO阳性率与未服药组的SIBO阳性率差异无统计学意义,但并未将PPI的使用时间纳入。Lombardo等[10]的研究发现长期服用PPI制剂的患者的SIBO患病率为50%。Lo等[11]对有关PPI的使用与SIBO的关系进行Meta分析,结果提示使用PPI的患者患SIBO的合并危险度是未使用PPI患者的2.282倍。国内研究认为PPI的使用时间与SIBO阳性率呈正相关[12-13]。
目前对于PPI长期应用能否引发SIBO风险仍有争议,对于发生SIBO的机制仍不清楚。有研究表明,PPI在体外表现出对中性粒细胞功能的损害,会降低其对内皮细胞的黏附能力[14]。推测PPI导致的胃酸分泌低下及对宿主防御能力的影响可能是增加SIBO风险的主要原因。
本研究采用LHBT检测服用PPI制剂的患者的SIBO情况,结果发现服用PPI制剂8周后SIBO阳性率为42.10%,服药24周后SIBO阳性率为71.42%,而对照组对应的SIBO阳性率分别为15%、10%。说明SIBO在PPI制剂服用人群中有较高的发生率,且随着服药时间的延长,SIBO的阳性率有逐渐上升的趋势。由于各种临床症状的重叠,与PPI使用相关的SIBO常被忽视。本研究中,研究对象的主要症状(腹痛、腹胀、腹泻、便秘)的GSRS评估显示,观察组中有无SIBO组间的GSRP存在差异,其中腹胀、腹泻评分增加明显,提示长期PPI治疗使得腹胀、腹泻出现或加重,应注意SIBO发生的可能性。
有文献报道对症状轻微的SIBO患者,给予限制碳水化合物的膳食,增加脂肪、矿物质和维生素,相关症状可缓解。对于症状明显者,推荐1~2周标准剂量的抗生素治疗(如利福昔明、左氧氟沙星等),或1个短疗程的抗生素治疗后给予益生菌治疗[15-17]。但对于在PPI使用过程中出现的SIBO,是否需要停用PPI或与抗生素、微生态制剂联合使用,仍需进一步研究。
参考文献
1 Bures J, Cyrany J, Kohoutova D, et al. Small intestinal bacterial overgrowth syndrome[J]. World J Gastroenterol, 2010, 16: 2978-2990.
2 Hao WL, Lee YK. Microflora of the gastrointestinal tract: a review[J]. Methods Mol Biol, 2004, 268: 491-502.
3 Rana SV, Bhardwaj SB. Small intestinal bacterial overgrowth[J]. Scand J Gastroenterol, 2008, 43: 1030-1037.
4 Mackie RI, Sghir A, Gaskins HR. Developmental microbial ecology of the neonatal gastrointestinal tract[J]. Am J Clin Nutr, 1999, 69: 1035S-1045S.
5 Pitchumoni CS, Dharmarajan TS. Small intestinal bacterial overgrowth syndrome // Pitchumoni CS, Dharmarajan TS. Geriatric Gastroenterology[M]. New York: Springer, 2012: 457-462.
6 Gasbarrini A, Lauritano EC, Gabrielli M, et al. Small intestinal bacterial overgrowth: diagnosis and treatment[J]. Dig Dis, 2007, 25: 237-240.
7 Khoshini R, Dai SC, Lezcano S, et al. A systematic review of diagnostic tests for small intestinal bacterial overgrowth[J]. Dig Dis Sci, 2008, 53: 1443-1454.
8 Husebye E, Hellström PM, Sundler F, et al. Influence of microbial species on small intestinal myoelectric activity and transit in germ-free rats[J]. Am J Physiol Gastrointest Liver Physiol, 2001, 280: G368-G380.
9 Ratuapli S, Ellington T, O′Neill M, et al. Proton pump inhibitor therapy use does not predispose to small intestinal bacterial overgrowth[J]. Am J Gastroenterol, 2012, 107: 730-735.
10 Lombardo L, Foti M, Ruggia O, et al. Increased incidence of small intestinal bacterial overgrowth during proton pump inhibitor therapy[J]. Clin Gastroenterol Hepatol, 2010, 8: 504-508.
11 Lo WK, Chan WW. Proton pump inhibitor use and the risk of small intestinal bacterial overgrowth: a meta-analysis[J]. Clin Gastroenterol Hepatol, 2013, 11: 483-490.
12 宋明伟, 姜葵. 质子泵抑制剂与小肠细菌过生长关系的研究[J]. 天津医科大学学报, 2014, 20: 445-447, 458.
13 金玲肖, 刘福, 龙惠珍, 等. 应用质子菜抑制剂导致小肠细菌过度生长发生的可能性[J]. 中国微生态学杂志, 2010, 22: 1113-1114.
14 Yoshida N, Yoshikawa T, Tanaka Y, et al. A new mechanism foranti-inflammatory actions of proton pump inhibitors-inhibitoryeffects on neutrophil-endothelial cell interactions[J]. Aliment Pharmacol Ther, 2000, 14(Suppl 1): S74-S81.
15 Rosania R, Giorgio F, Principi M, et al. Effect of probiotic or prebiotic supplementation on antibiotic therapy in the small intestinal bacterial overgrowth: a comparative evaluation[J]. Curr Clin Pharmacol, 2013, 8: 169-172.
16 Hamvas J. Proton pump inhibitor therapy and small bowel bacterial contamination[J]. Orv Hetil, 2012, 153: 1287-1293.
17 Lauritano EC, Gabrielli M, Scarpellini E, et al. Antibiotic therapy in small intestinal bacterial overgrowth: rifaximin versus metronidazole[J]. Eur Rev Med Pharmacol Sci, 2009, 13: 111-116.
(本文编辑:林磊)
(收稿日期:2015-05-12)
通信作者:马英杰,Email: mayingjie19@sina.com
基金项目:郑州市科技项目(CZSYJJ13015)
DOI:10.3969/j.issn.1673-534X.2016.01.017

