HSP70抑制剂PFTμ对干扰素γ诱导的iNOS表达的研究
袁小媚,雷 寒,夏 勇
(1.四川省人民医院心血管科,四川成都 621000;2.重庆医科大学附属第一医院心内科,重庆 400016;3.美国俄亥俄州立大学医学中心Davis心肺研究所,美国 43210)
HSP70抑制剂PFTμ对干扰素γ诱导的iNOS表达的研究
袁小媚1,2,3,雷 寒2,夏 勇3
(1.四川省人民医院心血管科,四川成都 621000;2.重庆医科大学附属第一医院心内科,重庆 400016;3.美国俄亥俄州立大学医学中心Davis心肺研究所,美国 43210)
目的 观察热休克蛋白70抑制剂PFTμ对干扰素γ (IFN-γ)诱导的RAW 264.7细胞一氧化氮(NO)的生成及诱生型一氧化氮合酶(iNOS)表达的作用。方法 采用IFN-γ诱导的RAW 264.7细胞株建立细胞炎症反应模型,采用Griess试剂法测定细胞NO释放量;采用Western blot法测定相应目的蛋白的表达;采用反转录聚合酶链反应(RT-PCR)分析iNOS mRNA表达的变化。建立小鼠心脏缺血/再灌注(I/R)模型,分为对照组和给药组,测定小鼠心肌梗死面积的变化。结果 PFTμ可抑制IFN-γ诱导的RAW264.7细胞NO的生成、iNOS蛋白及mRNA表达。其作用机制可能是通过部分抑制RAW264.7细胞核内的IRF-1蛋白表达。PFTμ可减少缺血/再灌注小鼠心脏梗死面积(P<0.05)。结论PFTμ可通过部分抑制细胞核内IRF-1蛋白表达而发挥抗炎症反应的作用。
热休克蛋白;干扰素γ;一氧化氮;诱生型一氧化氮合酶;PFTμ;缺血/再灌注损伤
巨噬细胞在外部细菌毒素如干扰素γ(IFN-γ)等刺激时,可促使炎症介质如一氧化氮(NO)等的分泌,这被广泛应用于研究炎症反应。Pifithrin-μ (PFTμ)是近期新报道的一种小分子,它是一种热休克蛋白70(HSP70)抑制剂,能够选择性抑制HSP70的蛋白质功能[1]。因此,本研究以IFN-γ诱导RAW264.7细胞为反应模型,拟探讨HSP70抑制剂PFTμ在炎症反应中的作用及其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂 IFN-γ、TRIzol提取试剂盒等购于Sigma公司,PFTμ购于CalBiochem公司,iNOS购于BD公司。DMEM培养基、Griess Reagent试剂盒、反转录聚合酶链反应试剂盒等购于Invitrogen公司,胎牛血清购于Gibco公司。蛋白浓度测量试剂购于Bio-Rad公司。
1.1.2 细胞与实验动物及其分组 RAW 264.7小鼠巨噬细胞和♂C57BL/6小鼠(20~30 g)由美国俄亥俄州立大学医学中心实验动物中心提供。细胞实验分组:给药组中加入PFTμ(终浓度20 μmol· L-1)预处理15 min后,再加入IFN-γ(终浓度2 mg ·L-1),对照组中加入等量DMSO预处理相同时间后,再加入同等IFN-γ。实验重复至少3次。C57BL/6♂小鼠随机分为2组:对照组10只,给药组(PFTμ 40 mg·kg-1,溶于DMSO腹腔注射)10只。
1.2 方法
1.2.1 一氧化氮测定 根据Griess Reagent试剂盒说明书,将300 μL溶液[20 μL Griess试剂、150 μL细胞培养液(对照组和给药组)、130 μL去离子水]混合于96孔板的孔中,20 μL Griess试剂加280 μL去离子水作为空白对照。室温下放置30 min后,用分光光度仪测量每孔混合液的吸光度(波长548 nm),并校正曲线。
1.2.2 Western blot测定 用PBS液收集RAW 264.7细胞,3 000~3 500 r·min-1室温下离心3~5 min,根据沉淀大小加入细胞裂解液(RIPA 89%,PIC 10%,EDTA 1%),置于冰上30 min,再12 000 r ·min-14℃离心15 min。将上清液转至新管后,取其中5 μL测定蛋白浓度,根据浓度计算配比等质量的样品,99℃5 min蛋白变性。150 V,1.5%胶电泳1 h,醋酸纸浸入转膜液15 min。15 V、35 min(一块胶)~45 min(两块胶)转膜。5%脱脂牛奶室温下孵育1 h,TBST洗3次,加入一抗4℃过夜。TBST再洗3次,加入二抗(1%脱脂牛奶稀释1∶5 000),室温下孵育1h,TBST洗3次,室温下显影液孵育5 min,暗室显影。
1.2.3 RT-PCR 总RNA按照TRIzol抽提试剂说明书进行。取8 μL做凝胶电泳,其余置-80℃保存备用。PCR反应体系条件如下:预变性94℃30 s,变性94℃30 s,退火60℃30 s,延伸72℃1 min,25个循环,最后延伸72℃7min。结束后,反应产物经1%琼脂糖凝胶电泳(95V,30 min)鉴定,用凝胶成像仪进行灰度扫描分析。
1.2.4 细胞核提取 用PBS液收集细胞后3 000 r ·min-1,5 min,4℃离心,加入250~500 μL低渗缓冲液,冰上放置20 min(10 mmol·L-1Tris-HCl,pH 7.5,10 mmol·L-1NaCl,1.5 mmol·L-1MgCl2),均匀匀浆20次;3 000 r·min-1,5 min,4℃离心,吸走上清液;每管加入0.5 mL低渗缓冲液,轻轻混合沉淀,再离心,反复2次;每管再加入RIPA 50~80 μL冰上放置30 min,测细胞蛋白浓度配样本。
1.2.5 小鼠I/R模型的建立及梗死面积的测定实验分组见“1.1.2”,建立小鼠I/R模型。结扎心脏左冠状动脉前降支1 h,再灌注24 h后,取小鼠心脏标本PBS清洗,扎紧冠状动脉左前降支,由主动脉推入1%Evan-Blue液2~3 mL,-20℃冰冻30 min后,将心脏从心尖到心基底部平行切成2 mm厚度的小片,置于1.5%氯化三苯基四氮唑(TTC)37℃孵育10~30 min,染色后,置于10%甲醛中固定,可见梗死区呈现白色,再灌注区呈现红色,正常心肌组织区呈现蓝色。照相并软件分析计算出缺血危险区(AAR)和梗死区(IS)的面积,用每张切片重量计算百分比,心肌梗死程度以IS/AAR来表示。
1.2.6 统计学处理 采用SPSS 10.0统计软件对数据进行配对资料t检验。
2 结果
2.1 PFTμ不同时间对IFN-γ诱导的RAW264.7细胞释放一氧化氮的影响 结果显示,0~4 h,PFTμ组、对照组中NO含量基本无变化;8 h起,IFN-γ组NO含量开始上升,与对照组比较差异有显著性(P<0.05);随着时间延长,IFN-γ组释放的NO量继续增加,在8~12 h间升高幅度最大。PFTμ组与IFN-γ组走势相似,但NO含量要明显低于IFN-γ组,两组比较差异有显著性(P<0.05)。这表明在0~12 h之间,PFTμ呈现时间依赖性地降低IFN-γ诱导的RAW264.7细胞释放一氧化氮(Fig 1)。
2.2 PFTμ不同时间对IFN-γ诱导的RAW264.7细胞iNOS蛋白表达的影响 结果显示,0~4 h,PFTμ组、对照组中iNOS蛋白表达基本无变化;在8 h时,IFN-γ开始诱导RAW264.7细胞大量表达iN-OS蛋白,8~12 h之间iNOS蛋白表达逐渐增多。而PFTμ组8~12 h之间无iNOS蛋白表达,提示PFTμ(终浓度20 μmol·L-1)能明显抑制IFN-γ诱导的iNOS蛋白表达。这表明在0~12 h之间,PFTμ呈现时间依赖性地抑制IFN-γ诱导的RAW264.7细胞iNOS蛋白表达(Fig 2)。
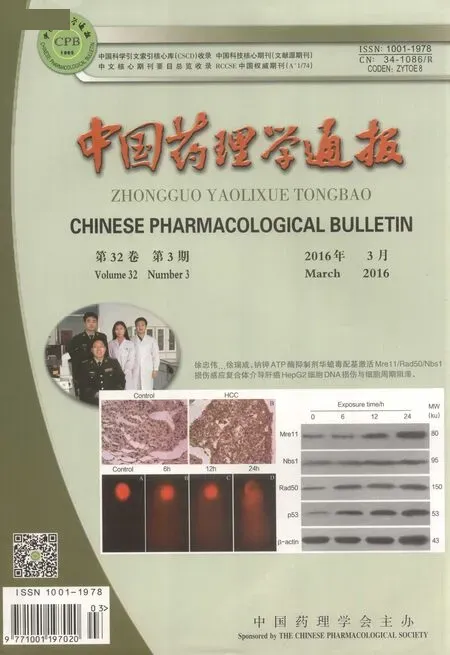
2.3 PFTμ不同时间对IFN-γ诱导的RAW264.7细胞iNOS mRNA的影响 结果显示,0~4 h,PFTμ组、对照组中iNOS mRNA表达基本无变化;4 ~8 h时,IFN-γ开始诱导RAW264.7细胞大量表达iNOS mRNA,而PFTμ组iNOS mRNA无表达,提示PFTμ(终浓度20 μmol·L-1)能明显抑制IFN-γ诱导iNOS mRNA表达。这表明在0~8 h之间,PFTμ呈现时间依赖性地降低IFN-γ诱导的RAW264.7细胞iNOS mRNA的表达(Fig 3)。
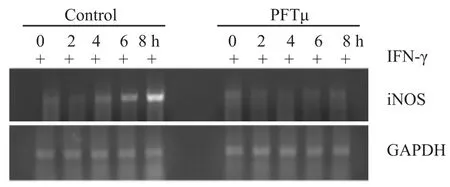
Fig 3 Effect of PFTμ on iNOS mRNA expression in RAW 264.7 cells induced by IFN-γ
2.4 PFTμ不同时间对IFN-γ诱导的RAW264.7细胞Stat1蛋白表达的影响 结果显示,在0~4 h之间,IFN-γ开始刺激RAW264.7细胞磷酸化Stat1 (Ser727Stat1和Tyr701Stat1)蛋白的表达,而PFTμ组磷酸化的Stat1表达无明显变化,提示PFTμ对IFN- γ诱导的Stat1蛋白表达无明显影响。这表明在0~4 h之间,PFTμ没有通过抑制Stat1蛋白表达而发挥抑制iNOS表达的作用(Fig 4)。
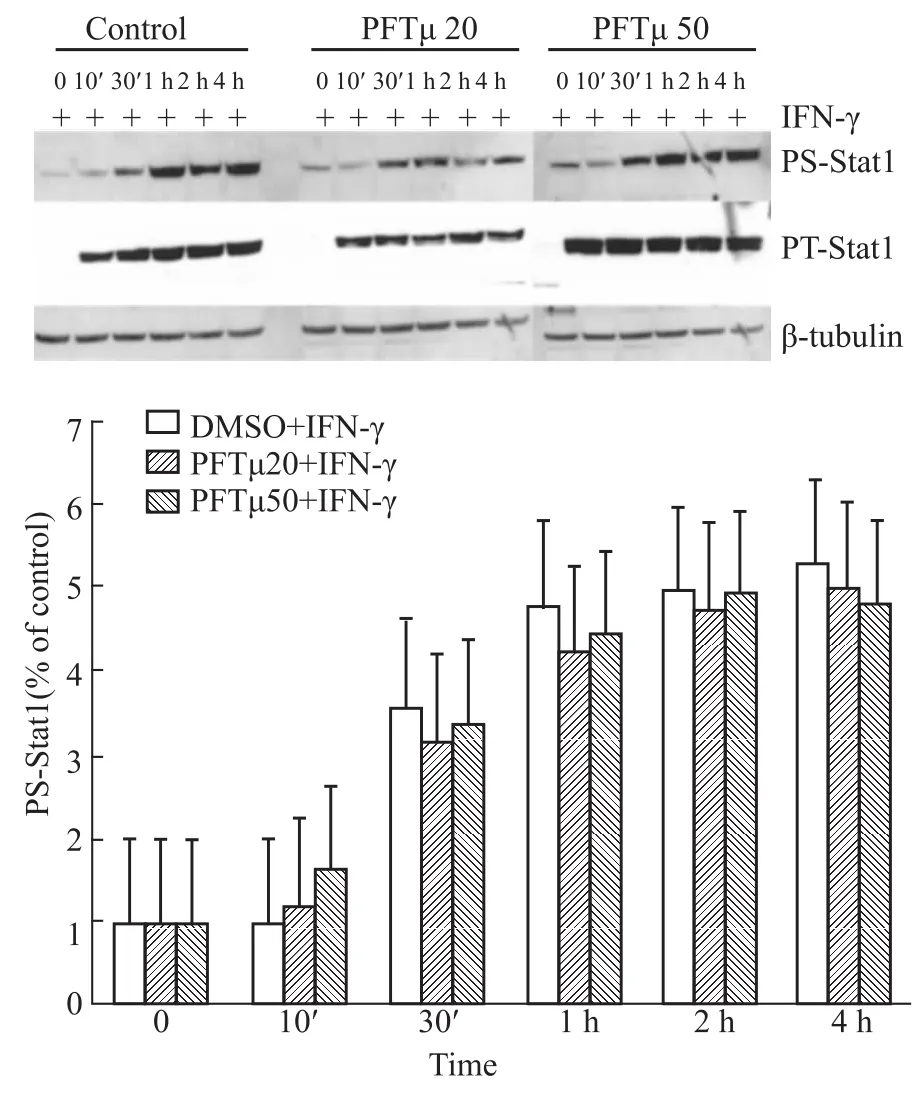
Fig 4 Effect of PFTμ pretreatment on IFN-γ-induced phosphorylated-Stat1 activation in RAW264.7 cells
2.5 PFTμ对IFN-γ诱导的RAW264.7细胞核IRF-1蛋白表达的影响 结果显示,空白组细胞核有少量IRF-1蛋白表达,IFN-γ组细胞核IRF-1蛋白表达增加,而PFTμ组IRF-1蛋白表达明显减少(P <0.05),提示PFTμ对IFN-γ诱导的细胞核内IRF-1蛋白表达有抑制作用。这表明早期PFTμ通过部分抑制细胞核内IRF-1蛋白表达而发挥抑制iNOS表达的作用(Fig 5)。
2.6 PFTμ对小鼠I/R心肌梗死面积的影响 结果显示,对照组和给药组比较发现,给药组心肌梗死面积明显小于对照组(P<0.05)。结果提示PFTμ (40 mg·kg-1,腹腔注射)能明显降低I/R小鼠心肌梗死面积(Fig 6)。
3 讨论
热休克蛋白70功能较多,与细胞耐热性的产生有关,是主要伴侣蛋白之一,并可能是机体衰老或细胞老化的一个重要因素等等,因而成为热休克蛋白中关注最广、研究最深的一种。本实验我们选择以一氧化氮为靶点分子,研究热休克蛋白70抑制剂PFTμ在炎症作用中的作用及其分子机制,关于这一研究内容国内外文献报道较少。NO的大量生成与炎症反应密切相关,它是一种具有生物活性的气体分子,是细胞间信息传递的重要调节因子,具有介导细胞免疫和炎症毒性的功能。在活化的巨噬细胞中,iNOS水平对一氧化氮的产生起到关键的作用。调节一氧化氮生成或诱生型一氧化氮合酶表达可能是治疗炎症反应的重要靶点[2]。
Fig 5 Western blot analysis of IRF-1 protein from nuclear extracts in RAW 264.7 cells

Fig 6 Mouse experiment
PFTμ是最近报道的一种小分子,在抑制癌症反应方面有着明显的作用,能选择性地与压力诱导的热休克蛋白70相互影响,并抑制其功能。iNOS在生理情况下表达量很少,但在一系列炎症因子的刺激下,可发生iNOS的基因转录和蛋白质的表达。合成的一氧化氮不仅直接导致细胞损伤,同时加重炎症反应[3]。热休克蛋白70对心肌细胞损伤的保护作用引起了国内外心血管界的高度重视[4]。有研究报道[5]发现,缺血预处理的保护作用不是热休克蛋白产生,其主要作用是由一氧化氮产生。同时,大量研究表明[6-9],缺血预处理的发生是由iNOS途径介导的。我们研究报道首次发现,PFTμ对IFN-γ诱导的RAW264.7细胞NO的释放呈现时间依赖性的抑制作用,同时对IFN-γ诱导的iNOS蛋白及mR-NA的表达呈现时间依赖性的抑制作用,从而我们推测,PFTμ对RAW264.7细胞NO的影响与改变iNOS表达量的变化有关。
大量研究报道表明[10-13],与IFN-γ密切相关的信号转导通路有几条,最主要的是JAK-Stat1信号通路,其主要的下游蛋白是磷酸化的Stat1,而PFTμ与多条信号转导通路有关联[1]。本实验首次研究发现,在0~4 h之间,PFTμ没有通过抑制RAW264.7细胞中Stat1蛋白的表达而发挥抑制iN-OS表达的作用,从而推测PFTμ抑制RAW264.7细胞中IFN-γ诱导的iNOS表达的作用机制与JAK-Stat1通路无关,这在国内外尚未见文献报道。IRF-1(interferon regulatory factor 1)在IFN-γ刺激的iN-OS转录过程中发挥着重要的作用。有报道显示,IRF-1介导IFN-γ诱导的iNOS表达,而IRF-1缺失小鼠不能诱导iNOS表达[14-16]。我们研究发现,PFTμ对IFN-γ诱导的RAW264.7细胞核内IRF-1蛋白表达有抑制作用。这表明早期PFTμ通过部分抑制细胞核内IRF-1蛋白表达而发挥抑制iNOS表达的作用。
缺血/再灌注损伤是最常见的炎症反应。本实验发现,PFTμ作为HSP70的选择性抑制剂,明显降低了I/R小鼠的心肌梗死面积,提示PFTμ对心脏具有一定的保护作用。有研究报道[5],缺血预处理的保护作用不是由HSP产生的,其主要作用是由NO产生的。同时,大量研究表明,缺血预处理的发生是由iNOS途径介导的,某些药物也可明显抑制IFN-γ诱导iNOS的表达[17]。我们推测,PFTμ可能通过抑制NO的生成和iNOS的表达而发挥作用。
综上所述,我们研究报道发现,HSP70抑制剂PFTμ明显抑制IFN-γ诱导的RAW264.7细胞NO的生成、iNOS蛋白及mRNA的表达,其作用机制可能是通过早期部分抑制RAW264.7细胞核内IRF-1蛋白表达来实现的。这部分研究内容国内外报道少。关于PFTμ更深入的分子生物学作用机制我们正在做大量的工作。
[1] Leu J J,Pimkina J,Frank A,et al.A small molecule inhibitor of inducible heat shock protein 70[J].Mol Cell,2009,36(1):15 -27.
[2] Luo S,Lei H,Qin H,et al.Molecular mechanisms of endothelial NO synthase uncoupling[J].Curr Pharm Des,2014,20(22):3548-53.
[3] Qi W N,Chaiyakit P,Cai Y,et al.NF-kappa-B p65 involves in reperfusion injury and iNOS gene regulation in skeletal muscle [J].Microsurgery,2004,24(4):316-23.
[4] Afzal A R,Mandal K,Nyamweya S,et al.Association of Met439Thr substitution in heat shock protein 70 gene with postop-erative atrial fibrillation and serum HSP70 protein levels[J].Car-diaology,2008,110(1):45-52.
[5] Qian Y Z,Shipley J B,Levasseur J E,et al.Dissociation of heat shock proteins expression with ischemic tolerance by whole body-hyperthermia in rat heart[J].J Mol Cell Cardio,1998,30(6):1163-72.
[6] Zhang L,Liu Q,Yuan X,et al.Requirement of heat shock pro-tein 70 for inducible nitric oxide synthase induction[J].Cell Sig-nal,2013,25(5):1310-7.
[7] Wang T,Xia Y.Inducible nitric oxide synthase aggresome forma-tion is mediated by nitric oxide[J].Biochem Biophys Res Com-mun,2012,426(3):386-9.
[8] Xiao Z,Wang T,Qin H,et al.Endoplasmic reticulum Ca2+re-lease modulates endothelial nitric-oxide synthase via extracellular signal-regulated kinase(ERK)1/2-mediated serine 635 phospho-rylation[J].J Biol Chem,2011,286(22):20100-8.
[9] Luo S,Wang T,Lei H,et al.Obligatory role of heat shock protein 90 in iNOS induction[J].Am J Physiol Cell Physiol,2011,301 (1):C227-33.
[10]Darnell J E,Kerr I M,Stark G R.Jak-STAT pathways and tran-scriptional activation in response to IFNs and other extracellular signaling proteins.Science,1994,264(5164):1415-21.
[11]Ramana C V,Gil M P,Schreiber R D,Stark G R.Stat1-depend-ent andindependent pathways in IFN-γ-dependent signaling [J].Trends Immunol,2002,23(2):96-101.
[12]Meraz M A,White J M,Sheehan K C,et al.Targeted disruption of the Stat1 gene in mice reveals unexpected physiologic specificity in the JAK-STAT signaling pathway[J].Cell,1996,84(3):443 -50.
[13]Durbin J E,Hackenmiller R,Simon M C,et al.Targeted disrup-tion of the mouse Stat1 gene results in compromised innate immu-nity to viral disease[J].Cell,1996,84(3):443-50.
[14]Kamijo R,Harada H,Matsuyama T,et al.Requirement for tran-scription factor IRF-1 in NO synthase induction in macrophages [J].Science,1994,263(5153):1612-5.
[15]Sims S H,Cha Y,Romine M F,et al.A novel interferon-induc-ible domain:structural and functional analysis of the human inter-feron regulatory factor I gene promoter.Mol Cell Biol,1993,13 (1):690-702.
[16]Coccia E M,Stellacci E,Marziali G,et al.IFN-gamma and IL-4 differently regulate inducible NO synthase gene expression through IRF-1 modulation[J].Int Immunol,2000,12(7):977-85.
[17]Chiou W F,Don M J,Liao J F,et al.Psoralidin inhibits LPS-in-duced iNOS expression via repressing Syk-mediated activation of PI3K-IKK-IκB signaling pathways[J].Eur J Pharmacol,2011,650(1):102-9.
Effects of HSP70 inhibitor on expression of iNOS induced by IFN-γ
YUAN Xiao-mei1,2,3,LEI Han2,XIA Yong3
(1.Sichuan Academy of Medical Sciences&Sichuan Provincial People’s Hospital,Chengdu 621000,China;2.Dept of Cardiology,First Affiliated Hospital,Chongqing Medical University,Chongqing 400016,China;3.Davis Heart and Lung Research Institute,Division of Cardiovascular Medicine,Dept of Internal Medicine,the Ohio State University,Columbus,OH 43210,USA)
Aim To research the effects of HSP70 in-hibitor(PFTμ)on the expressions of iNOS induced by IFN-γ in RAW 264.7 cells.Methods The NO con-centration was measured by Griess Kit.The expression of interest protein was measured by Western blot and iNOS mRNA was measured by RT-PCR.Mouse cardi-ac ischemia-reperfusion(I/R)model was established to set up the inflammatory response.These were divid-ed into control and treated groups.The infarct size was monitored on myocardial I/R mice.Results We found that PFTμ significantly blocked the production of NO and the expression of iNOS protein and mRNA in RAW 264.7 cells.The mechanism may be part of the inhibition of nuclear IRF-1 protein expression.We also found that PFTμ reduced the infarct size in myocardial I/R mice(P<0.05).Conclusion These results suggest that PFTμ down-regulates the IFN-γ-induced iNOS transcription through decreasing translocated IRF-1 protein.
HSP;IFN-γ;NO;iNOS;PFTμ;ische-mia-reperfusion injury
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.036.html
10.3969/j.issn.1001-1978.2016.03.018
A
1001-1978(2016)03-0390-05
R-332;R341;R542.202.2;R977.3;R977.6
2015-10-15,
2015-11-16
袁小媚(1981-),女,博士,主治医师,研究方向:冠心病的发病机制,E-mail:yuanxiaomei0903@126.com;雷 寒(1957-),男,博士,教授,博士生导师,研究方向:冠心病的发病机制,通讯作者,E-mail:hanleicq@hotmail.com