草地早熟禾愈伤组织对NaCl胁迫的生理响应
徐海鹏,李慧萍,金小煜,金 宁,牛奎举,马晖玲
(1.甘肃农业大学草业学院草业生态系统教育部重点实验室中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070; 2.甘肃农业大学园艺学院,甘肃兰州 730070)
草地早熟禾愈伤组织对NaCl胁迫的生理响应
徐海鹏1,李慧萍1,金小煜1,金 宁2,牛奎举1,马晖玲1
(1.甘肃农业大学草业学院草业生态系统教育部重点实验室中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070; 2.甘肃农业大学园艺学院,甘肃兰州 730070)
以草地早熟禾(Poa pratensis)午夜Ⅱ号愈伤组织为材料,研究NaCl胁迫对其生长、细胞膜相对透性、游离脯氨酸、丙二醛、可溶性蛋白及抗氧化酶活性的影响。结果表明,低浓度NaCl胁迫对午夜Ⅱ号愈伤组织的生长有促进作用,高浓度NaCl胁迫对愈伤组织生长具有抑制作用,且当NaCl浓度高于1.5%时愈伤组织开始出现褐化的现象;随NaCl浓度的升高,其胁迫程度也随之加强,丙二醛(MDA)和可溶性蛋白含量呈现先升高后降低的趋势,游离脯氨酸(Pro)含量和细胞膜相对透性则呈现出一直增加的趋势;过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性随NaCl胁迫程度的增加呈先升高后降低的趋势,在NaCl浓度为1.5%时酶活性达到最高。研究结果为草地早熟禾愈伤组织耐盐突变体的筛选奠定了基础。
NaCl胁迫;草地早熟禾;愈伤组织;生长;生理生化
草地早熟禾(Poa pratensis)是一种多年生草本植物,禾本科早熟禾属,喜冷凉湿润气候、色美、绿期长、耐践踏、观赏效果好,是我国北方地区广泛应用的冷季型草坪草种[1]。近年来,我国已从国外引进了许多草地早熟禾新品种,但我国北方降水短缺,地表和地下水蒸发较快,且降雨多为碱性,土壤渗透率较大,加之多处于干旱、半干旱地区,土壤灌溉区与非灌溉区均表现出较强的盐渍化问题[2]。高盐度土壤影响草坪草的许多生理和代谢过程,从而影响其正常的生长和发育(草坪草泛斑、生长不良、春季发芽延迟和秋季早衰),降低草坪的利用价值[3]。因此,土壤次生盐渍化问题严重影响着我国北方地区草坪的建植和推广应用,而解决这一问题的一条可行途径就是培育耐盐新品种。
体细胞变异具有变异频率高、育种周期短、成本低、操作难度小、应用范围广、可通过人为施加生物与非生物胁迫选择压来定向筛选突变体、能在保持原品种优良性状不变的情况下有效改善个别不良性状等优点[4-5]。利用体细胞无性系变异研究草坪草耐盐性方向的相对较少,Lu等[6-7]以杂交狗牙根(Cynodon dactylon)愈伤组织为材料,利用盐胁迫处理,从再生植株中筛选抗旱耐盐突变体,发现耐盐变异体的耐盐性与其脯氨酸的增高有直接关系,同时抗氧化酶活性提高。柴明良和王贺飞[8]测定了结楼草(Zoysia japonica)栽培品种Zenith商品种子愈伤和胚性愈伤组织系的耐盐性,并利用盐溶液多次定向筛选,获得了耐盐性较强的体细胞无性系变异植株。贾玉芳等[9]利用10 Gy60Coγ射线辐照沟叶结缕草匍匐茎诱导的胚性愈伤组织,经NaCl的筛选,发现10 Gy60Coγ辐射处理可显著提高胚性愈伤组织对NaCl的抗性,得到了沟叶结缕草(Z.matrella)的耐盐变异体。因此,利用体细胞培养技术可以从植物细胞中筛选出耐盐突变体,达到改良或选育植物新品种的效果。本研究以草地早熟禾午夜Ⅱ号愈伤组织为材料,在细胞水平分析草地早熟禾午夜Ⅱ号愈伤组织对不同NaCl浓度胁迫的生长和生理响应,旨为以后草地早熟禾午夜Ⅱ号愈伤组织耐盐突变体的筛选奠定基础。
1 材料与方法
1.1愈伤组织的获得及胁迫培养
以草地早熟禾午夜Ⅱ号的种子为研究材料,将其按俞玲和马晖玲报道[1]的方法灭菌后接种在MS + 2,4-D (1.0 mg·L-1) + 6-BA (0.3 mg·L-1) +3%蔗糖+ 0.7%琼脂的培养基上诱导产生愈伤组织,50 d后将诱导出的愈伤组织转入继代培养基,继代培养基同诱导培养基,此后每隔20 ~25 d继代一次,每次继代时去掉水渍化和褐化的愈伤组织,继代培养5~6次后,选择较好的愈伤组织(疏松、生长快速且均匀)接种于含不同NaCl浓度(0、0.5%、1.0%、1.5%、2.0%、2.5% )的培养基上,每皿接种20块愈伤组织,每个处理重复5皿,胁迫处理20 d,取样进行相关生长、抗氧化与渗透调节指标的测定。
1.2测定方法
1.2.1愈伤组织生长量的测定 愈伤组织的生长量以相对生长率来计算,草地早熟禾午夜Ⅱ号愈伤组织相对生长率= (盐胁迫20 d后愈伤组织重量-未处理前愈伤组织重量) /未处理前愈伤组织重量×100%。每个处理测量5皿,最终愈伤组织的生长量以每个处理重复测量的平均值表示。
1.2.2生理指标的测定 利用电导仪法测定细胞膜相对透性[10];采用考马斯亮蓝G-250染色法测定可溶性蛋白含量[11];采用茚三酮比色法测定游离脯氨酸含量[11];采用硫代巴比妥酸比色法测定丙二醛含量[12];采用NBT(氮蓝四唑)光化学还原反应法测定超氧化物歧化酶(SOD)活性[13];采用氧化愈创木酚比色法测定过氧化物酶(POD)活性[13];利用紫外分光光度法测定过氧化氢酶(CAT)活性[13]。
1.3数据处理
对所有数据利用Excel 2010统计和整理,单因素方差分析和多重比较利用SPSS 19.0软件,并将结果以平均值和标准误形式表示,最终结果采用Excel 2010制图。
2 结果与分析
2.1 NaCl胁迫对午夜Ⅱ号愈伤组织相对生长率的影响
图1-Ⅰ为对照,图1-Ⅱ、1-Ⅲ和1-Ⅳ分别为NaCl浓度为1.5%、2.0%和2.5%处理20 d后草地早熟禾的愈伤组织,当NaCl浓度高于1.5%时,部分愈伤组织出现褐化现象,且随着浓度的增高,褐化现象越严重。可以看出,不同NaCl浓度胁迫后对午夜Ⅱ号愈伤组织生长状况的影响存在较大的差异(图2),高盐浓度对愈伤组织的生长有显著抑制作用(P<0.05),轻度的盐胁迫对于愈伤组织的生长有促进作用,在NaCl浓度为0.5%时,愈伤组织的相对生长率显著高于其它NaCl浓度(P<0.05),净重效果明显,随着NaCl浓度的提高,愈伤组织生长受抑制程度增加,其生长速率减缓。
婆婆缓和了半天情绪后,对钱海燕说:“燕燕,这段时间你受苦了,妈还老是不理解你。对不起啊。”然后又对周启明说:“儿子,没事的。你不用担心钱,还有我和你爸呢。”那天晚上,一家人哭成一团。

图1 NaCl胁迫下午夜Ⅱ号的愈伤组织Fig.1 Effects of NaCl stress on relative growth rate of MidnightⅡcalli
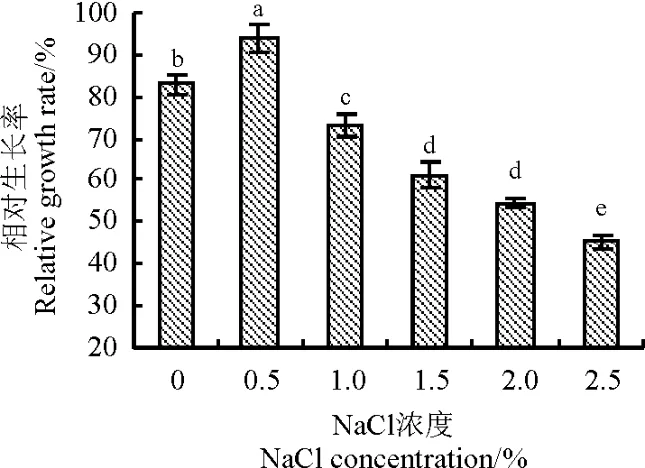
图2 不同浓度NaCl胁迫下午夜Ⅱ号愈伤组织相对生长率的变化Fig.2 Effects of NaCl stress on relative growth rate of MidnightⅡcalli
2.2 NaCl胁迫对午夜Ⅱ号愈伤组织细胞膜透性的影响
电解质外渗率可以反映逆境胁迫下愈伤组织细胞膜透性的增强程度。当NaCl的浓度逐渐升高时,午夜Ⅱ号愈伤组织的细胞膜透性逐渐增大,低浓度胁迫时,细胞膜透性上升趋势比较快,说明低浓度刺激时细胞膜透性表现的较为灵敏,而高浓度下细胞膜透性增长较为缓慢,说明高浓度NaCl胁迫对细胞的伤害率较大,细胞膜透性开始增大,细胞膜的损害程度越来越严重(图3)。
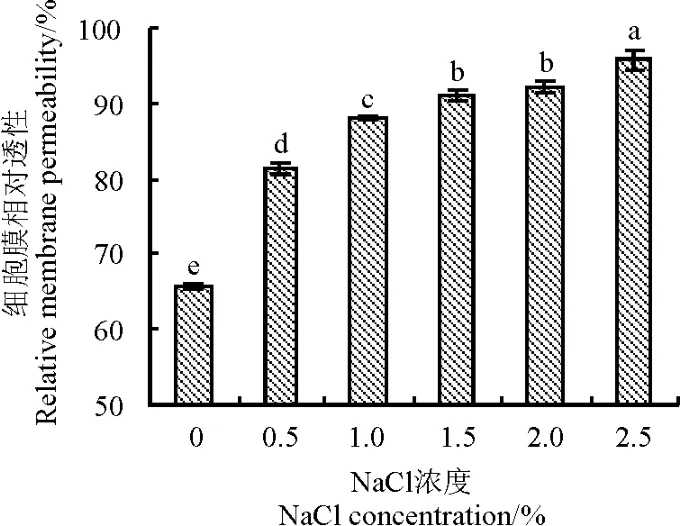
图3 NaCl胁迫对午夜Ⅱ号愈伤组织细胞膜透性的影响Fig.3 Effects of NaCl stress on the relative memberane permeability of MidnightⅡcalli
2.3 NaCl胁迫对午夜Ⅱ号愈伤组织游离脯氨酸含量的影响
游离脯氨酸是植物在逆境胁迫下极其重要的一项生理指标[14]。NaCl胁迫下午夜Ⅱ号愈伤组织游离脯氨酸的含量均高于对照,且随NaCl浓度的增大,脯氨酸含量显著增加(P<0.05) (图4)。游离脯氨酸含量在NaCl浓度为0.5%、1.0%、1.5%、2.0%、2.5%分别比对照增加了3.37倍、5.53倍、6.41倍、10.45倍和10.30倍,随胁迫程度的增加,游离脯氨酸逐渐积累,且与对照相比具有显著性差异(P<0.05)。

图4 不同浓度NaCl胁迫下午夜Ⅱ号愈伤组织游离脯氨酸含量的变化Fig.4 Effects of NaCl stress on Pro content in callus of MidnightⅡ
2.4 NaCl胁迫对午夜Ⅱ号愈伤组织丙二醛含量的影响
MDA是膜脂过氧化产物。在植物遭受逆境胁迫时,植物体内活性氧的代谢系统被破坏,从而导致植物体内平衡受损,活性氧积累,最终引发膜脂过氧化[15]。在NaCl胁迫下,MDA随胁迫的程度不同而呈现不同的变化,NaCl处理后,MDA含量均高于对照组,随着NaCl胁迫程度的加强,MDA含量呈现先增高后下降的趋势,分别比对照增加了1.48倍、1.94倍、2.40倍、1.92倍、1.93倍;在NaCl浓度为1.5%时,MDA含量达到最大,NaCl浓度为2.5%时,与2.0%时相比,MDA含量变化不显著(P>0.05),保持相对稳定(图5)。

图5 不同浓度NaCl胁迫下午夜Ⅱ号愈伤组织MDA含量的变化Fig.5 Effects of NaCl stress on MDA content in callus of MidnightⅡ
2.5 NaCl胁迫对午夜Ⅱ号愈伤组织可溶性蛋白含量的影响
不同浓度NaCl胁迫下愈伤组织可溶性蛋白含量的变化趋势显示(图6),随着NaCl浓度的增大,午夜Ⅱ号愈伤组织可溶性蛋白含量先增高后下降,变化趋势明显,其含量在0.5%、1.0%、1.5%、2.0% NaCl胁迫下分别为对照的100.11%、103.08%、105.23%和108.59%,2.5% NaCl胁迫下,午夜Ⅱ号愈伤组织可溶性蛋白含量比对照降低,是对照的99.71%;其中,低浓度处理的愈伤组织可溶性蛋白含量较对照组增长显著(P<0.05),而NaCl浓度为2.5%时,可溶性蛋白含量维持在一定的水平,略低于对照,但两者间差异不显著。

图6 不同浓度NaCl胁迫下午夜Ⅱ号愈伤组织可溶性蛋白含量的变化Fig.6 Effects of NaCl stress on soluble protein content in callus of MidnightⅡ
2.6 NaCl胁迫对午夜Ⅱ号愈伤组织抗氧化酶活性的影响
在整个试验过程中,愈伤组织中SOD、POD、CAT都是随着NaCl胁迫的增大先升高后下降(图7)。SOD与植物的抗逆性有关[16],在NaCl浓度为1.0%时,SOD活性最高。CAT和POD是构成植物愈伤组织细胞内H2O2清除系统的主要抗氧化酶[17],随盐浓度的增加,抑制作用明显增强,在NaCl浓度为1.5%时,POD和CAT酶活性达到最大,在NaCl浓度为2.5%时,活性降低。
3 讨论与结论
3.1 NaCl胁迫对午夜Ⅱ号愈伤组织生长的影响
盐胁迫可导致植物组织过量吸收Na+,不仅抑制了K+和其它一些维持植物正常生理活动的离子的吸收,还影响细胞新陈代谢。因此,植物愈伤组织在盐胁迫下生长减缓[18-19],甚至愈伤组织开始褐化。本研究发现,低浓度NaCl(<0.5%)对草地早熟禾午夜Ⅱ号愈伤组织的生长有明显的促进作用。其中,浓度为0.5%的NaCl处理的增重效果最为显著(P<0.05),而高浓度NaCl(>1%)对愈伤组织的生长具有显著抑制作用,耐受阈值<1.5%。午夜Ⅱ号愈伤组织对盐胁迫具有一定的耐受和抵抗能力,说明在轻度盐胁迫条件下,其可通过钠积累或离子交换而达到平衡,从而可以良好地生长。

图7 不同浓度NaCl胁迫下午夜Ⅱ号愈伤组织CAT、SOD和POD酶活性的变化Fig.7 Effects of NaCl stress on CAT,SOD and POD activities in callus of MidnightⅡ
3.2 NaCl胁迫下午夜Ⅱ号愈伤组织渗透调解物含量动态变化
脯氨酸的积累是植物逆境胁迫下的生理指标之一[20-21],具有调节细胞渗透压、降低细胞水势、稳定细胞蛋白结构的作用,在植物对逆境适应过程中发挥着重要作用[15-22]。本研究结果表明,不同浓度的NaCl处理后,随NaCl浓度的增大,草地早熟禾午夜Ⅱ号愈伤组织中的脯氨酸含量变化呈现上升趋势,表明脯氨酸在NaCl胁迫条件下逐渐累积,在午夜Ⅱ号愈伤组织逆境胁迫中发挥着重要的渗透调节作用,以适应盐胁迫。
可溶性蛋白的降低使细胞代谢速率降低,从而使愈伤组织对于盐胁迫的适应能力增强[23]。可溶性蛋白含量随着NaCl浓度的增大呈现先上升后下降的趋势,说明在低浓度盐胁迫下,午夜Ⅱ号愈伤组织为适应逆境环境,在组织内发生的蛋白质合成和分解反应中,其合成速率大于分解速率,因而表现出蛋白质含量逐渐积累的现象,而在高盐胁迫下,随着胁迫时间的延长蛋白质合成速率受到抑制,蛋白质分解速率大于其合成速率,使愈伤组织逐渐遭受盐害[24]。
电解质外渗率可以更深层地从细胞内部说明植物组织所受逆境胁迫的程度[25]。植物组织在逆境胁迫下,会引起细胞膜透性增大,细胞内含物外渗[26]。随NaCl浓度的增大,愈伤组织细胞膜透性曲线持续上升,说明细胞膜通透性越大,细胞膜损伤程度越严重。
3.3 NaCl胁迫下午夜Ⅱ号愈伤组织抗氧化酶活性及膜脂过氧化系统的响应
由于盐胁迫会引起植物体活性氧积累,产生氧化胁迫,因而植物一般不能在高盐土壤上正常生长。为避免氧化胁迫,非盐生植物体内形成一套防御机制,通过抗氧化酶和一些小分子化合物保护系统调节相关生理过程,维持机体相对稳定[15],以适应逆境环境。植物细胞在逆境胁迫下,表现出生物氧自由基增加,膜系统遭受破坏。而SOD和CAT由于具有消除氧自由基的作用,SOD可催化O2-发生歧化反应生成O2和H2O2,POD和CAT又催化H2O2形成H2O,所以SOD、CAT和POD的协调使植物体内活性氧维持在较低水平,可间接判断植物抗逆性的强弱[27-29]。Patade等[30]研究表明,NaCl和PEG胁迫下的甘蔗(Dioscorea esculenta)愈伤组织POD活性随着胁迫程度的加重而逐渐降低。本研究发现,午夜Ⅱ号愈伤组织中SOD、POD和CAT都随着NaCl胁迫程度的增大先升高后下降,这与Patade等[30]的研究结果基本一致,且NaCl胁迫下愈伤组织抗氧化酶活性均高于未胁迫对照,高盐浓度下,3种酶的活性均受到抑制,说明高浓度NaCl胁迫使午夜Ⅱ号愈伤组织中CAT和POD活性显著降低,不能及时清除H2O2,导致膜脂过氧化。而丙二醛是膜脂过氧化产物,其含量愈大,表明膜脂过氧化程度愈强。Patade等[30]研究还表明,NaCl和PEG胁迫下的甘蔗愈伤组织的丙二醛和电解质渗漏率均显著地高于未胁迫对照。本研究中,低盐胁迫下午夜Ⅱ号愈伤组织中MDA含量随胁迫程度的加剧而显著提高,高浓度NaCl(>1.5%)胁迫下愈伤组织中MDA含量均高于未胁迫对照,并随着盐浓度的增加而下降,与该研究结果一致,表明午夜Ⅱ号愈伤组织具有一定限度的抵抗膜脂过氧化能力。
综上所述,通过对NaCl胁迫下草地早熟禾午夜Ⅱ号愈伤组织的生长、抗氧化和渗透性调节能力的比较,发现午夜Ⅱ号愈伤组织可以耐受1.5%的盐浓度。因此,在筛选耐盐突变体时其NaCl浓度应不低于1.5%。
References)
[1]俞玲,马晖玲.甘肃陇西野生草地早熟禾植株的再生体系.草业科学,2014,31(6) : 1063-1069.Yu L,Ma H L.Plant regeneration system of wild Kentucky bluegrass in Longxi,Gansu Province.Pratacultural Science,2014,31(6) : 1063-1069.(in Chinese)
[2]梁慧敏,夏阳,杜峰,张普金.盐胁迫对两种草坪草抗性生理生化指标影响的研究.中国草地,2001,23(5) : 28-31.Ling H M,Xia Y,Du F,Zhang P J.Effects of NaCl stress on physiological index of two lawn grasses.Grassland of China,2001,23 (5) : 28-31.(in Chinese)
[3]顾敏霞,张丽,邵丽达,柴明良.体细胞无性系变异在草坪草改良上的研究进展.核农学报,2013,27(4) : 430-436.Gu M X,Zhang L,Shao L D,Chai M L.Progress in somaclonal variation and its application in germplasm improvement of turfgrasses.Journal of Nuclear Agricultural Sciences,2013,27(4) : 430-436.(in Chinese)
[4]Skirvin R M,McPheeters K D,Norton M.Sources and frequency of somaclonal variation.HortScience,1994,29(11) : 1232-1237.
[5]马建华,郑海雷,赵中秋,张春光.植物抗盐机理研究进展.生命科学研究,2001,5(3) : 175-179.Ma J H,Zheng H L,Zhao Z Q,Zhang C G.Progress in mechanisms of plant resistance to salt stress.Life Science Research,2001,5(3) : 175-179.(in Chinese)
[6]Lu S,Peng X,Guo Z,Zhang G,Wang Z,Wang C.In vitro selection of salinity tolerant variants from triploid bermudagrass (Cynodon transvaalensis×C.dactylon) and their physiological responses to salt and drought stress.Plant Cell Reports,2007,26(8) : 1413-1420.
[7]Lu S,Chen C,Wang Z,Guo Z,Li H.Physiological responses of somaclonal variants of triploid bermudagrass (Cynodon transvaalensis×C.dactylon) to drought stress.Plant Cell Reports,2009,28(3) : 517-526.
[8]柴明良,王贺飞.试管筛选耐盐的结缕草再生植株.科技通报,2006,21(5) : 557-560.Chai M L,Wang H F.In vitro selection for salt tolerance in zoysiagrass cv.zenith.Bulletin of Science and Technology,2006,21(5) : 557-560.(in Chinese)
[9]贾玉芳,陈曙,柴明良.γ射线对沟叶结缕草愈伤组织再生和耐盐性的影响.草业学报,2010,19(5) : 25.Jia Y F,Chen S,Chai M L.Effect of γ-irradiation on callus regeneration and salt tolerance in Manilagrass.Acta Prataculturae Sinica,2010,19(5) : 25-30.(in Chinese)
[10]Dionisio-Sese M L,Tobita S.Antioxidant responses of rice seedlings to salinity stress.Plant Science,1998,135(1) : 1-9.
[11]邹琦.植物生理学实验指导.北京:中国农业出版社,2003: 129-162.Zou Q.Plant Physiology Experiment.Beijing: China Agriculture Press,2003: 129-162.(in Chinese)
[12]Stewart R R C,Bewley J D.Lipid peroxidation associated with accelerated aging of soybean axes.Plant Physiology,1980,65(2) : 245-248.
[13]路文静,李奕松.植物生理学实验教程.北京:中国林业出版社,2012: 98-110.Lu W J,Li Y S.Experimental Course of Plant Physiology.Beijing: China Forestry Press,2012: 98-110.(in Chinese)
[14]汤章城.逆境条件下植物脯氨酸的累积及其可能的意义.植物生理学通讯,1984(1) : 15-21.Tang Z C.Possible significance of proline accumulation under plant conditions stress.Plant Physiology Communications,1984 (1) : 15-21.(in Chinese)
[15]范小峰,杨颖丽,程转霞.NaCl胁迫下唐古特白刺愈伤组织生理生化变化研究.干旱地区农业研究,2009,27(3) : 203-207.Fan X F,Yang Y L,Cheng Z X.Research on physiological and biochemical index changes of Nitraria tangutorm Bobr.callus under NaCl stress.Agricultural Research in the Arid Areas,2009,27(3) : 203-207.(in Chinese)
[16]薄鹏飞,孙秀玲,孙同虎.NaCl胁迫对海滨木槿抗氧化系统和渗透调节的影响.西北植物学报,2008,28(1) : 113-118.Bu P F,Sun X L,Sun T H.Antioxidative system and osmotic regulation in seedlings of annual Hibiscus hamabo Sieb.et zucc. under salt stress.Acta Botanica Boreali-Occidentalia Sinica,2008,28(1) : 113-118.(in Chinese)
[17]刘爱荣,张远兵,陈登科.盐胁迫对盐芥生长和抗氧化酶活性的影响.植物研究,2006,20(2) : 2216-2221.Liu A R,Zhang Y B,Chen D K.Effects of salt stress on the growth and the antioxidant enzyme activity of the Llungiella halophila.Bulletin of Botanical Research,2006,20(2) : 2216-2221.(in Chinese)
[18]陆卫,贾敬芬.谷子胚性愈伤组织耐盐系的选择及其生理生化特性分析.作物学报,1994,20(2) : 241-247.Lu W,Jia J F.Selection of NaCl-tolerant cell line from embryogenic calli of millet and studies on its physiological and biochemical characteristics.Acta Agronomica Sinica,1994,20(2) : 241-247.(in Chinese)
[19]许兴,毛贵莲,李树华.NaCl胁迫和外源ABA对枸杞愈伤组织膜脂过氧化及抗氧化酶活性的影响.西北植物学报,2003,23(5) : 745-749.Xu X,Mao G L,Li S H.Effect of salt stress and abscisic acid on membrane-lipid peroxidation and resistant-Oxidation enzyme activities of Lycium barbarum callus.Acta Botanica Boreali-occidentalia Sinica,2003,23(5) : 745-749.(in Chinese)
[20]王鸣刚,贾敬芬,谢放.小麦耐盐细胞系及后代耐盐稳定性的生化分析.西北植物学报,1999,19(2) : 144-148.Wang M G,Jia J F,Xie F.Biochemical analysis of salt-tolerant cell line and their progeny of wheat.Acta Botanica Boreali-occidentalia Sinica,1999,19(2) : 144-148.(in Chinese)
[21]裘丽珍,黄有军,黄坚钦.不同耐盐性植物在盐胁迫下的生长与生理特性比较研究.浙江大学学报(农业与生命科学版),2006,32(4) : 420-427.Qiu L Z,Huang Y J,Huang J Q.Comparative study on vegetal and physiological characteristics of different salt-tolerant plants under salt stress.Journal of Zhejiang University(Agriculture and Life Sciences),2006,32(4) : 420-427.(in Chinese)
[22]Prasad K,Saradhi P P.Effect of zinc on free radicals and proline in Brassica and Cajanus.Phytochemistry,1995,39(1) : 45-47.
[23]Heyser J W,Nabors M W.Growth,water content,and solute accumulation of two tobacco cell lines cultured on sodium chloride,dextran,and polyethylene glycol.Plant Physiology,1981,68(6) : 1454-1459.
[24]毛桂莲,哈新芳,孙婕.NaCl胁迫下枸杞愈伤组织可溶性蛋白含量的变化.宁夏大学学报(自然科学版),2005,26(1) : 64-66.Mao G L,Ha X F,Sun J.Researches on the content change of Lycium barbarum L.callus soluble proteins under NaCl stress,Journal of Ningxia University(Natural Science Edition),2005,26(1) : 64-66.(in Chinese)
[25]张军,王建波,陈刚,杜坤,刘娟,孙国荣.Na2CO3胁迫下星星草幼苗电解质外渗率与PSⅡ光能耗散的关系.草业学报,2009,18(3) : 200-206.Zhang J,Wang J B,Chen G,Du K,Liu J,Sun G R.The relationship between electrolyte leak and light energy dissipation of PS Ⅱin the leaves of Puccinellia tenuiflora seedlings under Na2CO3stress.Acta Prataculturae Sinica,2009,18(3) : 200-206.(in Chinese)
[26]Badger M R,von Caemmerer S,Ruuska S,Hiromi N.Electron flow to oxygen in higher plants and algae: rates and control of direct photoreduction (Mehler reaction) and rubiscooxygenase.Philosophical Transactions of the Royal Society B: Biological Sciences,2000,355(1402) : 1433-1446.
[27]董晓霞,赵树慧,孔令安,郭洪,刘光栋.苇状羊茅盐胁迫下生理效应的研究.草业科学,1998,15(5) : 11-14.Dong X X,Zhao S H,Kong L A,Guo H,Liu G D.Physiological responses of tall fescue to salt stress.Pratacultural Science,1998,15(5) : 11-14.(in Chinese)
[28]李雁博,张蕴薇,哈依夏,杜金鸿,刘源,陈果,王佺珍.须芒草、虉草和柳枝稷对干旱和盐胁迫的生理响应.草业科学,2014,31(5) : 905-914.Li Y B,Zhang Y W,Ha Y X,Du J H,Liu Y,Chen G,Wang Q Z.Physiological responses of bluestem,reed canarygrass and switchgrass under drought and salinity stress.Pratacultural Science,2014,31(5) : 905-914.(in Chinese)
[29]胡学俭,孙明高,夏阳,张金凤,李国雷,曹永富.NaCl胁迫对无花果与海棠膜脂过氧化作用及保护酶活性的影响.西北植物学报,2005,25(5) : 937-943.Hu X J,Sun M G,Xia Y,Zhang J F,Li G L,Cao Y F.Effect of NaCl stress on membrane lipid peroxidation and protective enzyme activities in the seedlings of fig and chinese flowering crabapple.Acta Botanica Boreali-occidentalia Sinica,2005,25(5) : 937-943.(in Chinese)
[30]Patade V Y,Bhargava S,Suprasanna P.Effects of NaCl and iso-osmotic PEG stress on growth,osmolytes accumulation and antioxidant defense in cultured sugarcane cells.Plant Cell,Tissue and Organ Culture,2012,108(2) : 279-286.
(责任编辑 王芳)
Physiological response of Kentucky bluegrass calli under NaCl treatment
Xu Hai-peng1,Li Hui-ping1,Jin Xiao-yu1,Jin-Ning2,Niu Kui-ju1,Ma Hui-ling1
(1.Pratacultural College,Gansu Agricultural University,Key laboratory of Grassland Ecosystem,Ministry of Education,Sino-U.S.Centers for Grazingland Ecosystem Sustainability,Lanzhou 730070,China; 2.Horticultural College,Gansu Agricultural University,Lanzhou 730070,China)
The effects of NaCl treatment on calli generated from Kentucky bluegrass cultivars MidnightⅡwere investigated by measuring calli growth,relative membrane permeability,contents of proline,MDA,and protein and the activities of antioxidant enzymes.The results showed that the calli growth of MidnightⅡwas stimulated under low concentration of NaCl whereas it was inhibited under high concentration of NaCl and the browning was observed if NaCl concentration was higher than 1.5%.With the increase of NaCl concentration,MDA and protein content increased firstly and then decreased.However,relative membrane permeability and proline content always increased.The activities of POD,SOD and CAT also increased firstly and then decreased with the increase of NaCl concentration which reached the peaks with the concentrations of 1.5% NaCl.The present study provided useful knowledge for screening salt resistant mutants of kentucky bluegrass.
NaCl stress; kentucky bluegrass; callus; growth; physiological and biochemical index
Ma Hui-ling E-mail: mahl@ gsau.edu.cn
S812; S543+.904; Q945.78
A
1001-0629(2016) 1-0086-07*
10.11829/j.issn.1001-0629.2015-0166
徐海鹏,李慧萍,金小煜,金宁,牛奎举,马晖玲.草地早熟禾愈伤组织对NaCl胁迫的生理响应.草业科学,2016,33(1) : 86-92.
Xu H P,Li H P,Jin X Y,Jin N,Niu K J,Ma H L.Physiological response of Kentucky bluegrass calli under NaCl treatment.Pratacultural Science,2016,33(1) : 86-92.
2015-03-24 接受日期: 2015-06-01
甘肃农业大学国家级大学生创新创业训练计划项目(201510733001) ;甘肃农业大学“大学生科研训练计划(SRTP)项目”(20150225) ;国家自然科学基金“草地早熟禾种间体细胞杂交的研究”(31160482)
徐海鹏(1994-),男,甘肃定西人,在读本科生,研究方向为草业科学。E-mail: 1292159295@ qq.com
马晖玲(1966-),女(回族),甘肃兰州人,教授,博士,研究方向为牧草及草坪草育种。E-mail: mahl@ gsau.edu.cn

