高效液相色谱法测定木薯干中黄曲霉毒素B1的不确定度评定
宋卫得,厉雪芹,高尧华,刘培海,刘 冰,卢志晓,孙 灿(日照出入境检验检疫局,山东日照276826)
高效液相色谱法测定木薯干中黄曲霉毒素B1的不确定度评定
宋卫得,厉雪芹,高尧华,刘培海,刘冰,卢志晓,孙灿
(日照出入境检验检疫局,山东日照276826)
摘要:依据GB/T18979—2003《食品中黄曲霉毒素的测定》,对免疫亲和层洗净化高效液相色谱法测定木薯干中黄曲霉毒素B1的不确定度进行了评定。对检测过程中产生的不确定分量进行了分类,计算各分量的相对标准不确定度,从而计算出合成标准不确定度和扩展不确定度。通过评估发现,对测定不确定度影响最大的分量是检测方法的回收率,影响最小的分量是样品质量的称量,合成相对标准不确定度为10.5 %。
关键词:液相色谱;黄曲霉毒素;不确定度;木薯干
黄曲霉毒素是黄曲霉菌的次级代谢产物,其中最具威胁的是具致癌性的黄曲霉毒素B1,主要作用于肝脏,产生致癌、致畸、致突变等严重危害[1-4]。目前,世界各国和地区对食品中黄曲霉毒素均有明确的限量要求[5]。我国食品安全标准中规定,木薯干中黄曲霉毒素B1的限量为5.0 μg/kg。木薯干作为制造酒精及柠檬酸的重要原料[6],由于国内原料的短缺,酿酒企业对木薯干需求量旺盛,进口木薯干规模和数量巨大,其毒素污染状况直接关乎酿酒产品质量和酿酒企业效益。本文以最新的不确定度评定标准为依据,结合实验室具体测定方法,对高效液相色谱法测定木薯干中黄曲霉毒素B1的不确定度进行评定,为食品和酿酒企业检测人员进行相关不确定度评定提供参考。
1 材料与方法
1.1材料、试剂及仪器
高效液相色谱仪Agilent 1260(荧光检测器FLD);黄曲霉毒素免疫亲和柱(北京中检维康公司);黄曲霉毒素B1标准品(Sigma公司),1.055 μ g/mL,误差范围±0.002 μg/mL;甲醇(色谱纯),美国J.T.Baker。
1.2检测方法
本实验室测定木薯干中黄曲霉毒素参照GB/T 18979—2003进行,并对某些步骤进行了优化和改进,检测结果满意。
实验步骤:称取25.0 g粉碎样品,加入5 g NaCl及(8∶2)甲醇-水至100 mL,以均质器高速搅拌提取2 min。定量滤纸过滤,准确移取5.0 mL滤液并加入20 mL水稀释,用玻璃纤维滤纸过滤。将免疫亲和柱连接于20.0 mL注射器下,准确移取10.0 mL样品提取液注入玻璃注射器中,将空气压力泵与注射器连接,调节压力使溶液以6 mL/min流速通过过免疫亲和柱,直至2~3 mL气体空气通过柱体。以10 mL水淋洗柱子2次,弃去全部流出液,并将2~3 mL气体空气通过柱体。准确加入1.0 mL色谱级甲醇洗脱,流速为1~2 mL/min,收集全部流出液于玻璃试管中,再加入去离子水定容1 mL淋洗柱,最后用甲醇-水(1∶1)定容至2 mL,待上机检测。
1.3不确定度来源
本方法操作步骤相对复杂,影响因素多,不确定来源主要包括:(1)样品制备均匀度引入的不确定度;(2)称量、定容等引入的不确定度;(3)标准溶液及配制产生的不确定度;(4)检测方法回收率引入的不确定度;(5)环境温度影响的不确定度。
2 不确定度的评定
2.1样品均匀度引入的不确定度
被测试样品各部位含有黄曲霉毒素的差异较大,本实验按照标准取样方法,分别抽取10个混合样品进行测定,以评定试样制备的均匀度。该不确定度评定属A类评定,可由全部10个不同混合试样测定结果进行统计分析得出。
本实验以木薯干中黄曲霉毒素B1为例,将10个混合样品分别粉碎、充分摇匀后依次进行测定,测试数据见表1。
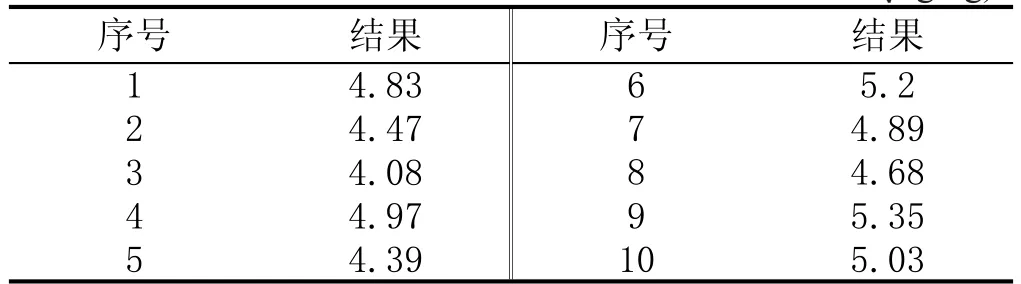
表1 黄曲霉毒素B1的测试数据 (μg/kg)
黄曲霉毒素B1含量的平均值:x=4.79 μg/kg。
单次测定∑标准差s(xi)用贝塞尔公式计算:

样品分布均匀度引入的标准不确定度u(x)为:

2.2样品称量不确定度


2.3样品定容不确定度
2.3.1由校准引入的标准不确定度u(V1)
样品经粉碎、提取、净化后准确加入1 mL甲醇洗脱,加入去离子水定容至2 mL,使用吸管获得该体积,依据JJG196—2006《常用玻璃量具检定规程》,2 mL吸管检定后给出的允许误差为±0.010 mL,按B类评定,假设服从均匀分布,置信因子k=,则由校准引入的标准不确定度u(V1)为:
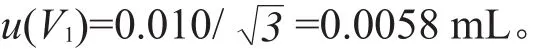
2.3.2由温度变化引入的标准不确定度u(V2)
实验室的温度在20℃±4℃间变化,水的体积膨胀系数为2.1×10-4/℃,由此引入的标准不确定度为:

相比之下,体积由校准带来的不确定度分量远高于温度波动引入的不确定度分量,因此后者可以忽略。体积的标准不确定度为u(V)=0.0058 mL。
2.4标准品工作液浓度不确定度的评定
2.4.1标准品浓度引入的不确定度
本方法采用的标准品1 mL液体试剂,黄曲霉毒素B1浓度为1.055 μg/mL,需经2次稀释配制为标准工作液。标准证书标明黄曲霉毒素B1浓度c0为1.055 μg/mL,误差范围±0.002 μg/mL,则该标准品浓度不确定度可按B类评定,同样按照矩形分布处理,其标准不确定度u(c0)为:
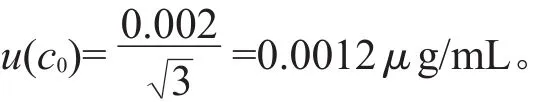
2.4.2标准工作液配制引入的不确定度
黄曲霉毒素标准品经2次稀释配制为标准工作液,即将1 mL标准品定容于10 mL容量瓶中,用苯-乙腈(98 ∶2)定容至刻度,充分混匀得到标准储备液;准确移取1 mL标准储备液于10 mL容量瓶中,用苯-乙腈(98∶2)定容至刻度,充分混匀得到标准工作液。
即:V1=1 mL,V2=10 mL,V3=1 mL,V4=10 mL。
标准工作使用液的浓度c:

依据JJG 196—2006《常用玻璃量具检定规程》,A级1 mL吸管,最大允许误差为:±0.007 mL;A级10 mL容量瓶,最大允许误差为:±0.020 mL。按均匀分布处理,由校准导致的标准不确定度分别为:

由于稀释操作时,吸管和容量瓶中的溶液几乎处于相同的温度下,因此可以忽略温度带来的影响。另外重复性已包括在样品均匀度的试验中。

表2 黄曲霉毒素含量检测的各不确定度分量
2.4.3合成标准样品工作液配制的不确定度
由此导出标准工作液配制的标准不确定度u(c)为:

2.4.4检测方法的不确定度
根据食品理化部分的实验室质量控制规范,当被测组分含量<0.1 mg/kg时,回收率范围60 %~120 %[7]。经过本实验室的大量添加回收率试验数据结果证明,当添加浓度在0.001~0.01 mg/kg时,该方法的回收率控制在70 %~105 %范围之内,符合实验室质量控制规范的要求。因此我们以该数据作为评定该检测方法不确定度的依据。该不确定度可包含整个检验方法过程中的提取、净化、淋洗、浓缩、定容及仪器分析等各个操作步骤在常规操作下产生的误差来源。
根据统计数据回收率的上界为a+=105 %,其下界为a-=70 %,其区间半宽度为a=(a+-a-)/2=(105 %-70 %)/2= 17.5 %,服从均匀分布,置信因子k=。由此引起的标准不确定度为:
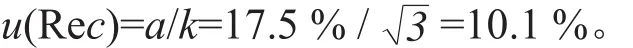
大量的回收率数据所表征的方法已包括了重复性引入的不确定度,故不重复评定。回收率实验中,试样的主要作用是产生一个与实际检测过程相同的载体条件。回收率实验中没有包含全部实验室偏倚分量,对能够产生偏倚的量,已在上述不确定度分量评定中进行了单独的分析讨论。
3 标准不确定度各分量的评估分析
通过表2中各不确定度分量的大小对比发现,不确定度的最大贡献来自于测试方法的回收率,其次是取样时样品分布均匀度,贡献最小的是样品质量的称量,后者在计算合成不确定度时可以忽略不计。
4 合成相对标准不确定度

5 合成标准不确定度

6 扩展不确定度与测试结果报告
取包含因子k=2,测试结果y的扩展不确定度:
U=kuc(y)=2×0.50=1.00 μg/kg。
测定结果报告为:y=(0.479±1.00)μg/kg,k=2。
7 讨论
本研究以木薯干中黄曲霉毒素B1的10次取样测定数据为基础,进行了免疫亲和层洗净化高效液相色谱法测定黄曲霉毒素的不确定度评定。从中发现,影响方法不确定度的主要因素是测试方法回收率和样品分布均匀性。因此,在同等实验操作条件下,选用性能稳定的免疫亲和净化柱和科学准确的取样方法是保证黄曲霉毒素测定结果准确性的前提。
一切测试结果都不可避免地产生不确定度,测试结果的可靠性取决于不确定度的大小,只有出具不确定度值,检测结果才完整而有意义。在本实例检测中,黄曲霉毒素B1平均测试结果为4.79 μg/kg,未超过国标限量;但加入扩展不确定度值后,黄曲霉毒素B1的浓度已超过国标限量值5.0 μg/kg,不能判定为合格,可作为木薯干进口企业应对贸易纠纷、进行维权的技术指标。
参考文献:
[1]李瑞芳,韩北忠,陈晶瑜,等.黄曲霉生长预测模型的建立及其在玉米储藏中的应用[J].中国粮油学报,2008,23(3):144-147.
[2]罗小虎,王韧,王莉,等.黄曲霉毒素检测方法研究进展[J].粮食与饲料工业,2013(10):54-58.
[3]许艳丽,鲍蕾,梁成珠,等.黄曲霉毒素检测及其生物防治方法的研究进展[J].安徽农业科学,2007,35(32):10210-10212.
[4]田瑞红,孙建平.HPLC技术分析测定黄曲霉毒素的研究进展[J].食品研究与开发,2015,36(6):149-152.
[5]郭礼强,宫小明,孙军,等.高效液相色谱-质谱法同时测定曲霉菌代谢物中的黄曲霉毒素及其同系物[J].分析试验室,2015,34(6):677-682.
[6]韦昌联,卢柳忠,黎贞崇.我国木薯生物质能源产业发展现状与科技需求[J].酿酒科技,2012(7):108-111.
[7]全国认证认可标准化技术委员会.实验室质量控制规范食品理化检测:GB/T 27404—2008[S].北京:中国标准出版社,2008.
Evaluation of the Uncertainties in the Determination of Aflatoxins B1in Dry Cassava by HPLC
SONG Weide, LI Xueqin, GAO Yaohua, LIU Peihai, LIU Bing, LU Zhixiao and SUN Can
Rizhao Entry-Exit Inspection & Quarantine Bureau, Rizhao, Shandong 276826, China)
Abstract:The uncertainties in the determination of aflatoxins B1in dry cassava by HPLC according to GB/T 18979-2003 were evaluated. The uncertainty components were classified, the relative standard uncertainty of each component was calculated, and the combined standard uncertainty and expanded uncertainty were calculated eventually. The evaluation results suggested that the component with the maximum uncertainty influence was recovery rate and the component with the minimum uncertainty influence was sample weighing, with the relative combined standard uncertainty of 10.5 %.
Key words:liquid chromatography; aflatoxins; uncertainty ; dry cassava
作者简介:宋卫得(1981-),男,山东日照人,工程师,硕士,主要从事食品检验及质量控制工作,E-mail:woxinyh2006@163.com。
收稿日期:2015-11-03;修回日期:2015-12-07
基金项目:山东出入境检验检疫局科研计划项目(SK201619)。
DOI:10.13746/j.njkj.2015415
中图分类号:TS261.2;TS261.7
文献标识码:A
文章编号:1001-9286(2016)04-0093-03
优先数字出版时间:2016-02-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160225.1713.002.html。

