雌激素对肾血管性高血压大鼠心脏功能及氧化应激的影响
马 虎, 阿迪力·阿不都热合曼, 秦 浩, 努尔乎玛尔·库尔班, 邬利娅·伊明,
艾尼瓦尔·吾买尔1
(新疆医科大学1基础医学院药理教研室, 2研究生学院2014-1班, 乌鲁木齐 830011)
·药学研究·
雌激素对肾血管性高血压大鼠心脏功能及氧化应激的影响
马虎1, 阿迪力·阿不都热合曼1, 秦浩2, 努尔乎玛尔·库尔班1, 邬利娅·伊明1,
艾尼瓦尔·吾买尔1
(新疆医科大学1基础医学院药理教研室,2研究生学院2014-1班, 乌鲁木齐830011)
摘要:目的探讨雌激素对肾血管性高血压大鼠心脏功能及氧化应激的影响。方法取10周龄SD大鼠,狭窄一侧肾动脉建立肾血管性高血压(2KIC)模型,雌性大鼠去除双侧卵巢建立雌激素低下模型(VOX),分为2K1C雌性组(2KIC-F组)、2K1C雌性去势组(2K1C-VOX组)和2K1C雄性组(2K1C-M组)。于手术后16 w进行超声心动图检查和心脏血流动力学检查,评价雌激素对肾血管性高血压大鼠心脏结构和功能的影响;取心脏组织液氮冻存,测定心肌组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、总抗氧化能力(T-AOC)及抗超氧阴离子(抗O-2 )。结果超声心动图结果显示,与2KIC-F组比较,2KIC-VOX组左心室收缩末期内径(LVIDd)、左心室舒张末期后壁厚度(LVPWd)显著降低,2KIC-M组LVPWd显著升高(P<0.05)。血流动力学结果显示,与2KIC-F组比较,2KIC-VOX组和2KIC-M组收缩压(SBP)、舒张压(DBP)均有明显降低,2KIC-VOX组和2KIC-M组差异无统计学意义;2KIC-M组室内压最大上升速率(+dp/dtmax)、室内压最大下降速率(-dp/dtmin)均显著降低;与2KIC-VOX组比较,2KIC-M组-dp/dtmin显著降低(P<0.05)。氧化应激结果显示,与2KIC-F组比较,2KIC-VOX组心脏组织SOD的活性升高,MDA含量降低;2KIC-M组SOD的活性、T-AOC及抑制阴离子水平升高,MDA含量降低;与2KIC-VOX组比较,2KIC-M组T-AOC、抗O-2、MDA水平显著增高(P<0.05)。结论雌激素可加重肾血管性高血压的严重程度和氧化应激水平,雌激素低下时,其严重程度得以改善。
关键词:雌激素; 肾血管性高血压大鼠; 血流动力学; 氧化应激
高血压发病机制错综复杂,是多种因素综合作用的结果。肾血管性高血压占高血压人群的5%左右,主要由于肾动脉狭窄引起肾脏血流量减少,从而导致肾素-血管紧张素系统(renin-angiotensin system, RAS)激活[1-2]。氧化应激和高血压的关系越来越被人们所关注,随着血压过度升高,活性氧的产生增加,其可以影响血管的紧张度和血管重构。RAS激活使血管紧张素II(AngII)生成增加,AngII生物学效应中的氧化应激机制在高血压的形成过程中发挥重要作用[3-4]。血压存在性别差异,然而导致性别差异的机制还处于一个不断研究的阶段。雌激素是一种男、女性体内均存在的激素,女性体内的雌激素和孕激素主要由卵巢合成、分泌,肾上腺皮质也产生少量雌激素。雌激素对RAS有一定的影响,可以增加肾皮质AT1受体的mRNA和蛋白的表达[5-6],增加血管紧张素原,升高循环中和肾脏内的AngII水平,导致肾血流量的减少而引起心脏和肾脏损伤[7]。雌性自发性高血压脑卒大鼠去势可降低脑卒中和肾功能损伤,用雌激素治疗后反而加重脑卒中和肾功能损伤[8]。然而,氧化应激对血管紧张素II诱导的高血压在雌性中的贡献是未知的。本实验旨在研究雌激素对肾血管性高血压大鼠的血压水平、心功能及氧化应激水平的影响。
1材料与方法
1.1实验动物150只SD大鼠,体质量180~200 g,雌性100只,雄性50只,由新疆医科大学实验动物中心提供。所有的动物行两肾一夹(2K1C)手术,其中50只雌性大鼠行去势手术合并2K1C手术。分雌性两肾一夹组(2K1C-F组)、雄性两肾一夹组(2K1C-M组)和雌性两肾一夹去势组(2K1C-VOX组)。手术后动物常规饮食喂养,手术4 w后用BP-6无创尾动脉测压仪测定动物血压,以收缩压≥140mmHg者确认为高血压模型形成进入实验,低于此标准者剔除。实验期间大鼠自由饲养环境为SPF级。
1.2实验仪器与试剂低温离心机(HITACHI CENTRIFUGE,日本),HD11 XE超声诊断仪(PHILIPS,荷兰),超纯水仪(MILIQ,MILIPORE,法国),无创血压测定仪(BP-6,成都泰盟),生物信号采集系统(BL-420F,成都泰盟),分光光度计(UV2550岛津,日本),酶标仪(Thermo,美国),考马斯亮蓝试剂盒(生产批号:20150923),NO化学法试剂盒(生产批号:20150812),抗超氧阴离子(抗O-2)试剂盒(生产批号:20150923),丙二醛(MDA)试剂盒(生产批号:20150922),超氧化物歧化酶(SOD)试剂盒(生产批号:20150922),总抗氧化能力(T-AOC)试剂盒(生产批号:20150923),以上试剂盒均由南京建成生物工程研究所提供。
1.3实验方法
1.3.12KIC高血压模型的制备SD大鼠100只,雌雄各半。用戊巴比妥30 mg/kg体质量腹腔注射麻醉,仰卧固定于手术台,距离剑突下约1.5 cm处,将腹部皮肤沿正中切开2~3 cm,沿腹中线切开肌肉层,分离肾动脉,并套以U型银夹(内径为0.2 mm)。缝合切口,后肢肌肉注射青霉素钠8万U。
1.3.2双侧卵巢切除手术雌性SD大鼠50只,用戊巴比妥30 mg/kg体质量腹腔注射麻醉,仰卧固定于手术台,距离剑突下约1.5 cm处,将腹部皮肤沿正中切开2~3 cm,然后沿腹中线切开肌肉层,用止血钳分开切口,用镊子移开腹内组织,分离肾动脉行2K1C手术,暴露卵巢,结扎卵巢的动脉后将其切除,完成双侧卵巢的摘除手术。缝合切口,后肢肌肉注射青霉素钠8万U。
1.3.3超声心动图检查手术16 w后,用戊巴比妥30 mg/kg体质量腹腔注射麻醉,剔除心脏部位的毛,用超声探头进行心脏B超检测。测量参数包括:舒张期间隔厚度(interventricular septal thickness at diastole, IVSd)、左心室短轴缩短率(fractional shortening, FS%)、左心室舒张末期后壁厚度(left ventricular posterior wall depth, LVPWd)、左心室舒张末期内径(left ventricular internal diameter at end-diastole, LVIDd)、左心室射血分数(ejection fraction, EF)等指标。
1.3.4血流动力学测定手术16 w后,用戊巴比妥钠30 mg/kg体质量腹腔注射麻醉,仰卧固定于实验台上,分离右侧颈总动脉插入充满肝素化生理盐水的PE50导管,将导管接压力传感器上,信号输入至BL-420生物信号处理系统,稳定后,记录颈总动脉收缩压(systolic blood pressure, SBP)、舒张压(diastolic blood pressure, DBP),再经右侧颈总动脉向左心室内推送导管,至出现明显的心室压波形,记录左室收缩压(left ventricular systolic pressure, LVSP)、左室舒张末期压(left ventricular end diastolic pressure, LVEDP)、 室内压最大上升速率(+dp/dtmax)、室内压最大下降速率(-dp/dtmax)。
1.3.5氧化应激指标测定取心室肌组织,用生理盐水制备10%的组织匀浆液,考马斯亮蓝法测定组织蛋白浓度;黄嘌呤氧化酶法测定SOD;TBA法测定MDA;比色法测定T-AOC;利用黄嘌呤与黄嘌呤氧化酶反应系统测抗超氧阴离子(抗O-2),上述指标均按照试剂盒说明书操作。
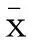
2结果
2.1雌激素对肾血管性高血压大鼠超声心动图的影响与2KIC-F组相比,2KIC-VOX组LVIDd、 LVPWd显著降低(P<0.05),2KIC-M组LVPWd显著升高(P<0.05);与2KIC-VOX组相比,2KIC-M组LVPWd显著增高(P<0.05),LVSd、FS和EF的变化差异无统计学意义,见表1。

表1 雌激素对肾血管性高血压大鼠超声心动图的影响(±s)
注:与2KIC-F组比较,*P<0.05; 与2KIC-VOX组比较,△P<0.05。
2.2雌激素对肾血管性高血压大鼠血流动力学的影响2KIC-F组SBP和DBP明显高于2KIC-VOX组和2KIC-M组(P<0.05),2KIC-VOX组和2KIC-M组的变化差异无统计学意义。与2KIC-M组相比,2KIC-M组+dp/dtmax与-dp/dtmin 均显著降低(P<0.05),与2KIC-VOX组相比,2KIC-M组-dp/dt min显著降低(P<0.05),见表2。
2.3雌激素对肾血管性高血压大鼠心脏组织氧化应激水平的影响与2KIC-F组比较,2KIC-VOX组心脏组织SOD、 NO水平升高,MDA水平降低(P<0.05),T-AOC与抑制阴离子水平无明显差异(P>0.05);2KIC-F组心脏组织中SOD、T-AOC、抑制阴离子水平升高(P<0.05),MDA水平降低(P<0.05),与2KIC-VOX组相比,2KIC-M组T-AOC、抗O-2、 MDA水平显著增高(P<0.05),见表3。

表2 雌激素对肾血管性高血压大鼠血流动力学的影响(±s)
注:与2KIC-F组比较,*P<0.05,**P<0.01; 与2KIC-VOX组比较,△P<0.05。

表3 雌激素对肾血管性高血压大鼠心脏组织氧化应激的影响(±s, n=15)
注:与2KIC-F组比较,*P<0.05,**P<0.01; 与2KIC-VOX组比较,△P<0.05,△△P<0.01。
3讨论
心血管系统的疾病尤其是高血压的发病存在性别差异性。有研究显示,雌激素对心血管系统有保护作用,雄激素对心血管系统有损伤作用,并对一些靶器官如血管、肾脏和心脏等进行局部的调节,其详细机制尚不明确[9-11]。RAS的激活在高血压的发病中起关键作用。有研究表明,性激素对RAS的影响是导致高血压性别差异的主要因素之一[12]。
为了阐明雌激素与AngII之间的相互作用,本研究选用10周龄雌性和雄性的SD大鼠制备2K1C肾血管性高血压模型。为了进一步了解雌激素的作用,切除双侧卵巢造成雌激素水平低下,再行2K1C手术,常规喂养16 w后,观察肾性高血压形成、心脏结构与功能的改变。2K1C高血压的形成机制: 狭窄大鼠一侧的肾动脉,肾血流量减少(约30%)促使肾入球小动脉的近球小球细胞释放肾素,激活RAS,最终引起大鼠血压的升高[13]。本研究结果表明,2K1C-F组SBP和DBP高于2K1C-VOX组和2K1C-M组,2K1C-VOX组与2K1C-M组差异无统计学意义,提示雌性组大鼠肾血管性高血压较雄性组严重,摘除双侧的卵巢导致雌激素水平低下时,其严重程度得以缓解,血压水平接近雄性组。
心脏是高血压最常损害的靶器官之一。高血压时由于心肌损伤、压力或容量的超负荷,可导致心室质量、心腔大小和容积的变化,在细胞水平则表现为心肌细胞肥大、凋亡、成纤维细胞增生、单核炎症细胞的异常浸润,进一步引起心脏收缩功能障碍及心律失常等病理变化[14]。本研究心脏超声检测结果表明,与2KIC-F组比较,2KIC-VOX组LVIDd、 LVPWd显著降低,提示雌激素低下时左心室肥厚程度明显改善;2KIC-M组LVPWd显著增高,其原因可能与雄激素的作用有关[15]。
左心室内压变化速率+dp/dtmax和-dp/dtmin用于评价心脏的收缩舒张功能,本实验结果表明,与2KIC-F组比较,2KIC-M组+dp/dtmax、 -dp/dtmin显著降低,提示雌激素可使肾血管性高血压大鼠处于血压升高引起的高动力血流状态,左室收缩舒张功能受损程度严重。
高血压的发生、发展与活性氧的过度生成造成氧化应激和(或)机体内抗氧化能力降低有关[16-18]。本实验结果显示,与2K1C-F组比较,2K1C-VOX组心脏组织中SOD的活性明显增高,MDA的水平明显降低;2K1C-M组心脏组织SOD的活性明显升高,T-AOC水平和抗O-2水平明显增高,MDA水平均明显降低,提示雌性肾血管性高血压大鼠心脏组织的氧化应激损伤明显高于雌性去势组和雄性组。
综上所述,高血压的形成有一定的性别差异,雌激素可加重肾血管性高血压的严重程度和氧化应激水平,雌激素低下时,其严重程度得以改善。
参考文献:
[1]Ohnston CL. Renin-angiotensen system:a dual tissue and hormonal system for cardiovacular control[J]. J Hypertens Suppl, 1992,10(7):13-26.
[2]Dzau VJ, Bernstein K, Celermajer D, et al. The relevance of tissue angiotensin- converting enzyme:Manifestations in mechanistic and endpoint data[J]. Am J Cardiol,2001, 88(9):1-20.
[3]Bhatia K, Elmarakby AA, El-Remessy AB, et al. Oxidative stress contributes tosex differences in angiotensin II mediated hypertension in spontaneously hypertensive rats[J]. Am J Physiol Regul Integr Comp Physiol,2012,302(2):274-282.
[4]Wen HR, Liu JG, LH Xie. Oxidative stress-mediated effects of angiotensin II in the cardiovascular system[J]. World J Hypertens,2012, 2(4):34-44.
[5]Karl D, Pender G, Nancy T, et al. Sex differences in circulating and renal angiotensins of hypertensive mRen(2).Lewis but not normotensive Lewis rats[J].Am J Physiol Heart Circ Physiol ,2008,295(1):10-20.
[6]Oestreicher EM, Guo C, Seely EW, et al. Estradiol increases proteinuria and angiotensin II type 1 receptor in kidneys of rats receiving L-NAME and angiotensin II[J]. Kidney Int ,2006,70(10):1759-1768.
[7]Seely EW, Brosnihan KB, Jeunemaitre X, et al. Effects of conjugated oestrogen and droloxifene on the renin angiotensin system, blood pressure and renal blood flow in postmenopausal women[J]. Clin Endocrinol (Oxf),2004,60(3):315-321.
[8]Stier CT, Chander PN, Rosenfeld L, et al. Estrogen promotes microvascular pathology in female stroke-prone spontaneously hypertensive rats[J].Am J Physiol Endocrinol Metab,2003,285(1):232-239.
[9]Christine MB, Michaele B. Sex differences in hypertension: contribution of the Renin-Angiotensin System[J] .Gend Med ,2012,9(9):291.
[10]Chappell MC, Westwood BM, Yamaleyeva LM. Differential effects of sex steroids in young and aged female mRen2.Lewis rats: a model of estrogen and salt-sensitive hypertension[J]. Gend Med, 2008, 5(Suppl A):65-75.
[11]Yanes LL, Sartori-Valinotti JC, Iliescu R, et al. Testosterone dependent hypertension and upregulation of intrarenal angiotensinogen in Dahl salt-sensitive rats[J]. Am J Physiol Renal Physiol, 2009, 296(4):771-779.
[12]Gallagher PE, Li P, Lenhart JR, et al. Estrogen regulation of angiotensin converting enzyme mRNA[J]. Hypertension,1999,33(1 Pt 2):323-328.
[13]Manuel MM. Pathophysiology of renovaseular hypertension[J].Hypertension,1991, 17(17):707-719.
[14]殷晓峰,胡刚,汪海. 血压调控机制及抗高血压药物靶标[J]. 中国药理学通报,2003,19(9):971-975.
[15]胡剑平,谈世进,丁在咸.雄激素在高盐引发高血压中的作用[J].中华高血压杂志,2008,16(11):991-993.
[16]Bhatia K, Elmarakby AA, El-Remessey A, et al.Oxidative stress contributes to sexdifferences in angiotensin II-mediated hypertension in spontaneously hypertensive rats[J].Am J Physiol Regul Integr Comp Physiol,2012,302(2):274-282.
[17]邢之华, 蔡昌龙, 李明月,等.高血压病患者血压与血清SOD、MDA、CAT、GSH -PX水平的关系[J].江苏医药,2005,31(5):367-368.
[18]Redon J, Oliva MR, Tormos C, et al. Antioxidant activities and oxidative stress byproducts in human hypertension[J].Hypertension,2003,41(5):1096-1101.
(本文编辑周芳)
Effect of estrogen on cardiac function and oxidative stress in renovascular hypertensive rats
MA Hu1, Adili Abudureheman1, QIN Hao2, Nuerhumaer Kurban1, Wuliya Yiming1, Ainiwaer Wumaier1
(1DepartmentofPharmacology,BasicMedicalCollege,2Class2014-1,CollegeofPostgraduate,XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo study the effects of estrogen on cardiac function and oxidative stress in renovascular hypertensive rats. MethodsThe experiments were performed with 10-week-old SD rats which were prepared by the narrow side of the renal artery to develop renovascular hypertension(2K1C). Both ovaries of one group of female rats were removed (VOX) to make the low levels of estrogen modle. Animals were divided 3 groups: 2K1C-femals (2K1C-F), 2K1C-femals-VOX (2K1C-VOX) and 2K1C-mals (2K1C-M). After 16 weeks of regular feeding, the echocardiography, hemodynamics examination of the heart were performed to investigate the impact of estrogen on the cardiac function of renovascular hypertensive rats. The cardiac tissues were isolated and snap frozen in liquid nitrogen for measurement of the activity of superoxide dismutase (SOD), the content of malondialdehyde (MDA), total antioxidant capacity (T-AOC), and the anti-level of oxidative stress-related indicators-superoxide anion (antiO-2 ). ResultsThe echocardiography results showed that, compared with 2K1C-F group, LVIDd, LVPWd were decreased in 2KIC-VOX group (P<0.05), and LVPWd was increased in 2K1C-M group (P<0.05). The hemodynamics results showed that, compared with 2K1C-F group, in 2K1C-M group and 2K1C-VOX group, systolic blood pressure (SBP) and diastolic blood pressure (DBP) were decreased (P<0.05). There was no significant difference between 2K1C-VOX group and 2K1C-M group. LV+dp/dtmax, and LV-dp/dtmin in 2K1C-M group were lower than in 2K1C-F group (P<0.05), compared with 2K1C-VOX group, -dp/dtmin was decreased in 2K1C-M group (P<0.05). Oxidative stress results of cardiac tissues showed that, compared with 2K1C-F group, in 2KIC-VOX group, the activity of SOD was increased (P<0.05), the content of MDA was decreased (P<0.05); in 2K1C-M group, the activity of SOD, the content of T-AOC and antiO-2 were increased (P<0.05),while the content of MDA was decreased (P<0.05). Compared with 2K1C-VOX group , the content of MDA, T-AOC and antiO-2 were increased in the 2KIC-M group (P<0.05). ConclusionEstrogen can aggravate the renovascular hypertension and oxidative stress Renovascular hypertension can be improved with low level of estrogen.
Keywords:estrogen; renovascular hypertension; hemodynamics; oxidative stress
[收稿日期:2016-02-08]
doi:10.3969/j.issn.1009-5551.2016.04.014
中图分类号:R54
文献标识码:A
文章编号:1009-5551(2016)04-0441-05
作者简介:马虎 (1989-),男,在读硕士,研究方向:心血管药理学研究。通信作者:艾尼瓦尔·吾买尔,男(维吾尔族),教授,博士生导师,研究方向:心血管药理学研究,E-mail:anwar.umar@126.com。
基金项目:国家自然科学基金(81360048); 新疆医科大学创新基金(XJC201111)

