人体呼出气中总挥发性有机物水平与呼吸系统疾病相关性研究
刘静莎,索 爽,高红梅,陈文丽,陈 献,张 晔,谭青海,谷 晔,张健鹏
人体呼出气中总挥发性有机物水平与呼吸系统疾病相关性研究
刘静莎1,索 爽2,高红梅1,陈文丽1,陈 献1,张 晔1,谭青海1,谷 晔1,张健鹏1
目的 探讨人体呼出气中总挥发性有机物(volatile organic conmpounds,VOCs)的浓度水平是否与疾病之间存在关联,进而指导疾病早期诊断。方法 选取武警某三甲医院收治的100例呼吸系统疾病患者为观察对象,分为4组:肺癌组(n=15)、肺炎组(n=55)、肺纤维化组(n=15)、慢性阻塞性肺疾病(chronic obstructive pulmonary diseases,COPD)组(n=15);同时选取我院81例健康医护人员作为对照组。用光离子化探测器(photoionization detector,PID)测定所有对象呼出气中总VOCs浓度(标记为Pvoc)。结果 与健康对照组相比,肺癌组(Z=-2.523,P=0.012)、肺炎组(Z=-4.281,P<0.001)、肺纤维化组(Z=-3.204,P=0.001)及COPD组(Z=-2.644,P=0.008)Pvoc 测定结果均明显降低,差异均有统计学意义。而肺癌组、肺炎组、肺纤维化组与COPD组之间Pvoc两两比较,差异均无统计学意义。结论 用PID测定人体呼出气总VOCs浓度无助于对肺癌、肺炎、肺纤维化、COPD患者的诊断。
挥发性有机物;呼吸系统疾病;光离子化探测器
VOCs是常温下以气态形式存在于空气中的可挥发性有机物的总称。人体在生理代谢过程中会产生痕量的VOCs并经呼出气呼出。因呼出气成分检测的无创、便捷、高灵敏度及高特异性等特点,近年来,呼出气分析已被认为有可能成为一种安全便捷的疾病早期诊断方法[1]。目前,针对呼出气VOCs的研究主要集中于对患者呼出气中某一种或几种VOCs的检测分析。有研究显示,正丁醇和3-羟基-2-丁酮可能是早期肺癌气态标志物[2];吲哚、十一烷醇及丁基羟基甲苯分别是大肠杆菌、铜绿假单胞菌、肺炎克雷伯杆菌的特征性VOCs等[3]。然而,呼出气研究大多存在着样本量小、重复性差、检测技术方法繁杂、标准和方法不统一等不足,因而与实际临床应用之间尚存在较大距离。迄今尚未见有关人体呼出气中总VOCs浓度与疾病诊断的相关报道,本研究拟通过快速PID检测技术对呼吸系统不同疾病患者呼出气中总VOCs浓度进行检测分析,以探讨呼出气中总VOCs浓度与疾病之间是否存在关联,现报道如下。
1 对象与方法
1.1 对象 以2013-11至20 14-02,武警某三甲医院呼吸内科收治的100例呼吸系统疾病患者为观察对象,根据疾病种类分为4组,其中肺癌组15例,肺炎组55例,肺纤维化组15例,COPD组15例。同时选取我院81名健康医护人员作为对照组。所有对象年龄18~80岁,并均知情同意,其一般资料及纳入、排除标准见表1。
1.2 试验器材 本研究所用的便携式PID由美国RAE Systems公司提供,型号ppbRAE plus VOC,由主机(含传感器及紫外线灯)、采样管及水阱过滤器组成,是一种快速准确测定气体中VOCs浓度的仪器。工作环境温度-10~40℃,湿度0%~95%(无冷凝);呼出气干燥器采用不锈钢材料自行制作,内以干燥棉填充。仪器间采用聚四氟乙烯管和硅胶管连接(图1)。


图1 PID检测设备
1.3 方法 (1)将PID开机调试,受试者晨起空腹状态,用清水清洁口腔后待测。先用PID测定环境空气中VOCs浓度,作为背景VOCs浓度,记为Evoc;(2)受试者于处置室取坐位或仰卧位平静呼吸0.5 h,用力吸气后将呼出气直接通过吹气口匀速吹入PID中直至用力呼气末,然后通过PID检测屏直接读出连续测量过程中VOCs浓度的最大值,作为校正前总VOCs浓度,记为Tvoc;(3)受试者呼出气总VOCs记为Pvoc,Pvoc=Tvoc-Evoc,即为本试验收集的目标数据。为最大限度收集患者的全部呼出气体信息,以上操作重复测量3次,取最高值作为检测结果并记录。
1.4 统计学处理 数据采用SPSS17.0软件包进行分析,因所收集数据为非正态资料,所有数据采用中位数(四分位间距)[M(Q)]表示,多组间的比较采用Kruskal-Wallis H秩和检验,各组间的两两比较采用Mann-Whitney U秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同疾病组与健康对照组Pvoc的比较 经检测,Pvoc在对照组为4800.00(2915.00) ppb,肺癌组为4060.00(1450.00) ppb,肺炎组为2958.00(1842.00)ppb,肺纤维化组为3056.00(2851.00)ppb,COPD组为3580.00(1458.00)ppb。与健康对照组相比,肺癌组(Z=-2.523,P=0.012)、肺炎组(Z=-4.281,P<0.001)、肺纤维化组(Z=-3.204,P=0.001)及COPD组(Z=-2.644,P=0.008)Pvoc测定结果均明显降低,差异均有统计学意义。
2.2 不同疾病组之间Pvoc结果比较 将肺癌组、肺炎组、肺纤维化组和COPD组各组进行Kruskal-Wallis H秩和检验,经检验发现各组间的差异无统计学意义(H=1.867,P=0.601)。进一步应用Mann-Whitney U秩和检验对各疾病组进行两两对比发现:肺炎组(Z=-1.167,P=0.243)、肺纤维化组(Z=-1.182,P=0.237)、COPD组(Z=-0.601,P=0.548)与肺癌组相比,肺纤维化组(Z=-0.336,P=0.737)、COPD组(Z=-0.508,P=0.611)与肺炎组相比,肺纤维化组与COPD组相比(Z=-0.601,P=0.548),Pvoc测定结果差异均无统计学意义。
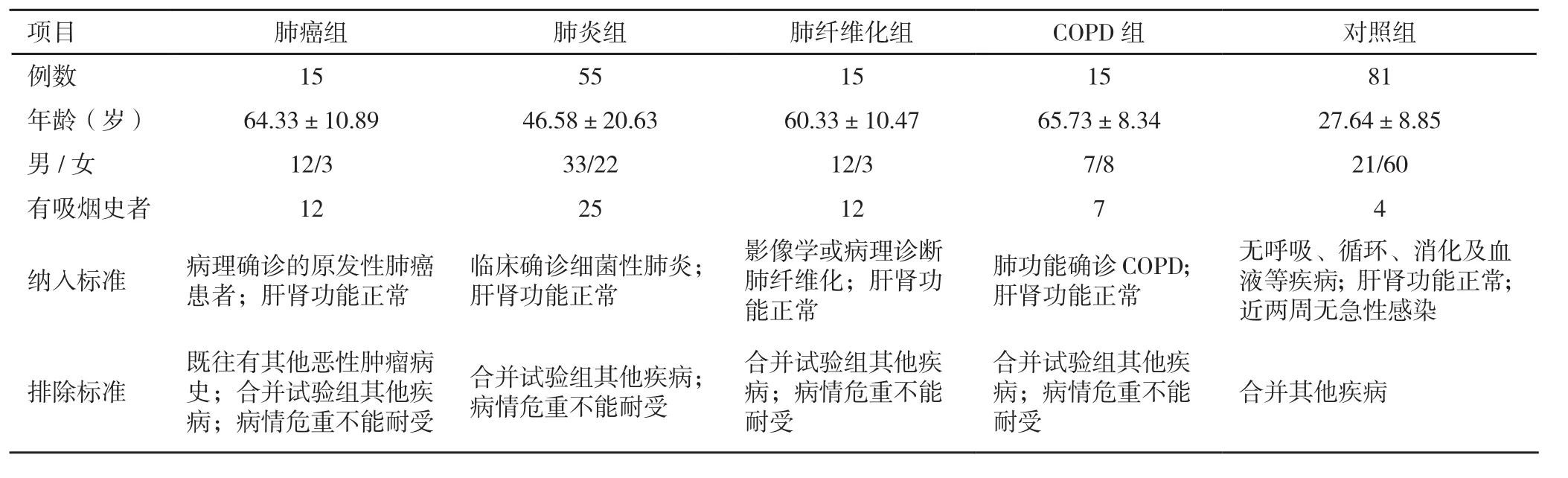
表1 一般资料及纳入、排除标准在各研究组的情况(x± s)
3 讨 论
目前已有学者对哮喘、COPD、肺癌、肝癌、心绞痛等多种疾病患者的呼出气成分进行了研究[4],且多采用气相色谱、电子鼻等技术对呼出气中某一特定VOCs成分进行检测。
本研究发现,肺癌组、肺炎组、肺纤维化组和COPD组Pvoc均显著低于对照组,差异均有统计学意义。但肺癌组、肺炎组、肺纤维化组、COPD组各组间Pvoc的比较并无统计学差异,不能将各组一一鉴别开来。分析原因,肺癌患者的VOCs不是单独地由肿瘤组织产生,而是肿瘤在发生和发展过程中引起机体一系列代谢紊乱而产生的[5]。肺泡上皮细胞的持续损伤是肺纤维化发病的关键环节,氧化应激及上皮细胞凋亡等多种机制均参与肺纤维化的发生和发展[6]。而COPD与肺炎等肺部炎性病变中存在的氧化应激是导致病情加重的重要因素。虽然上述疾病中或多或少存在氧化应激过程,导致机体代谢的紊乱与代偿,进而产生相应的VOCs。从理论上讲,其代谢产生的VOCs应有所增加。然而这些VOCs在人体正常生理代谢过程中也可产生,如饱和烷烃可通过脂质过氧化作用产生;异戊二烯主要产生于胆固醇合成的中间步骤;醛酮化合物中最重要的丙酮则来源于肝中乙酰辅酶 A的去羰基作用[7]。虽然目前关于肺癌及肺部感染性疾病特征性标志物的研究层出不穷,也找出了一些特征性VOCs[8,9]。但由于人体微生物及代谢产物的复杂多样及个体差异存在,即使某一代谢途径导致某种挥发性有机物的浓度增加,同时因另一代谢途径的抑制,而使其他VOCs的产生减少,最终导致了呼出气中总VOCs的浓度变化不大。因此,呼出气中单个组分或成分VOCs浓度可能在不同疾病间存在差异,但是不能通过总VOCs浓度反映这种差异。因而,呼出气总VOCs浓度的测定对于呼吸系统疾病早期识别并无帮助。
综上所述,应用PID测定呼出气总VOCs对呼吸系统疾病早期诊断无价值。今后的研究方向应重点关注具体单一VOCs成分。由于PID主要用于工业领域,将其应用于临床,是一种VOCs研究方法学上的尝试,无任何既往资料可供参考,所以本研究在方法学上可能会存在不足。另外,本研究存在对水蒸汽的处理仅采用简单的物理干燥法、样本量较小等不足之处,在今后的研究中,将进一步对PID方法学的细节进行不断完善,并扩大样本量等进一步评价该方法的临床价值,使PID这一无创、便捷的VOCs检测技术在临床医学领域发挥应有的价值。
[1]李雯雯,段忆翔.人体呼出气分析的技术进展及其在非侵入式医学诊断方面的临床应用前景[J].化学进展,2015,27(4):321-335.
[2]宋 耕,秦 涛,刘 虎,等.早期肺癌患者呼气中痕量挥发性有机化合物的定量检测[J].安徽医科大学学报,2008,43(3):323-325.
[3]李绚梅.部分细菌和真菌特征性挥发性有机物的研究[D].杭州:浙江大学,2012.
[4]黄冬薇,张德明,王露霞,等.革兰阴性菌挥发性有机物的检测与分析[J].重庆医学,2013,42(11):1224-1225.
[5]Hakim M,Broza Y Y,Barash O,et al.Volatile organic compounds of lung cancer and possible biochemical pathways[J].Chem Rev,2012,112(11):5949-5966.
[6]du Bois R M.Strategies for treating idiopathic pulmonary fibrosis[J].Nat Rev Drug Discov,2010,9(2):129-140.
[7]张 晨,赵美萍.人体呼出气中挥发性有机化合物的检测方法[J].化学进展,2010,22(1):140-147.
[8]Fuch P,Loeseken C,Schubert K J,et al.Breath gas aldehydes as biomarkers of lung cancer[J].Int J Cancer,2010,126(11):2663-2670.
[9]黄冬薇,张德明,王露霞,等.挥发性有机物检测应用于下呼吸道感染病原菌诊断价值的探讨[J].中国现代医学杂志,2013,23(34):40-44.
(2016-01-19收稿 2016-03-01修回)
(责任编辑 付 辉)
Research on the correlation between total volatile organic commpounds level in exhale gas and respiratory disease
LIU Jingsha1,SUO Shuang2,GAO Hongmei1,CHEN Wenli1,CHEN Xian1,ZHANG Ye1,TAN Qinghai1,GU Ye1,and ZHANG Jianpeng1.1.Department of Internal Respiratory,General Hospital of Chinese People’s Armed Police Forces,Beijing 100039,China;2.Department of Respiratory,Beijing Mentougou District Hospital,Beijing 102300,China
ZHANG Jianpeng,E-mail:zjp99@vip.sina.com
Objective To explore the correlation between volatile organic conmpounds (VOCs)concentration in human exhale gas and disease,in order to direct early diagnosis of disease.Methods 100 cases of patients with respiratory diseases one a first grade tertiary hospital of Chinese People’s Armed Police Forces were selected as research subjects,and divided into four groups:lung cancer group (n=15),pneumonia group (n=55),pulmonary fibrosis group (n=15)and chronic obstructive pulmonary diseases (COPD)group (n=15);81 cases of healthy medical staff were selected as the control group.Total VOCs concentration in exhaled gas (labeled Pvoc)of all subjects were detected by photoionization detector (PID).Results Compared with the control group,Pvoc of lung cancer group (Z=-2.523,P=0.012),pneumonia group (Z=-4.281,P<0.001),pulmonary fibrosis group (Z=-3.204,P=0.001)and COPD group (Z=-2.644, P=0.008)were obviously decreased,the differences were all statistically significant.Comparison of Pvoc in any two groups of lung cancer group,pneumonia group,pulmonary fibrosis group and COPD group,there were no statistical significance.Conclusions Total VOCs concentration in exhale gas detected by PID has no contribution to the diagnosis of lung cancer,pneumonia,pulmonary fibrosis and COPD.
volatile organic compounds;respiratory disease;photoionization detector
R563
10.13919/j.issn.2095-6274.2016.04.003
刘静莎,硕士研究生在读,
E-mail:liujingsha880102@126.com
1.100039 北京,武警总医院呼吸内科;
2.102300,北京门头沟区医院呼吸科
张健鹏,E-mail:zjp99@vip.sina.com

