氨溴索对大鼠肺组织中氟康唑药物浓度的影响Δ
陈桂林,翁春梅, 刘广军,杜贯涛(常州市第二人民医院药学部,江苏 常州 213003)
氨溴索对大鼠肺组织中氟康唑药物浓度的影响Δ
陈桂林*,翁春梅#, 刘广军,杜贯涛(常州市第二人民医院药学部,江苏 常州213003)
DOI10.14009/j.issn.1672-2124.2016.03.032
摘要目的:建立测定大鼠肺组织中氟康唑的高效液相色谱-紫外吸收检测(HPLC-UV)法,探讨氨溴索对大鼠肺组织中氟康唑药物浓度的影响。方法:将实验大鼠按随机数字表法分为A、B组,每组各10只,A组大鼠首日经尾静脉给予72 mg/kg注射用氟康唑,以后给予1日36 mg/kg;B组大鼠先经胃灌注给予6 mg/kg氨溴索,1日2次,上午给予氨溴索30 min后给予注射用氟康唑。连续给药2 d后,第3日给予氟康唑后2 h对大鼠颈静脉取血后解剖,取肺组织备用。采用HPLC-UV法同时测定最后一次使用氟康唑后2 h大鼠的肺组织浓度。结果:氟康唑线性范围均为2.5~80 μg/ml之间,回归方程为X=0.052C-0.027 6,相关系数r=0.999 9。A组大鼠肺组织氟康唑的浓度(28.1±19.6)μg/ml,B组为(26.6±17.7)μg/ml,2组的差异无统计学意义(P<0.05)。结论:氨溴索对肺组织中的氟康唑药物浓度无显著影响,但尚需结合临床实际行进一步的研究。
关键词氟康唑; 氨溴索; 药物浓度; 高效液相色谱一紫外吸收检测法
Effects of Ambroxol on Concentration of Fluconazole in Rat Lung TissueΔ
CHEN Guilin, WENG Chunmei, LIU Guangjun, DU Guantao (Dept.of Pharmacy, Changzhou the Second People’s Hospital, Jiangsu Changzhou 213003, China)
ABSTRACTOBJECTIVE:To establish a HPLC-UC method of fluconazole and explore effects of ambroxol on concentration of fluconazole in rat lung tissue. METHODS: Rats were divided into group A and group B via the random number table, with 10 cases in each. And group A were treated with 72 mg/kg fluconazole injection by caudal vein in the first day, followed by 36 mg/kg for a day during the latter treatment. Group B received 6 mg/kg ambroxol by abomasum infusion, twice a day, and after the administration of ambroxol for 30 min in the morning, fluconazole injection was given. After administration of 2 d, 2 h after administration of fluconazole in the 3rdday, the blood was drawn from jugular vein of rats and then anatomy was conducted, lung tissue of rats were taken. HPLC-UV method was adopted to determine the concentration of rat lung tissue 2 hours after injecting fluconazole in the last administration. RESULTS: The calibration curve was linear with the logarithm of concentration range of 2.5~80 μg/ml of fluconazole ,he linear equation wasX=0.052C-0.027 6, the correlation coefficientr=0.999 9.The concentration of fluconazole in the lung tissue of group A was(28.1±19.6)μg/ml, and in group B was(26.6±17.7)μg/ml, the difference was not statistically significant(P<0.05). CONCLUSIONS: Ambroxol has no significant effect on concentration of fluconazole in the lung tissue, yet it still needs the further research combined with the clinical practice.
KEYWORDSFluconazole; Ambroxol; Drug concentration; HPLC-UC method
近年来,由于大剂量广谱抗菌药物的长期应用及造血干细胞移植、实体器官移植的广泛开展,侵袭性肺部真菌感染的发病率明显上升。目前,已知侵袭性肺部真菌感染最常见的致病菌为念珠菌,初始治疗时首选氟康唑[1]。然而,氟康唑的广泛使用导致了白念珠菌耐药性的逐年增加[2-3]。有报道称,氨溴索能明显增加氨苄西林、阿莫西林、红霉素等多种抗菌药物在肺组织中的药物浓度[4],临床常见氟康唑与氨溴索联合使用,但至今无氨溴索对氟康唑在肺组织中药物浓度影响的报道。本研究以大鼠作为研究对象,通过测定大鼠肺组织中氟康唑的浓度,探讨氨溴索对氟康唑肺转运作用的影响,为临床合理用药提供科学依据,现报告如下。
1材料
1.1仪器与设备
高效液相色谱仪,包括waters2695泵,2487紫外检测器,Empower 2工作站(美国waters公司); N-EVAP氮吹仪(美国Organomation 公司);Allegra.TM. 21R型台式冷冻离心机(美国贝克曼库尔特有限公司);Milli-Q纯水机(美国Mllipore公司);XH-C型旋涡混合器(江苏省金坛市医疗仪器厂)。
1.2药品与试剂
氟康唑对照品(中国药品生物制品检定所,批号:100314-200503)。非那西丁对照品(中国药品生物制品检定所,批号:100095-200204);氨溴索片(常州市第四制药厂,规格:30 mg,批号:20110524);注射用氟康唑(山东罗欣药业股份有限公司,批号:1106231,规格:0.1 g) 乙腈为色谱纯;冰醋酸、氨水为分析纯,水为超纯水。
1.3实验动物
实验动物为健康SD大鼠,提质量220~240 g,由南京医科大学实验动物中心提供,动物合格证号SCXK(苏)2002-0031。
1.4方法
1.4.1色谱条件:色谱柱 MERCK Purospher C18(4.6×150 mm,5 μm),Phenomenex ODS 预柱(4 mm×3 mm);流动相为0.02 5mol/L,磷酸二氢钾缓冲液(三乙胺调节pH为6.1)∶乙腈=(V∶V=75∶25),检测波长260 nm,流速1 ml/min,柱温35 ℃;进样量20μl。
1.4.2药物制备:精密称取氟康唑10.0 mg置于25 ml容量瓶中,加甲醇,即得400μg/ml的标准储备液。精密称取内标物非那西丁10.0 mg 置10 ml容量瓶中,加甲醇摇匀,即得1 000μg/ml的储备液,两种储备液同置4 ℃冰箱中保存。
1.4.3样品处理:精密吸取2 ml肺组织匀浆于5 ml离心管内,加入8 μg/ml非那西丁标准溶液20 μl,涡旋混匀15 s,加入4 ml乙酸乙酯,涡旋震荡2 min,4 000 r/min离
心10 min,取上清液3 ml于10 ml尖底试管内,40 ℃水浴中氮气流吹干,残渣用150 μl流动相溶解,取20μl进行高效液相测定。
1.5动物模型
取大鼠20只,雌雄各半,按随机数字表法分为A、B组各10只。A组大鼠首日经尾静脉给予72 mg/kg注射用氟康唑,以后每日给予36 mg/kg;B组大鼠先经胃灌注给予6 mg/kg氨溴索,1日2次,上午给予氨溴索30 min后给予注射用氟康唑(氟康唑给药剂量及方法同A组)。连续给药2 d后,第3日给予氟康唑后2 h,对A、B两组大鼠颈静脉取血后解剖,取肺组织备用。取肺组织的方法:术前在大鼠腹腔注射10%水合氯醛30 mg/kg,待大鼠麻醉后固定四肢,仰卧位固定于操作台上。打开胸腔,心脏穿刺放血处死,然后结扎右侧肺门,取大鼠右肺,用冰冷的0.9%氯化钠注射液冲洗3次,洗去凝血块,用滤纸吸干后称质量,按质量(W)/体积(V)=1/10的比例加入预冷的0.9%氯化钠注射液,置于超声粉碎器中15 min,制成10%肺组织匀浆,4层纱布过滤后,取组织匀浆液保存于-80 ℃冰箱中待测。
1.6统计学方法
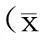
2结果
2.1方法专属性
在上述色谱条件(1.4.1)下,氟康唑、非那西丁分离后所得色谱图见图1。

A 空白肺组织;B 空白肺组织+氟康唑+非那西丁;C 肺组织样品(1-氟康唑;2-非那西丁)A Blank lung tissue; B Blank lung tissue+Fluconazole+phenacetin; C Lung tissue sample(1-Fluconazole;2-Phenacetin)图1 大鼠肺组织高效液相色谱图Fig 1 HPLC chromatograms of rat lung tissue
2.2线性关系及灵敏度试验
在离心管中精密加入20 μl不同浓度的氟康唑标准溶液和内标溶液(8μg/ml)20μl,再加入空白肺组织匀浆2 ml,使氟康唑的浓度分别为2.5、5.0、10.0、20.0、40.0、80.0 μg/ml的系列样品,然后操作,进样后记录样品峰与内标峰峰面积,算出比值X,以浓度C对比值X作加权直线回归计算,得出氟康唑的回归方程为X=0.052C-0.027 6,相关系数r=0.999 9;线性范围均为2.5~80 μg/ml之间。氟康唑检测限为0.2 μg/ml。
2.3回收率试验
制备含氟康唑及内标的混合肺组织样品,浓度分别为2.5、10.0、80.0 μg/ml,按操作,分别记录氟康唑峰面积与内标峰面积比值X,代入回归方程,计算方法回收率(以测得量与加入量的比值计算回收率),样品绝对回收率,以及日内变异和5 d内的日间变异结果见表1。
2.4稳定性试验
制备5份浓度为10.0 μg/ml的氟康唑的肺组织样品,冰箱冷藏5 d,按“1.4.3”项下处理样品,测定肺组织中药物浓度,考察其稳定性,结果氟康唑相对偏差<6%,未发生明显降解。
Tab 1Recovery rate and result of precision experiment
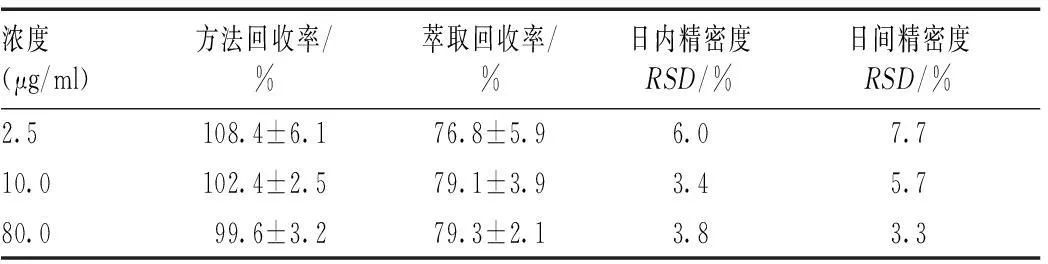
浓度(μg/ml)方法回收率/%萃取回收率/%日内精密度RSD/%日间精密度RSD/%2.5108.4±6.176.8±5.96.07.710.0102.4±2.579.1±3.93.45.780.099.6±3.279.3±2.13.83.3
2.5检测结果
对处理过的肺组织进行浓度测定后可见,A组大鼠氟康唑的肺组织浓度为(28.1±19.6) μg/ml,B组为(26.6±17.7) μg/ml,2组的差异无统计学意义(P<0.05)。

Tab 2Determination result of fluconazole in lung tissue


组别12345678910肺组织浓度A组20.928.521.018.632.129.431.027.329.727.626.6±17.7B组22.828.620.124.532.824.630.025.934.837.028.1±19.6
3讨论
3.1大鼠肺组织中氟康唑的测定方法的建立
因氟康唑和非那西丁二者分离度良好且能够与杂质峰分离,系统理论板数较高。研究结果表明,用乙酸乙酯作为提取溶剂,峰形较好,且杂质不干扰样品峰,回收率可达70%以上[5]。因此,本研究将其选为内标。建立测定大鼠肺组织中氟康唑的HPLC-UV法,以探讨氨溴索对大鼠肺组织中氟康唑药物浓度的影响。
3.2氨溴索对氟康唑药物浓度的影响
真菌感染的死亡率较高,早期诊断和治疗对患者的预后具有重要意义。临床上常用的治疗药物主要为氟康唑、氟胞嘧啶和两性霉素B等[6-7]。氟康唑是双三唑类真菌感染治疗药,可抑制麦角固醇的合成,增加真菌细胞膜的通透性,使真菌死亡达到治疗效果[8-10]。相关研究结果认为,抗菌药物在细菌感染部位组织中的浓度是决定药物疗效的主要因素,在选择敏感性抗菌药物的同时,提高其在肺内转运,尤其是感染灶中药物浓度是决定临床疗效的关键[11]。
氨溴索是临床上安全、有效的镇咳祛痰药,具有黏液溶解作用,可有效缓解呼吸道疾病的临床症状;此外,氨溴索还可促进支气管纤毛上皮的再生和功能恢复;刺激肺泡Ⅱ型细胞合成和分泌肺泡表面活性物质,防止肺泡萎缩和肺不张[12]。氨溴索还可增加抗菌药物在肺组织及其分泌物质中的浓度,提高抗菌疗效[13]。杨常菀等[14]和张志新等[15]研究结果表明,氨溴索可以增加利福平在大鼠肺组织中的浓度,并且认为氨溴索对抗菌药物肺转运的影响是非特异性的。氨溴索增加抗菌药物肺组织浓度的原因尚不明确,可能与氨溴索能够增强肺组织及呼吸道中的多种细胞活性,增强其化学驱化反应有关[16-17]。目前,临床治疗肺部疾病及真菌感染时常联合应用氨溴索和氟康唑,以达到治疗效果。但氨溴索能否增加肺组织中氟康唑的药物浓度仍不明确。本研究检测了SD大鼠肺组织中氟康唑的药物浓度,结果显示,A组大鼠肺组织浓度为(28.1±19.6)μg/ml,B组为(26.6±17.7) μg/ml,2组的差异无统计学意义(P<0.05),说明氨溴索对大鼠肺组织中氟康唑的浓度影响很小。
综上所述,氨溴索可能不会增加氟康唑在大鼠体内的肺转运,进而增加氟康唑在肺组织中的浓度,也可能不会增强其抗真菌效力,原因可能与氟康唑表观分布容积接近于体内水的总量,血浆蛋白结合率很低(约为11%~12%),能良好地透入全身体液,在肺组织中的浓度接近血药浓度等因素所致。但尚需结合临床实际进行进一步的研究。
参考文献
[1]任兵,王在义.真菌感染的诊断与治疗新进展[J].临床肺科杂志,2014,19(1):140-142.
[2]李伟铭,马厚勋.103例肺部真菌感染临床分析[J].重庆医科大学学报,2009,34(8):1112-1115.
[3]赵娜,陈虹,陶娟.侵袭性肺部真菌感染的耐药性分析及临床疗效评估[J].重庆医学,2011,40(6):576-578.
[4]翁春梅,刘广军,陈桂林,等.氨溴索对呼吸系统的保护机制及临床应用[J].药物流行病学杂志,2011,20(9):494-496.
[5]盛晓燕,熊歆,杨文领,等.RP-HPLC法测定人血清氟康唑浓度及其临床应用[J].中国新药杂志,2010,19(9):772,804.
[6]王锦华,王晓辉.重症监护室真菌感染特点及氟康唑预防治疗分析[J].中国现代医生,2013,51(18):158-160.
[7]杨维林.氟康唑对重度COPD患者进行预防性抗真菌治疗的研究[J].中外医学研究,2014,12(8):37-38.
[8]Lu LX,Zhou F,Zhou Y, et al. Expression profile analysis of the polygalacturonase-inhibiting protein genes in rice and their responses to phytohormones and fungal infection[J]. Plant Cell Reports,2012,31(7):1173-1187.
[9]覃文周.临床标本的真菌培养和药敏分析[J].广西医学,2010,32(1):116-117.
[10]张莉莉,连桂真,黄新华,等.40例院内真菌感染的临床分析[J].内科,2008,3(5):689-690.
[11]马利军,吴纪珍,牛红丽,等.氨溴索对头孢哌酮/舒巴坦肺转运作用的临床研究[J].中国新药杂志,2003,12(1):61-63.
[12]陈绍堂,欧阳长安.氨溴索注射液与其他药物配伍稳定性研究进展[J].中国保健营养,2012(3):242-243.
[13]Chen F,Zhang YX,Zhang CQ. Effect of ambroxol on the concentration of cefotaxime in the bronchoalveolar lavage fluid of rats with pulmonary fibrosis[J]. Exp Ther Med, 2015,9(2):539-542.
[14]杨常菀,张志新,屠文俊,等.氨溴索对头孢哌酮肺转运作用的临床研究[J].临床肺科杂志,2008,13(6):682,685.
[15]张志新,杨常菀,屠文俊,等.氨溴索对利福平肺转运作用的影响[J].江苏医药,2009,35(12):1486-1488.
[16]宋金春,陈杏,周妮.复方阿莫西林盐酸氨溴索血药浓度测定及药代动力学研究[J].中国药业,2013,22(4):21-23.
[17]张立超,胡晋红,李珍,等.HPLC法测定体液中氨溴索浓度及其药代动力学参数[J].西北药学杂志,2000,15(3):115-116.
(收稿日期:2015-07-24)
中图分类号R965.1
文献标志码A
文章编号1672-2124(2016)03-0366-03
#通信作者:主任药师。研究方向:临床药学。E-mail:chunmeiweng@sina.com
Δ基金项目:常州市科技计划项目(NO.CS20109012)
*主管药师。研究方向:临床药学。E-mail: chenguilin@126.com

