菊芋中菊糖的热水浸提工艺优化及抗氧化活性
乔月芳+马艳弘+张宏志+李亚辉+侯红萍+唐伯平


摘要: 研究菊芋菊糖的热水浸提法提取工艺,在单因素试验基础上,通过正交分析法优化菊糖的提取工艺,分析料液比、提取温度、提取时间对菊糖提取率的影响,并对菊糖的抗氧化活性进行分析。结果表明,菊芋菊糖的最佳提取工艺为:料液比1 g ∶ 30 mL,提取温度90 ℃,提取时间120 min,在此条件下菊糖的提取率为89.60%。所提菊糖具有较强的抗氧化活性,0.10 mg/mL浓度的菊糖对1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力最高达 91.30%,抗超氧阴离子自由基能力最高达205.59 U/L,对羟自由基的抑制率最高达96.00%。
关键词: 菊芋;菊糖;热水浸提;工艺优化;抗氧化活性
中图分类号: TS201.1 文献标志码: A 文章编号:1002-1302(2016)03-0291-03
菊芋(Helianthus tuberosus)别称洋姜、鬼子姜或姜不辣,为菊科向日葵属宿根性草本植物,具有抗旱、耐低温和盐碱等生理特性,尤其适合在荒漠、盐碱滩涂地种植[1],属于非耕地型经济作物。菊芋富含菊糖、多种氨基酸、维生素、果胶、有机酸、酚类化合物等营养物质,具有极高的营养价值、经济价值和开发应用前景[2]。菊芋被美国防癌协会列为30种有防癌作用的蔬菜之一,菊糖是其中最主要的功能成分,其干物质含量占菊芋块茎的70%以上,是由D-果糖经β(2→l)糖苷键脱水聚合而形成的呈线形直链状结构的天然果聚糖[3],是超强的双歧杆菌增殖增效因子,具有降血脂、调节血糖、调节肠道功能、预防结肠癌、促进金属离子吸收、增强免疫功能等营养保健功效[4-6],还具有低热量、脂质感、凝胶性、保湿性、稳定性等优良的理化特性[7],已被40多个国家批准为功能食品,被广泛应用于乳制品、面包、糖果、饮料、调味料等食品加工领域。
目前国内市场上的菊糖大多采用菊苣为原料来制备,而以菊芋为原料的菊糖生产尚处于起步发展阶段。尽管有报道认为微波、超声辅助法提取菊糖技术具有提取率高、速度快、安全无污染等优点[8-10],但大多不适合产业化生产。因此,本试验采用热水浸提法提取菊芋菊糖,采用正交试验法优化菊糖提取工艺,并探讨菊糖抗氧化活性,为寻求科学高效的菊糖提取技术途径及解决菊糖生产技术难题提供科学依据。
1 材料与方法
1.1 材料与试剂
菊芋,由江苏大丰盐土大地农业科技有限公司提供;1,1-二苯基-2-三硝基苯肼(DPPH),上海源叶生物科技有限公司;羟自由基测定试剂盒、抗超氧阴离子自由基测定试剂盒,南京建成生物工程研究所;葡萄糖、3,5-二硝基水杨酸、氢氧化钠、浓硫酸、苯酚、4水酒石酸钾钠、无水亚硫酸钠等均为分析纯试剂,购自国药集团化学试剂有限公司。
1.2 试验仪器
FW100高速万能粉碎机,天津市泰斯特仪器有限公司;DHG-9070电热鼓风干燥箱,上海齐欣科学仪器有限公司;HJ-6A多头磁力搅拌器,常州国华仪器有限公司;XW-80A型旋涡混合器,海门市其林贝尔仪器制造有限公司;D-B5型紫外可见分光光度计,上海奥析科学仪器有限公司;DDL-1kW电子调温电炉,常州市伟嘉仪器制造有限公司;JJ-500电子天平,常熟市双杰测试仪器厂;TGL-16B台式离心机,上海安亭科学仪器厂;RE6000型旋转蒸发仪,上海亚荣生化仪器厂;ZD-F12真空冷冻干燥机,南京载智自动化设备有限公司。
1.3 试验方法
1.3.1 菊芋菊糖的提取 将新鲜菊芋清洗干净,切成约 2 mm 厚的薄片,铺于鼓风干燥箱中,于60 ℃烘干至恒质量,经高速万能粉碎机粉碎后过60目筛。准确称取一定量的菊芋干粉于锥形瓶中,在不同料液比、不同提取时间、不同提取温度下提取菊糖,离心得菊糖粗提取液,添加新鲜饱和石灰水调节pH值为10左右,放入70 ℃恒温水浴保温10 min,冷却至室温再用磷酸调pH值为7左右,离心得除杂后的菊糖提取液。在除杂提取液中加入0.4%高温活化处理过的活性炭粉末,混合均匀后于50 ℃恒温水浴保温10 min,冷却至室温后抽滤[11-12],上清液于50 ℃旋转蒸发浓缩,最后经冷冻干燥即可。
1.3.2 菊芋菊糖提取单因素试验设计 以菊芋菊糖提取率为考察目标,考察热水浸提法提取菊糖时不同料液比、提取时间、提取温度对菊芋菊糖提取率的影响,提取条件的单因素试验设计见表1。
1.3.3 菊芋菊糖提取正交试验设计 根据单因素试验结果,采用L9(34)正交试验设计方案,以料液比、提取温度、提取时间为试验因素,以菊糖提取率为指标优化工艺条件。试验因素水平见表2。
1.3.4 菊糖提取率的测定 采用DNS试剂法测定提取液还原糖含量,苯酚-硫酸法测定提取液总糖含量,菊糖提取率的计算方法为:
菊糖提取率=[总糖质量(g)-还原糖质量(g)]/菊芋质量(g)×100%。
1.3.5 菊芋菊糖抗氧化活性检测[13-15]
1.3.5.1 DPPH自由基清除能力测定 配制0.02、0.04、0.06、0.08、0.10 mg/mL的菊芋菊糖溶液,各取2 mL于具塞试管中,每管加入2 mL 2×10-4 mol/L DPPH溶液,摇匀后避光放置30 min,分别测定517 nm处的吸光度D517 nm。DPPH自由基清除率计算公式为:
DPPH清除率=[1-(Di-Dj)/Dc] ×100%。
式中Di为2 mL样品溶液+2 mL DPPH溶液的吸光度;Dj为2 mL样品溶液+2 mL蒸馏水的吸光度;Dc为2 mL DPPH溶液+2 mL蒸馏水的吸光度。
1.3.5.2 抗超氧阴离子自由基能力测定 配制0.02、0.04、0.06、0.08、0.10 mg/mL的菊芋菊糖溶液,按试剂盒说明书操作。超氧阴离子自由基清除能力计算公式为:
抗超氧阴离子自由基能力(U/L)=(D550 nm(对照组)-D550 nm(标准组))/(D550 nm(对照组) -D550 nm(测试组))×标准品浓度(mg/mL)×1 000 mL。
1.3.5.3 清除羟自由基能力测定 配制0.02、0.04、0.06、0.08、0.10 mg/mL的菊芋菊糖溶液,按试剂盒说明书操作。羟自由基抑制能力计算公式如下:
羟自由基抑制率=(D550 nm(对照组)-D550 nm(测试组))/D550 nm(对照组)×100%。
2 结果与分析
2.1 单因素试验结果与分析
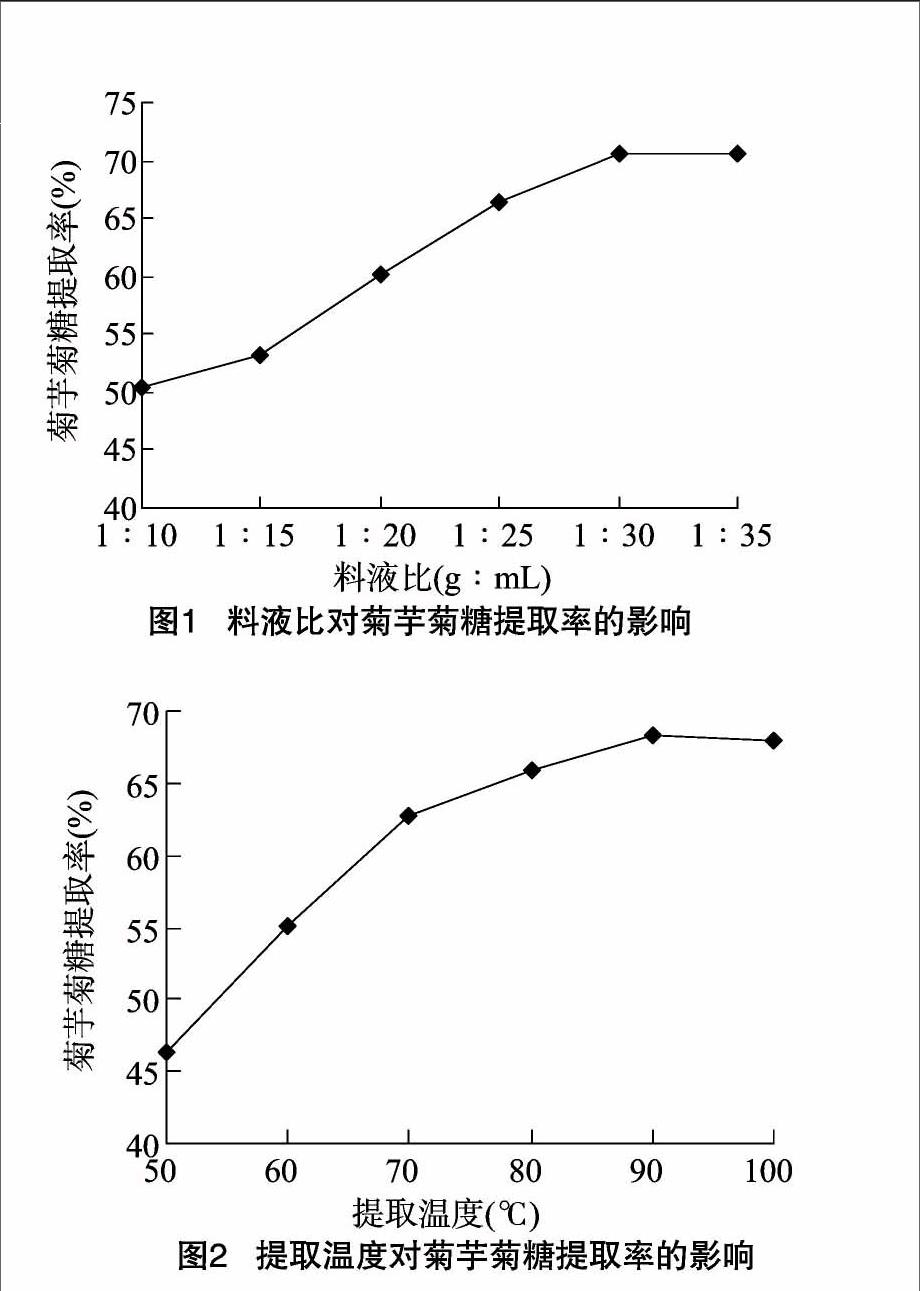
2.1.1 料液比对菊芋菊糖提取率的影响 如图1所示,在料液比1 g ∶ 10 mL~1 g ∶ 30 mL范围内,随料液比逐渐增大,菊糖提取率逐渐增高;当料液比达到1 g ∶ 30 mL后,继续增大提取溶剂量,提取率提高极其缓慢。这可能是因为随着提取溶剂量的增大,细胞内部的多糖物质向外扩散速度提高。溶剂量过大会加重后续浓缩负担从而导致成本的增加,因此,综合考虑确定菊糖提取最佳料液比为1 g ∶ 30 mL。
2.1.2 提取温度对菊芋菊糖提取率的影响 如图2所示,50~90 ℃范围内,随着提取温度的提高,提取率逐渐升高;当温度大于90 ℃后,菊糖提取率呈下降趋势。表明在一定范围内,温度越高越有利于菊糖的溶解,但是温度太高既增加菊糖提取能耗,又可导致菊糖轻微降解。因此,可确定90 ℃为适宜的提取温度。
2.1.3 提取时间对菊芋菊糖提取率的影响 如图3所示,在提取时间30~120 min以内,菊糖提取率随着提取时间的延长而逐渐提高;超过120 min后,提取率逐渐趋于平缓。表明提取时间越长,菊糖在溶液中溶解得越多,当时间超过 120 min 后,菊糖溶出基本达到平衡。因此,120 min为菊糖提取的适宜时间。
2.2 正交试验结果
在单因素试验基础上,采用L9(34)正交试验优化菊糖提取工艺,结果见表3。由极差分析可知,各因素对菊糖提取率的影响不同,提取温度对菊糖提取率影响最大,其次是料液比,提取时间对菊糖提取率的影响最小,即:B>A>C。最佳工艺组合为A3B3C2,即料液比为1 g ∶ 30 mL、提取温度 90 ℃,提取时间120 min,此条件下菊糖提取率高达89.60%。
2.3 菊芋菊糖抗氧化活性分析
2.3.1 清除DPPH 自由基能力 检测菊糖对DPPH自由基的清除能力。如图4所示,随着菊糖浓度的增加,对DPPH自由基清除能力不断增强,在0.10 mg/mL浓度时,菊糖对 DPPH 自由基清除能力最高,为91.30%。
2.3.2 抗超氧阴离子自由基能力 如图5所示,随样品溶液浓度的增加,抗超氧阴离子自由基能力不断增强。在0.02~0.10 mg/mL浓度范围内,菊糖抗超氧阴离子自由基能力上升趋势明显,在0.10 mg/mL浓度时,菊糖抗超氧阴离子自由基能力最高,达 205.59(U/L)。
2.3.3 抑制羟自由基能力 如图6所示,随样品溶液浓度的增加,菊芋菊糖对羟自由基抑制率不断提高,在0.04~0.10 mg/mL 浓度范围内,其抑制率趋于平衡,在0.10 mg/mL浓度时,抑制率最高,达96.00%。
3 结论
在单因素试验基础上,通过正交分析法优化了菊芋菊糖提取工艺,得到最佳提取条件为:料液比1 g ∶ 30 mL,提取温度90 ℃,提取时间120 min,在此条件下菊芋菊糖的提取率为89.60%。通过DPPH自由基清除能力、抗超氧阴离子自由基能力、羟自由基抑制能力发现,所提取的菊芋菊糖有较强的抗氧化能力,其DPPH自由基清除能力最高达91.30%,抗超氧阴离子自由基能力最高达205.59(U/L),羟自由基抑制率最高达96.00%。
参考文献:
[1]胡素琴,蔡飞鹏,王建梅,等. 菊芋的种植和开发利用[J]. 生物质化学工程,2012,46(1):51-54.
[2]Bach V,Clausen M R,Edelenbos M. Chapter 12-Production of Jerusalem artichoke (Helianthus tuberosus L.) and impact on inulin and phenolic compounds[M]//Preedy V. Processing and Impact on Active Components in Food. US:Academic Press,2015:97-102.
[3]殷 洪,林学进. 菊粉、低聚果糖的研究进展[J]. 中国食品添加剂,2008(3):97-101.
[4]Ellegard L,Anderson H,Bosaeus I. Inulin and oligofructose do not influence the absorption of cholesterol,or the excretion of cholesterol,Ca,Mg,Zn,Fe,or bile acids but increase energy excretion in ileostomy subjects[J]. European Journal of Clinical Nutrition,1997,51(1):1-5.
[5]Baba S,Ohta A,Ohtsuki M,et al. Fructooligosacch-arides stimulate the absorption of magnesium from the hindgut in rats[J]. Nutrition Research,1996,16(4):657-666.
[6]Nair K K,Kharb S,Thompkinson D K. Inulin dietary fiber with functional and health attributes-a review[J]. Food Reviews International,2010,26(2):189-203.
[7]Arango O,Trujillo A J,Castillo M. Predicting coagulation and syneresis parameters of milk gels when inulin is added as fat substitute using infrared light backscatter[J]. Journal of Food Engineering,2015,157:63-69.
[8]张泽生,张建平,王 浩,等. 菊芋菊糖的超声波提取、纯化及HPLC法纯度检测[J]. 食品工业科技,2009,30(6):260-262.
[9]徐 鑫,陈小辉,刘国艳,等. 微波辅助法提取牛蒡根中菊糖的研究[J]. 食品科学,2007,28(10):207-210.
[10]陈秀枝,沈辰婷,曹未音,等. 菊芋中菊糖提取方法的比较[J]. 江苏农业科学,2013,42(11):312-313,314.
[11]吴洪新,阿拉木斯,张存莉,等. 活性炭法用于菊苣菊粉脱色的研究[J]. 安徽农业科学,2008,36(7):2626-2628.
[12]李丹丹,金征宇. 牛蒡菊糖脱色工艺的研究[J]. 农业工程学报,2007,23(8):241-244.
[13]牟建楼,王 颉. 响应面法优化灵芝枣饮料工艺及其抗氧化性研究[J]. 中国食品学报,2013,13(11):21-27.
[14]陈莉华,龙进国,谭林艳,等. 红果参多糖的提取纯化及抗氧化活性研究[J]. 天然产物研究与开发,2013,25(2):170-173.
[15]Li X X,Han L J,Chen L J. In vitro antioxidant activity of protein hydrolysates prepared from corn gluten meal[J]. Journal of the Science of Food and Agriculture,2008,88(9):1660-1666.

