聚乙烯亚胺介导Bmk CT基因抑制C6胶质瘤细胞C-Myc、VEGF表达
张亚涛,范丽娜,温春丽,胡风云*
(1.山西中医学院,山西 太原 030024;2.山西省人民医院,山西 太原 030012)
聚乙烯亚胺介导Bmk CT基因抑制C6胶质瘤细胞C-Myc、VEGF表达
张亚涛1,范丽娜1,温春丽2,胡风云2*
(1.山西中医学院,山西 太原030024;2.山西省人民医院,山西 太原030012)
[摘要]目的:应用阳离子聚合物聚乙烯亚胺(polyethyleneimine, PEI)介导东亚钳蝎氯离子通道毒素(Buthus martensii Karsch Chlorotoxin-like Toxin,Bmk CT)基因转染C6胶质瘤细胞,观察其对C6细胞内C-Myc、VEGF表达的影响。方法:将PEI分别和pEGFP-N1-Bmk CT、pEGFP-N1质粒混合,获得PEI/pEGFP-N1-Bmk CT和PEI/pEGFP-N1两种复合物,将其转染C6细胞,MTS法观察细胞增殖和存活活力,48 h后通过Western-blot方法检测C-Myc、VEGF蛋白表达水平。结果:PEI/pEGFP-N1-Bmk CT转染C6细胞48 h后较PEI/pEGFP-N1能够显著抑制C6细胞增殖和存活活力,同时抑制C-Myc、VEGF蛋白表达。结论:PEI/pEGFP-N1-Bmk CT转染C6细胞可能通过抑制C-Myc、VEGF表达进而抑制C6细胞增殖和血管生成。
[关键词]Bmk CT;胶质瘤;C-Myc ;VEGF
脑胶质瘤在神经外胚层脑肿瘤中最为常见,发生率约占颅内肿瘤的40%。美国癌症协会统计,美国每年有24 000人被诊断患有这种疾病,大约75%的患者在被检出的当年死亡[1]。脑胶质瘤具有高浸润性和侵袭性,与正常脑组织之间没有明显界限,手术很难完全切除[2]。蝎氯毒素(chlorotoxin, CTX)能特异性阻断神经胶质瘤所特有的氯离子通道,进而抑制胶质瘤的迁移和侵袭,同时不影响正常脑细胞[3]。东亚钳蝎氯离子通道毒素(Buthus martensii Karsch Chlorotoxin-like Toxin,Bmk CT)是CTX的第一个类似物,与其有68%的同源性,具有相似的生物学功能[4]。BmK CT作用于C6细胞可抑制MMP2的酶活性及蛋白分泌水平,进而抑制胶质瘤细胞的侵袭力[5, 6]。纯化的重组BmK CT蛋白腹腔注射于C6/SD荷瘤鼠能够抑制肿瘤细胞的增殖和迁移[7]。BmK CT蛋白获得困难、价格昂贵,基因转染是解决途径之一。本项研究采用非病毒载体阳离子聚合物PEI转染重组质粒pEGFP-N1-Bmk CT于C6胶质瘤细胞,观察Bmk CT基因对于胶质瘤细胞C-Myc、VEGF表达的影响。
1材料
C6细胞购于中国协和医科大学基础医学研究所细胞中心。阳离子聚合物聚乙烯亚胺(polyethyleneimine, PEI)购于南京慧基公司。DMEM(GIBCO公司),FBS(GIBCO公司),CellTiter 96 Aqueous One Solution Cell Proliferation Assay(MTS)(Promega 公司),C-Myc抗体(CST公司)、VEGF抗体(Abcam公司)。
2细胞培养
C6细胞培养采用含10%胎牛血清的DMEM培养基,将其置于37℃、5%CO2(体积分数)、饱和湿度的培养箱中传代培养。
3实验方法
3.1MTS实验
3.1.1基因转染取对数生长期C6细胞,胰酶消化后接种于96孔板,调节细胞密度为8×103个/孔,分为pEGFP-N1-Bmk CT组和pEGFP-N1组,每组5个复孔。24 h后,进行基因转染。取0.2 μg pEGFP-N1-Bmk CT质粒和0.6 μL PEI置于30 μLPBS溶液中,混匀,获得PEI/pEGFP-N1-Bmk CT复合物。同样方法制备PEI/pEGFP-N1复合物,室温静置20 min。两种复合物中分别加入50 μL完全培养基;弃去96孔板中原有培养基,将两者分别加入不同组中。6 h后每孔补加120 μL完全培养基。
3.1.2观察荧光蛋白表达转染24 h,将细胞在荧光显微镜下观察,拍照。
3.1.3测定OD值 转染24 h和48 h后每孔加入20 μL的MTS溶液,30 min后酶标仪读取OD值,波长490 nm。
3.2Western-blot 实验
取对数生长期C6细胞胰酶消化后接种于6孔板,调节细胞密度为2.5×105个/孔,分为pEGFP-N1-Bmk CT组和pEGFP-N1组。24 h后,进行基因转染。取2.5 μg pEGFP-N1-Bmk CT质粒和7.5 μL PEI置于200 μLPBS溶液中,混匀,获得200 μL PEI/pEGFP-N1-Bmk CT复合物。同样方法制备PEI/pEGFP-N1复合物,室温静置20 min。两种复合物中分别加入500 μL完全培养基;弃去6孔板中原有培养基,将两者分别加入不同组中。6 h后每孔补加1 500 μL完全培养基。转染后48 h,每孔细胞中加入含有磷酸酶和蛋白酶抑制剂的RIPA裂解液150 μL,刮掉细胞,冰上裂解30 min,10 000 rpm离心10 min,提取细胞总蛋白。取上清,lowry法进行蛋白定量。进行SDS-聚丙烯酰胺凝胶电泳、湿转,5%脱脂奶粉封闭1 h, C-Myc、VEGF抗体1∶1 000稀释,4℃孵育过夜,室温下孵育二抗1 h,ECL显影。
4统计学方法
5结果
5.1基因转染后EGFP蛋白表达情况
pEGFP-N1-Bmk CT和pEGFP-N1转染C6细胞后,均有EGFP蛋白表达,如图1,证明基因转染成功。
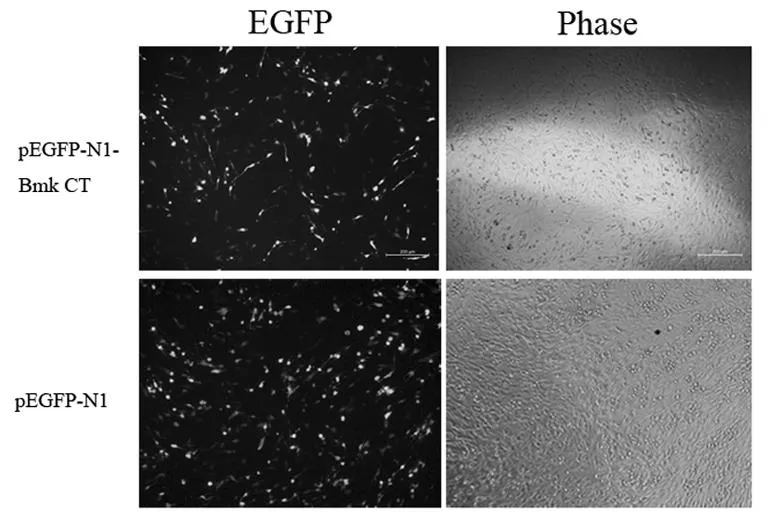
图1 基因转染后绿色荧光蛋白表达图
5.2基因转染后对C6细胞增殖和存活活力的影响
pEGFP-N1-Bmk CT和pEGFP-N1转染C6细胞后,MTS结果显示,24 h两者无统计学差异(P>0.05),48 h前者能明显抑制C6细胞增殖和存活活力(P<0.05),如图2,证明PEI转染Bmk CT基因在体外可以抑制C6细胞存活。
5.3基因转染后C-Myc、VEGF蛋白表达水平变化
pEGFP-N1-Bmk CT和pEGFP-N1转染C6细胞48 h后,Western-blot检测结果显示pEGFP-N1-Bmk CT组C-Myc、VEGF蛋白表达水平显著下调(P<0.05),如图3。
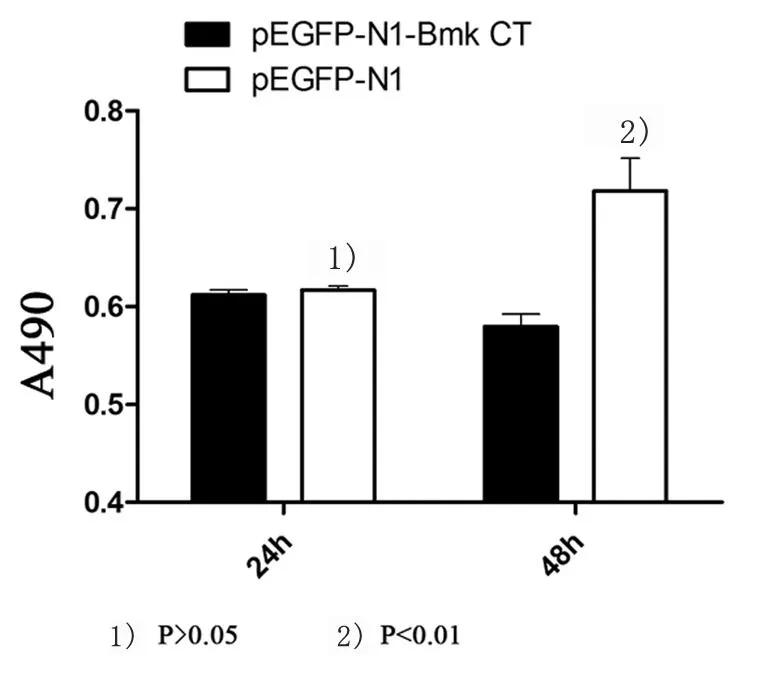
图2 pEGFP-N1-Bmk CT降低C6细胞增殖和存活活力
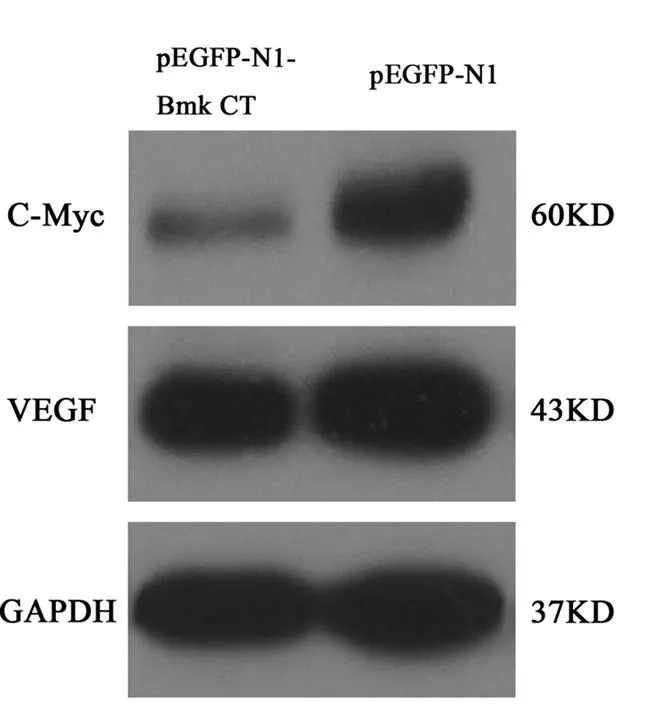
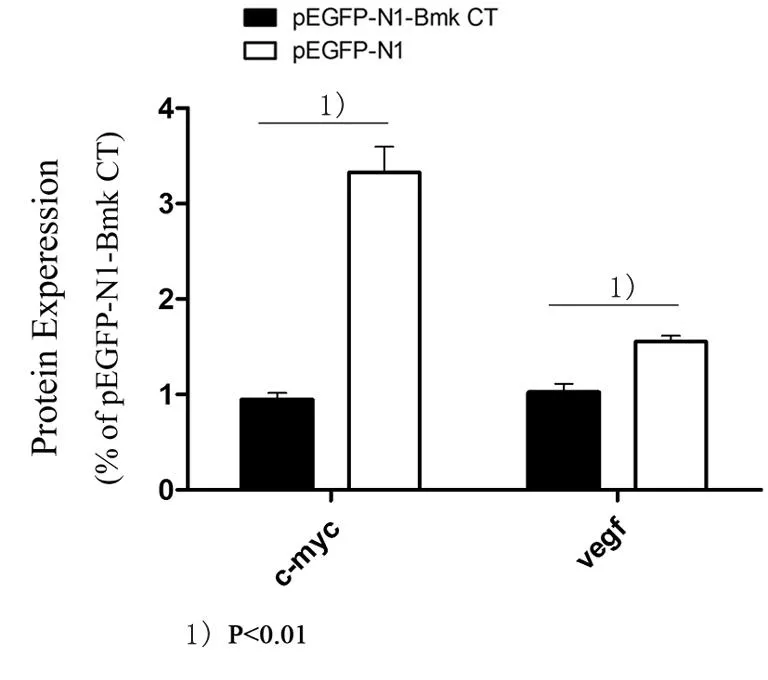
图3 基因转染后C-Myc、VEGF蛋白表达水平
6讨论
手术结合放疗和化疗的标准治疗并不能显著改善神经胶质瘤患者的生存问题,基因治疗胶质瘤作为一种新的治疗策略是对胶质瘤治疗的有益补充[8]。基因治疗相对于蛋白药物治疗可以降低免疫原性,防止蛋白降解,降低成本。非病毒基因载体克服了病毒载体存在的免疫原性高、靶向性差、目的基因容量小等缺点,具备免疫原性低、安全性高、可重复利用的优点[9]。阳离子聚合物PEI具有较强的DNA结合和保护能力,因独特的“质子海绵效应”被作为阳离子聚合物基因载体性能评价的参照标准[10]。PEI便于进行生物适用性改性,目前改进的生物可降解PEI,能够降低其毒性。
Bmk CT在体内外均可抑制胶质瘤细胞的增殖[10],但是对于其中机理的探讨尚浅。在本项研究中PEI/pEGFP-N1-Bmk CT转染C6细胞较PEI/pEGFP-N1能显著抑制细胞增殖和存活活力(P<0.05)。同时pEGFP-N1-Bmk CT和pEGFP-N1转染C6细胞48 h后,Western-blot检测结果显示pEGFP-N1-Bmk CT组C-Myc、VEGF蛋白表达水平显著下调,说明Bmk CT基因抑制C6胶质瘤细胞增殖可能与C-Myc、VEGF相关。C-Myc与肿瘤的发生、增殖和分化都有密切关系,C-Myc蛋白具有DNA结合能力,能够促进DNA的复制[11]。C-Myc在恶性胶质瘤细胞中过度表达[12]。于如同等[13]用C-Myc反义寡核苷酸(C-Myc ASON)注射原位胶质瘤大鼠瘤区,能够抑制胶质细胞增殖,同时出现较多凋亡细胞。C-Myc蛋白能促使肿瘤细胞由G1期向S期转化,这促进了肿瘤细胞的增殖。抑制C-Myc蛋白表达就能抑制肿瘤细胞从G1期向S期转化[12]。VEGF在胶质瘤中存在过度表达[14]。VEGF是目前认为最能直接参与诱导肿瘤血管形成的因子之一[15]。新生血管的生成不仅能促进肿瘤的增长,而且加剧了肿瘤的浸润和转移[16]。VEGF可通过增加微小血管的通透性增加血浆蛋白渗出,为新生血管形成提供营养支持,也增加了组织水肿[17]。C-Myc能够触发并增加VEGF的表达,它的活性对于维持VEGF的表达是必不可少的。C-Myc基因的缺失可导致血管内皮生长因子的表达降低,血管生成停滞,说明Bmk CT基因可能通过抑制C-Myc,进而抑制VEGF表达水平,抑制胶质瘤细胞的增殖和血管新生。
PEI介导的Bmk CT基因能够抑制C6细胞增殖和存活活力,降低C-Myc、VEGF蛋白表达水平,显示出良好的治疗前景,为胶质瘤的治疗提供了新的途径。
[参考文献]
[1]Venneti S, Thompson CB.Metabolic Modulation of Epigenetics in Gliomas[J].Brain Pathol,2013, 23(2):217-221.
[2]Preusser M, de Ribaupierre S, Wohrer A,etal.Current Concepts and Management of Glioblastoma[J].Ann Neurol,2011, 70(1):19-21.
[3]Deshane J, Garner CC, Sontheimer H.Chlorotoxin Inhibits Glioma Cell Invasion Via Matrix Metalloproteinase-2[J].J Biol Chem, 2003,278(6):4135-4144.
[4]Fu Y, Jiao Y, An N, Liang A.pEGFP-N1-mediated BmK CT Expression Suppresses the Migration of Glioma.Cytotechnology[J].2013, 65(4):533-539.
[5]孙娜, 赵晋华, 乔文礼, 等.(125)I-BmK CT对胶质瘤细胞侵袭的影响[J].核技术, 2013,36(8):50-53.
[6]孙娜, 赵晋华, 乔文礼, 等.BmK CT对胶质瘤细胞侵袭的影响及机制研究[J].上海医学影像,2012,21(4):249-251.
[7]Fan S, Sun Z, Jiang D,etal.Bmk CT Toxin Inhibits Glioma Proliferation and Tumor Metastasis[J].Cancer Lett,2010, 291(2):158-166.
[8]Du J, Fu Y, Wang J,etal.Adenovirus-mediated Expression of BmK CT Suppresses Growth and Invasion of Rat C6 Glioma Cells[J].Biotechnol Lett,2013, 35(6):861-870.
[9]David S, Pitard B, Benoit JP,etal.Non-viral Nanosystems for Systemic siRNA Delivery[J].Pharmacol Res,2010, 62(2):100-114.
[10]Yamano S, Dai J, Hanatani S,etal.Long-term Efficient Gene Delivery Using Polyethylenimine with Modified Tat Peptide[J].Biomaterials,2014,35(5):1705-1715.
[11]Graves JA, Wang Y, Sims-Lucas S,etal.Mitochondrial Structure, Function and Dynamics are Temporally Controlled by C-Myc[J].PLoS One,2012,7(5):37699.
[12]De Salvo M, Maresca G, D'agnano I,etal.Temozolomide Induced C-Myc-mediated Apoptosis Via Akt Signalling in MGMT Expressing Glioblastoma Cells[J].Int J Radiat Biol, 2011, 87(5):518-533.
[13]于如同, 白永文, 高文昌.C-Myc反义寡核苷酸对大鼠脑胶质瘤细胞凋亡及增殖作用[J].江苏医药, 2004, 30(11):1-3.
[14]Li Q, Qiao G, Ma J,etal.Downregulation of VEGF Expression Attenuates Malignant Biological Behavior of C6 Glioma Stem Cells[J].Int J Oncol, 2014,44(5):1581-1588.
[15]Guo WY, Zhang DX, Li WJ,etal.Akt-centered Amplification Loop Plays a Critical Role in Vascular Endothelial Growth Factor/Stromal Cell-derived Factor 1-alpha Cross-talk and Cardioprotection[J].Chin Med J (Engl), 2011, 124(22):3800-3805.
[16]Baker GJ, Yadav VN, Motsch S,etal.Mechanisms of Glioma Formation:Iterative Perivascular Glioma Growth and Invasion Leads to Tumor Progression, VEGF-independent Vascularization, and Resistance to Antiangiogenic Therapy[J].Neoplasia, 2014,16(7):543-561.
[17]Jiang YS, Wang FR.Caloric Restriction Reduces Edema and Prolongs Survival in a Mouse Glioma Model[J].J Neurooncol, 2013, 114(1):25-32.
本文编辑:王知平
Expression of Polyethyleneimine-mediated Bmk CT Gene Inhibitation to VEGF and C-Myc in C6 Glioma Cells
ZHANG Yatao1,FAN Lina1,WEN Chunli2,HU Fengyun2*
(1.ShanxiUniversityofTraditionalChineseMedicine,Taiyuan030024,ShanxiProvince,China;2.ShanxiProvincialPeople'sHospital,Taiyuan030012,ShanxiProvince,China)
[ABSTRACT]Objective:To investigate the effects of PEI (polyethyleneimine)-mediated Bmk CT (Buthus martensii Karsch Chlorotoxin-like Toxin),Bmk CT gene transfection on the expression levels of C-Myc and VEGF of C6 glioma cells.Methods:pEGFP-N1 and pEGFP-N1-BmK CT were combined with PEI to form the composites, PEI/pEGFP-N1-Bmk CT and PEI/pEGFP-N1, which were used to transfect C6 glioma cells.Then, MTS test was performed to investigate the proliferation and viability of the transfected cells.After 48 hours the expression of C-Myc and VEGF proteins were detected by Western-bloting.Results: The proliferation of C6 glioma cells in the pEGFP-N1-Bmk CT group was significantly inhibited, while the expression levels of C-Myc and VEGF were lower than pEGFP-N1 group after the transfection.Conclusion: PEI/pEGFP-N1-Bmk CT may suppress the angiogenesis and the proliferation of C6 glioma cells through inhibiting the expression of C-Myc and VEGF.
[KEYWORDS]Bmk CT; Glioma; C-Myc; VEGF
[中图分类号]Q78
[文献标识码]A
[文章编号]1671-0126(2016)01-0007-04
[作者简介]张亚涛,男,中医内科学中医药防治脑病方向硕士研究生在读[通讯作者]胡风云,女,主任医师,E-mail:fengyun71@163.com

