COPD模型大鼠气道黏液高分泌机制及健脾益肺化痰方干预作用*
刘 娟,钟相根,邓秀兰,李 配,齐明月,赵娜妹
北京中医药大学基础医学院,北京 100029
COPD模型大鼠气道黏液高分泌机制及健脾益肺化痰方干预作用*
刘 娟,钟相根,邓秀兰△,李 配,齐明月,赵娜妹
北京中医药大学基础医学院,北京 100029
目的:观察健脾益肺化痰系列方对慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)模型大鼠的防治作用及其机制。方法:采用单纯香烟烟熏法建立COPD大鼠模型。将60只Wistar雄性大鼠随机分为正常组、模型组、健脾益肺化痰方组、健脾益肺方组、化痰方组和羧甲司坦组,每组10只。健脾益肺化痰方组、健脾益肺方组、化痰方组和羧甲司坦组大鼠分别给予相应的药物灌胃治疗,正常组和模型组灌胃等体积纯净水。用酶联免疫测定法(ELISA)检测各组大鼠肺泡灌洗液(BALF)中黏蛋白5AC(MUC5AC)、黏蛋白5B(MUC5B)、白细胞介素1β(IL-1β)、环氧化酶2(COX2)、转化生长因子α(TGF-α)、前列腺素E2(PGE2)的含量。结果:与正常组比较,模型组大鼠肺泡灌洗液(BALF)中MUC5AC、MUC5B、IL-1β、COX2、TGF-α、PGE2含量显著升高(P<0.05)。与模型组比较,健脾益肺化痰组、健脾益肺组、化痰组大鼠肺泡灌洗液(BALF)中MUC5AC、MUC5B、IL-1β、COX2、TGF-α、PGE2含量均降低(P<0.05)。结论:健脾益肺化痰系列方中以标本兼治的健脾益肺化痰方尤为突出,能降低COPD模型大鼠肺泡灌洗液中MUC5AC、MUC5B、IL-1β、COX2、TGF-α、PGE2的含量,抑制气道黏液高分泌传导通路,使气道结构重塑,改善气道通气状况,最终改善COPD模型大鼠肺功能。
COPD;气道黏液高分泌;标本兼治;健脾益肺化痰系列方
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以气道不完全可逆性气流受限为特征的慢性疾病,与肺部对香烟烟雾等有害气体或有害颗粒的异常炎症反应有关。COPD以气道、肺实质和肺血管的慢性炎症为特征,同时气道黏液高分泌是其重要的病理生理特征,可加重气道阻塞,并致下呼吸道感染难以控制,已被认为是影响COPD病死率和预后的独立危险因素[1]。气管、支气管杯状细胞化生是黏蛋白的主要来源,也是黏液过度分泌的结构基础。研究显示[2],黏蛋白5AC(MUC5AC)、黏蛋白C5B(MUC5B)是构成黏液的主要低聚物黏蛋白,在COPD患者中表达明显增加,MUC5AC存在于气道上皮杯状细胞,MUC5B存在于黏膜下腺体。研究表明[3-4]参与COPD对黏液分泌有作用的细胞因子和炎性介质有IL-1β、IL-4、IL-6、IL-8、IL-9、IL-13、IL-17,以 及TNF-α、EGF、前列腺素、白三烯等,且它们之间存在协同效应。目前认为杯状细胞化生及MUC5AC基因表达的关键介导环节涉及白细胞介素-1β(IL-1β)和表皮生长因子受体(EGFR)信号传导通路。
本课题在“黏液高分泌”及“痰”相关理论的指导下,采用单纯香烟烟熏建立COPD大鼠模型,以健脾益肺化痰系列方药进行干预治疗,观察发现健脾益肺化痰系列方可显著改善COPD大鼠肺功能、血气及肺组织病理状况[5],本研究拟从气道黏液高分泌角度,进一步探讨健脾益肺化痰系列方防治COPD的作用机制及针对“痰”进一步辨证论治的差异性。
1 材料与方法
1.1 实验动物SPF级健康雄性Wistar大鼠60只,体质量(180±20)g,鼠龄10~12周[购于北京维通利华实验动物公司,动物许可证号:SCXK(京) 2012-0001],于北京中医药大学实验动物中心适应性饲养7天。
1.2 实验用药实验用中药材全部购自北京同仁堂医药药材有限公司,经北京中医药大学药用植物教研室鉴定。生药剂量比例按原著换算,依照人单位体质量生药量求得大鼠单位体质量生药量,扩大10倍。各组药物分别以纯净水煎煮30分钟,提取2次。再合并煎液,并将所得药液用双层纱布过滤,水浴加热蒸发浓缩,贮于冰箱中备用。羧甲司坦组予羧甲司坦(北京曙光药业股份有限公司生产,批号:H11021036,规格:250 mg×12片×2板/盒)500 mg/kg灌胃,剂量参考文献[6]。
1.2.1 健脾益肺化痰方 由四君子汤、玉屏风散、二陈汤加桔梗化裁方组成。药物组成:党参15 g,茯苓15 g,白术10 g,炙甘草5 g,黄芪15 g,防风6 g,半夏10 g,陈皮10 g,桔梗10 g。
1.2.2 健脾益肺方 四君子汤合玉屏风散组成。药物组成:党参15 g,茯苓15 g,白术10 g,炙甘草5 g,黄芪15 g,防风6 g。
1.2.3 化痰方 即二陈汤加桔梗化裁方,药物组成:半夏10 g,陈皮10 g,茯苓15 g,炙甘草5 g,桔梗10 g。
1.3 仪器与试剂大前门牌香烟(烤烟型,焦油量12 mg,烟气烟碱量0.9 mg,烟气一氧化碳含量14 mg);自制动物熏烟箱(60 cm×50 cm×40 cm);自动切片机、自动包埋机;温控仪鼓风干燥箱(上海跃进医疗器械厂);高精度可调节移液器,枪头(白枪头、黄枪头、蓝枪头);吸水纸(自备);电热恒温培养箱(上海益恒实验仪器有限公司生产);TECAN全波长酶标仪(Thermo生产,Multiskan MK3);离心机(Tomy Seiko生产);试管及离心管,容量瓶,蒸馏水。
1.4 实验方法
1.4.1 实验分组及给药 将60只Wistar大鼠随机分为正常组、模型组、健脾益肺化痰方组、健脾益肺方组、化痰方组、羧甲司坦组,共6组,每组10只。模型组于吸烟造模12周后每天给予等体积纯净水灌胃,各给药组于吸烟第13周起于每日上午吸烟前半小时给予相应药物灌胃;正常组每天给予等体积纯净水灌胃。
1.4.2 COPD大鼠模型建立 参考文献[7]方法,采用单纯香烟烟熏法复制COPD大鼠模型。模型组及各给药组大鼠放入自制被动吸烟玻璃熏箱,箱顶留有通气孔,燃烧大前门牌香烟,由三通管导入烟雾。1次熏烟燃烧大前门香烟12支,每支香烟约产生烟雾1 L,烟雾浓度约5%,持续0.5小时,每日吸烟2次,上下午各1次,每周5天,连续16周。1.4.3 实验取材 实验大鼠在末次给药后,禁食12小时,4%戊巴比妥钠腹腔麻醉。随机挑选等量的各实验组动物,行正中切口,气管插管,进行生理盐水支气管肺泡灌洗3次,5 mL/次。待注入生理盐水后,轻轻按摩肺组织30秒,回收支气管肺泡灌洗液(BALF),记录回收的灌洗液量(保证回收率>80%)。将回收的BALF离心(3 000 r/min,4℃) 10分钟,用于ELISA检测。
1.4.4 酶联免疫测定法(ELISA) 检测大鼠肺泡灌洗液中MUC5AC、MUC5B、IL-1β、COX2、TGF-α、PGE2的含量。
1.4.4.1 试剂盒组成 酶标板:12条×8孔;标准品:2瓶(冻干品);生物素标记抗体:1×120 μL/瓶;辣根过氧化物酶标记亲和素:1×120 μL/瓶;生物素标记抗体稀释液:1×15 mL/瓶;辣根过氧化物酶标记亲和素稀释液:1×15 mL/瓶;样本稀释液:1× 50 mL/瓶;浓洗涤液:1×20 mL/瓶;底物溶液:1× 10 mL/瓶;终止液:1×10 mL/瓶;板贴:4张;密封袋:1个。
1.4.4.2 操作步骤 1)将各种试剂移至室温(18~25℃)平衡至少30分钟,按各自试剂配制方法配制试剂以备用;2)加样:分别设标准品孔、待测样本孔。每孔分别加标准品或待测样本100 μL,轻轻晃动混匀,覆上板贴,37℃温育2小时;3)弃去液体,甩干,不用洗涤;4)每孔加生物素标记抗体工作液100 μL,覆上新的板贴,37℃温育1小时;5)弃去孔内液体,甩干,洗板3次。每次浸泡2分钟,200 μL/孔,甩干;6)每孔加辣根过氧化物酶标记亲和素工作液100 μL,覆上新的板贴,37℃温育1小时;7)弃去孔内液体,甩干,洗板5次。每次浸泡2分钟,200 μL/孔,甩干;8)依序每孔加底物溶液90 μL,37℃避光显色15~30分钟;9)依序每孔加终止液50 μL,终止反应;10)在反应终止后5分钟内用酶标仪在450 nm波长依序测量各孔的光密度。
1.5 统计学方法数据采用SPSS 17.0统计软件分析,计量资料以(±s)表示,多组样本间均数的比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
模型组大鼠肺泡灌洗液中MUC5AC、MUC5B、IL-1β、COX2、TGF-α、PGE2的含量均显著升高,与正常组比较差异有统计学意义(P<0.05)。健脾益肺化痰组、健脾益肺组、化痰组大鼠肺泡灌洗液中MUC5AC、MUC5B、IL-1β、COX2、TGF-α、PGE2的含量均降低,与模型组比较差异有统计学意义(P<0.05)。3组中药给药组之间比较,健脾益肺化痰组(标本兼治组)COPD模型大鼠炎症因子IL-1β、TGF-α的含量下降较明显,化痰组(治标组)次之,健脾益肺组(治本组)COPD模型大鼠IL-1β、TGF-α含量下降最低。健脾益肺化痰组(标本兼治组)COPD模型大鼠炎症因子COX2、PGE2的含量下降较明显,健脾益肺组(治本组)次之,化痰组(治标组)COPD模型大鼠COX2、PGE2含量下降最低,见表1—2。
表1 各组大鼠肺泡灌洗液中MUC5AC、MUC5B的含量(±s) pg/mL
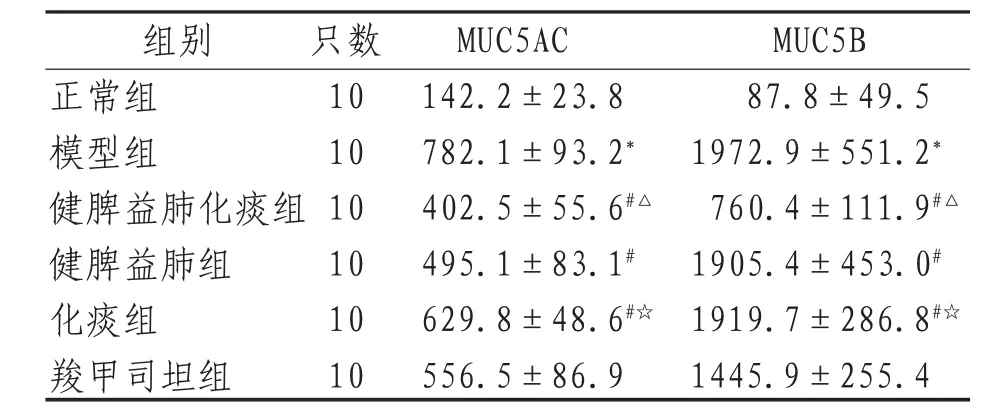
表1 各组大鼠肺泡灌洗液中MUC5AC、MUC5B的含量(±s) pg/mL
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05;☆表示与健脾益肺组比较,P<0.05;△表示与化痰组比较,P<0.05。
组别 只数 MUC5AC MUC5B正常组 10 142.2±23.8 87.8±49.5模型组 10 782.1±93.2*1972.9±551.2*健脾益肺化痰组 10 402.5±55.6#△760.4±111.9#△健脾益肺组 10 495.1±83.1#1905.4±453.0#化痰组 10 629.8±48.6#☆1919.7±286.8#☆羧甲司坦组 10 556.5±86.9 1445.9±255.4
表2 各组大鼠肺泡灌洗液中IL-1β、COX2、TGF-α、PGE2的含量(±s) pg/mL
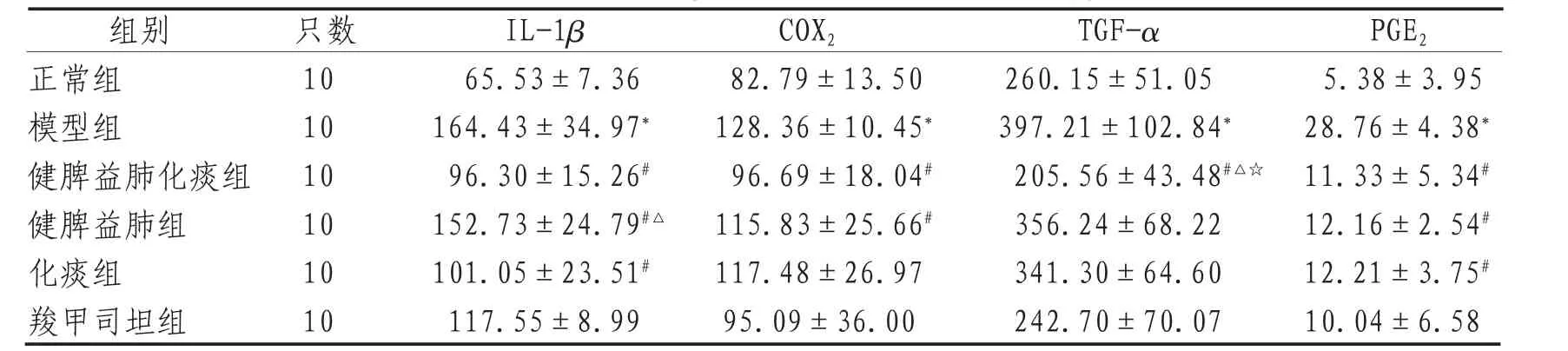
表2 各组大鼠肺泡灌洗液中IL-1β、COX2、TGF-α、PGE2的含量(±s) pg/mL
注:*表示与正常组比较,P<0.05;#表示与模型组比较,P<0.05;☆表示与健脾益肺组比较,P<0.05;△表示与化痰组比较,P<0.05。
组别 只数 IL-1β COX2TGF-α PGE2正常组 10 65.53±7.36 82.79±13.50 260.15±51.05 5.38±3.95模型组 10 164.43±34.97*128.36±10.45*397.21±102.84*28.76±4.38*健脾益肺化痰组 10 96.30±15.26#96.69±18.04#205.56±43.48#△☆11.33±5.34#健脾益肺组 10 152.73±24.79#△115.83±25.66#356.24±68.22 12.16±2.54#化痰组 10 101.05±23.51#117.48±26.97 341.30±64.60 12.21±3.75#羧甲司坦组 10 117.55±8.99 95.09±36.00 242.70±70.07 10.04±6.58
3 讨论
杯状细胞化生和黏液高分泌过度分泌是COPD气道慢性炎症的重要病理改变,过度分泌的黏液潴留于气道,加重了已经狭窄气道的阻塞,加速了肺功能的下降进程,容易导致气道内感染的发生,病情恶化。COPD气道黏液高分泌的结构基础是杯状细胞化生/增生,而IL-13、IL-1β、TNF-α信号通路参与刺激诱导了杯状细胞的化生/增生。此外,EGFR信号转导通路是诸多刺激因子诱导MUC5AC基因表达的共同通路,多种刺激物可通过NE/TNF-α/TGF-α/EGFR等信号途径,上调MUC5AC基因转录和MUC5AC生成[8]。IL-1β激活COX2/PGE2;经MAPK激活细胞外信号调节激酶1/2(extracellular signal-regulated kinasel1/2,ERK1/2)和p38-MAPK途径,激活环磷酸腺苷(cAMP)反应元件结合蛋白(CREB),从而诱导MUC5AC基因的表达[9 ]。
COPD属中医学“肺胀”“咳嗽”“喘证”“痰饮”范畴,在对其病证病机的认识中,始终重视痰的作用[10-13];在治疗过程中,也积极化痰,大多以益气健脾化痰法为原则[14]。中医学认为“脾为生痰之源,肺为贮痰之器”,肺脾气虚,津液不化,痰浊潴留,伏痰形成;外邪引动伏痰,引发COPD。结合现代医学与中医学对本病进行较为全面的研究[15],认识到现代医学的“气道黏液高分泌”就是中医学的“痰”。相关临床研究[16-18]表明,健脾益肺化痰系列方治疗稳定期COPD患者,具有减轻临床症状,减少急性发作频率,改善呼吸功能等作用。药理研究[19]表明,健脾益肺化痰系列方具有增强机体免疫功能、抗变态反应、抗菌抗病毒、抗纤维化、增强肾上腺皮质功能等功效。临床上通过抑制黏液高分泌或化痰,可以有效缓解COPD的发病[20-21]。本实验选用健脾益肺化痰方及其拆方,从气道黏液高分泌角度探讨其作用机制,并着重对比分析“健脾益肺化痰标本兼治”的干预作用。
综上所述,健脾益肺化痰系列方中以标本兼治的健脾益肺化痰方尤为突出,可以通过抑制COPD气道上皮杯状细胞化生及黏液高分泌信号转导,从而抑制气道黏液高分泌,使气道结构重塑,改善气道通气状况,最终改善COPD模型大鼠肺功能。这可能是健脾益肺化痰标本兼治法改善COPD大鼠肺功能的效应机制之一,可为临床使用健脾益肺化痰系列方防治COPD提供了部分实验依据。
[1] Mac Nee W.Pathogenesis of chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2005,2(4):258-266.
[2] Kirkham S,Sheehan JK,Knight D,et al.Heterogeneity of airways mucus:variations in the amounts and glycoforms of the major oligomeric mucins MUC5AC and MUC5B[J].Biochem J,2002,361(3):537-546.
[3] Takeyama K,Jung B,Shim JJ,et al.Activation of epidermal growth factor receptors is responsible for mucin synthesis induced by cigarette smoke[J].Am J Physiol Lung Cell Mol Physiol,2001,280(1):165-172.
[4] 钟相根,李宇航,祝小惠.慢性阻塞性肺疾病气道黏液高分泌机制及中医药干预作用[J].中华中医药杂志,2011,26(8):1686-1689.
[5] 李配,邓秀兰,钟相根,等.健脾益肺化痰方对慢性阻塞性肺疾病模型大鼠肺组织病理的影响[J].中华中医药学刊,2015,33(6):1330-1332.
[6] 孙丽.羧甲司坦对慢性被动吸烟大鼠气道细菌负荷的影响及相关机制的研究[D].沈阳:中国医科大学,2010.
[7] 李配.基于标本兼治“化痰”的健脾益肺化痰方对COPD大鼠气道黏液高分泌的干预作用及其差异研究[D].北京:北京中医药大学,2015.
[8] Kim ST,Ye MK,Shin SH.Effects of Asian and dust on mucin gene expression and activation of nasal polyp epithelial cells[J].Am J Rhinol Allergy,2011,25(5):303-306.
[9] Cosio MG,Saetta M,Agusti A.Immunologic aspects of chronic obstructive pulmonary disease[J].N Engl J Med,2009,360(23):2445-2454.
[10]王振伟,杨佩兰,沈丽,等.百部养肺煎膏治疗COPD稳定期患者的临床研究[J].西部中医药,2015,28(5):56-59.
[11]王慧卿,李跃进.痰热清注射液治疗慢性阻塞性肺病急性加重期42例[J].河北中医,2008,30(8):870.
[12]李竹英,郅扶旻,刘文波.益气健脾化痰法对COPD稳定期患者肺功能及免疫功能的影响[J].中医药信息,2014(1):51-53.
[13]王兰娣,潘文.沙美特罗替卡松联合益气养阴合剂治疗轻症及缓解期COPD 36例[J].西部中医药,2012,25(5):76-77.
[14]孙朔.健脾化痰法治疗慢性阻塞性肺疾病的临床观察[J].中国中医基础医学杂志,2010,16(2):143-144.
[15]钟相根,祝小惠,郑子安,等.论“痰”在慢性阻塞性肺疾病发病及治疗中的重要性[J].中华中医药杂志,2012,27(12):3159-3161.
[16]吴蕾,林琳,许银姬,等.健脾益肺Ⅱ号治疗慢性阻塞性肺疾病稳定期178例临床研究[J].中医杂志,2011,52(17):1465-1468.
[17]Li SY,Li JS,Wang MH,et al.Effects of comprehensive therapy based on traditional Chinese medicine patterns in stable chronic obstructive pulmonary disease:a four-center,open label,randomized,controlled study[J].BMC Complement Alternat Med,2012,12(1):1-11.
[18]杨珺超,王真,楼雅芳,等.益气健脾颗粒剂联合西药治疗慢性阻塞性肺疾病稳定期肺脾气虚型60例临床观察[J].中医杂志,2013,54(22):1933-1936.
[19]王本祥.现代中药药理学[M].天津:天津科学技术出版社,1997:1144-1147.
[20]杨峰,敖素华.清热化痰法对气道黏液高分泌大鼠气道炎症影响机制[J].辽宁中医药大学学报,2014,16(5):21-24.
[21]王胜,熊玲玲,任薇,等.益气健脾方对慢性阻塞性肺疾病模型大鼠气道炎症和气道黏液高分泌的影响[J].中国中西医结合杂志,2015,35(8):993-999.
Airway Mucus Hypersecretion Mechanism in Rat with COPD Model and Intervention Process of Tonifying the Spleen and Nourishing the Lung as well as Eliminating Phlegm
LIU Juan,ZHONG Xianggen,DENG Xiulan△,LI Pei,QI Mingyue,ZHAO Namei College of Basic Medical Sciences,Beijing University of Chinese Medicine,Beijing 100029,China
A
1004-6852(2016)11-0011-04
2016-01-14
国家自然科学基金资助项目(编号81173314,81473666);国家中医药管理局中医药重点学科基本科研项目(编号2013-ZDXKKF-03)。
刘娟(1987—),女,在读硕士研究生。研究方向:呼吸系统疾病的中医药防治。
△通讯作者:邓秀兰(1963—),女,硕士学位,副教授。研究方向:呼吸系统疾病的诊治。

