环介导等温扩增技术早期诊断结核性脑膜炎的研究
孙雯雯 肖和平
·论著·
环介导等温扩增技术早期诊断结核性脑膜炎的研究
孙雯雯 肖和平
目的 评价环介导等温扩增(LAMP)技术快速检测脑脊液标本中结核分枝杆菌对于结核性脑膜炎(TBM)早期诊断的价值。 方法 收集上海市肺科医院于2014年1月至2015年12月收治的200例疑诊为TBM的患者在行抗结核药物治疗前的脑脊液标本,分别采用结核分枝杆菌涂片法(简称“涂片法”)、BACTECTMMGIT液体960培养法(简称“MGIT 960培养法”)、实时荧光定量聚合酶链反应(RTFQ PCR)法和LAMP技术检测脑脊液标本中结核分枝杆菌。使用SPSS 17.0软件进行统计学分析,计算LAMP技术诊断TBM的敏感度、特异度、阳性预测值、阴性预测值; 4种检测方法阳性检出率的比较采用χ2检验,以P<0.05为差异具有统计学意义;LAMP技术与其他3种检测方法检测的一致性评价采用Kappa检验。结果 200例患者中临床确诊为结核性脑膜炎者172例(86.00%),4种检测方法(涂片法、MGIT 960培养法、LAMP法,RTFQ PCR)对诊断结核性脑膜炎的敏感度分别为2.91%(5/172)、12.79%(22/172)、43.02%(74/172)、34.30%(59/172)。LAMP法与涂片法、MGIT960培养法比较,敏感度均明显增高,差异有统计学意义(χ2=75.11,P=0.000;χ2=43.88,P=0.002);与RTFQ PCR法比较,敏感度差异无统计学意义(χ2=2.08,P=0.130)。LAMP技术对诊断结核性脑膜炎的特异度分别为92.86%(26/28),其他3种检测方法均为100.00%(28/28)。LAMP技术与RTFQ PCR、MGIT 960培养法、涂片法检测结核性脑膜炎一致性总体符合率与Kappa系数分别为88.50%(177/200)、0.87;71.00%(142/200)、0.73;63.50%(127/200)、0.59。结论 LAMP 技术在诊断结核性脑膜炎患者中具有较高的敏感度、特异度,与MGIT960培养法及RTFQ PCR法具有较高的一致性,对于结核性脑膜炎的早期诊断具有一定的临床价值。
结核, 脑膜; 诊断; 实验室技术和方法; 核酸扩增技术; 对比研究
结核性脑膜炎(tuberculous meningitis,TBM)患者临床表现缺乏特异性,病原学阳性检出率极低,国内报道脑脊液(cerebro-spinal fluid,CSF)结核分枝杆菌(MTB)检出率仅为12.3%[1]。TBM患者的CSF改变多不典型,易与新型隐球菌性脑膜炎、病毒性脑膜炎等相混淆,故早期诊断存在困难。环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术检测结核分枝杆菌复合群(Mycobacteriumtuberculosiscomplex,MTBC)是一种新型的核酸扩增方法,该方法无需昂贵的设备和严格的实验室环境条件,具有方法简单、反应快速灵敏等优点。目前,国内外已有研究者做了一些有益的探索[2],但应用LAMP技术检测CSF中结核分枝杆菌的研究极为少见,于霞等[3]在采用LAMP技术检测临床标本结核分枝杆菌的系统评价中指出,纳入全球18项研究中17项为痰标本,因此临床上针对LAMP技术在CSF结核分枝杆菌检测方面的应用价值缺乏较大样本量的研究。本研究收集200例上海市肺科医院于2014年1月至2015年12月收治的疑诊为结核性脑膜炎患者在行抗结核药物治疗前的CSF标本,分别采用结核分枝杆菌抗酸染色涂片法(简称“涂片法”)、BACTECTMMGIT 960液体培养法(简称“MGIT 960培养法”)、实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ PCR)、LAMP法检测标本中结核分枝杆菌,对所得结果进行统计学分析,以评价LAMP技术对结核性脑膜炎早期诊断的价值。
资料和方法
一、一般资料
选取上海市肺科医院于2014年1月至2015年12月收治的疑诊为结核性脑膜炎并拟行抗结核药物治疗的患者200例。根据诊断标准、排除标准最终临床确诊为结核性脑膜炎患者(简称“TBM组”)172例,其中男108例(62.79%),女64例(37.21%),年龄16~78岁,平均年龄为(38.6±22.8)岁;排除结核性脑膜炎的患者(简称“非TBM组”)28例,其中男19例(67.86%),女9例(32.14%),年龄为21~76岁,平均年龄为(42.8±24.5)岁。28例非TBM组患者中,16例为病毒性脑膜炎、6例为细菌性脑膜炎、4例为隐球菌脑膜炎、2例为肺癌脑转移。收集患者抗结核药物治疗前的脑脊液标本,保存于-20 ℃冰箱内直至统一检测。经医院伦理委员会同意,所以患者均签署用于本次临床试验采取标本的知情同意书。
二、参照标准
结核性脑膜炎的诊断建立根据2010年国际TBM协作组制定的诊断标准[4],评分标准见表1。
1.临床疑诊标准为包含以下1个或多个症状或体征:发热、头痛、呕吐、易激惹、脑膜刺激征、抽搐、局灶性神经损害、意识状态改变或嗜睡。
2.结核性脑膜炎诊断标准和排除标准:(1)确诊结核性脑膜炎须符合以下标准之一:①临床入选标准+CSF抗酸染色阳性,或CSF结核分枝杆菌培养阳性,或CSF核酸扩增实验阳性;②脑(脊髓或脑膜)组织的抗酸染色阳性,且符合结核病病理变化 (多见于尸检中)。(2)很可能的结核性脑膜炎:临床入选标准+诊断评分10分(无影像学资料)或12分(有影像学资料)+排除诊断,其中至少有2分来自脑脊液检测或脑影像学评分。(3)可能的结核性脑膜炎:临床入选标准+诊断评分9分(无影像学资料)或6~11分(有影像学资料)+排除诊断,如未行腰椎穿刺术或头颅正电子发射计算机体层摄影术(PET)不能做此诊断。所有入组患者均经过规范抗结核药物治疗4~8周,并根据临床症状改善情况复查脑脊液、影像学等检查,并以此资料建立临床诊断,对疑诊患者抗结核药物治疗无效者均行进一步检查明确诊断。
三、检测方法
1.结核分枝杆菌抗酸染色涂片法:收集1 ml脑脊液标本进行涂片,干燥后行抗酸染色,镜检查找抗酸杆菌。操作严格按照《结核病实验室诊断检验规程》[5]和试剂说明书进行操作。
2. MGIT 960液体培养:收集经4% NaOH溶液处理的脑脊液标本1 ml,取0.1 ml接种于酸性罗氏培养基(珠海贝索生物技术有限公司产品)斜面上, 每份标本分别接种2支, 置37 ℃培养箱培养4~8周,记录培养结果。MGIT 960液体培养系统由美国 BD 公司生产。将脑脊液标本按照 BACTECTMMGIT生产规范(MGITTMProcedure Manual)要求进行培养[6]。

表1 结核性脑膜炎的临床诊断和排除诊断
3.DNA提取与LAMP技术检测:收集1.5 ml脑脊液进行结核分枝杆菌DNA提取与LAMP技术检测。针对结核分枝杆菌特异靶基因序列IS6110设计引物(所用引物)如下:
F3 5′-AGACCTCACCTATGTGTCGA-3′;B3 5′-TCGCTGAACCGGATCGA-3′;FIP 5′-ATGGAGGTGGCCATCGTGGAAGCCTACGTGGCCTTTGTCAC-3′;BIP 5′-AAGCCATCTGGACCCGCCAACCCCTATCGTATGGTG-GAT-3′;FLP 5′-AGGATCCTGCGAGCGTAG-3′; BLP 5′-AAGAAGGCGTACTCGACCTG-3′。
(1)DNA提取:采用核酸快速提取试剂盒[荣研生物科技(中国)有限公司],该试剂盒通过对样本中所含的结核分枝杆菌进行破碎处理,使细菌内所含的核酸游离到溶液中,并将得到的溶液与吸附剂试剂管中的多孔介质混合,把样本中所含的阻碍核酸扩增反应的物质去除,在通过滴注盖薄膜滤器,使核酸溶液被提取出来。操作步骤严格按试剂盒说明进行。(2)LAMP扩增:采用达安基因股份有限公司生产的结核分枝杆菌核酸扩增荧光检测试剂盒。将30 μl的核酸溶液加到反应试管中。将恒温器在67 ℃加热40 min,再用加热器进行酶的灭活,80 ℃,5 min。反应结束后将反应管上下甩动数次,使反应液中的扩增产物与预先包被在试管内壁的SYBR Green I染料混合,置于紫外线灯管下照射,阳性管发出绿色荧光,未发出荧光为阴性。操作步骤严格按试剂盒说明进行。
4.RTFQ PCR法:采用达安基因股份有限公司生产的结核分枝杆菌核酸扩增荧光检测试剂盒,实时荧光核酸扩增仪(型号DA7600),按试剂盒方法进行检测。
四、相关定义
(1)敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;(2)特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;(3)阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;(4)阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%。
五、统计学分析
采用SPSS 17.0软件将所有患者基础信息和实验室检测结果建立数据库。所有患者随访至少6个月,动态记录临床症状及体征、脑脊液检测指标、影像学表现、治疗后转归,建立最终的临床诊断。根据2010国际TBM协作组制定的诊断标准[4],选择符合确诊标准患者的CSF标本。使用SPSS 17.0软件进行数据的统计学分析,计算LAMP法诊断结核性脑膜炎的敏感度、特异度、阳性预测值、阴性预测值。对不同方法检出率的比较使用χ2检验,以P<0.05为差异具有统计学意义;进行LAMP法与其他3种检测方法的一致性检验,计算Kappa系数。Kappa系数取值在-1~+1,其值越大,说明一致性越高,Kappa系数在0.3~0.7提示一致性较好,Kappa系数>0.7说明一致性强。
结 果
一、 4种检测方法的检出情况
在最终确诊为结核性脑膜炎的172例患者中,4种检测方法(涂片法、MGIT 960液体培养法、LAMP法,RTFQ PCR法)阳性检出率分别为2.91%(5/172)、12.79%(22/172)、43.02%(74/172)、34.30%(59/172)。检出时间(中位数)结果说明,LAMP法的检出时间最短(表2)。
二、 4种检测方法检测的敏感度、特异度、阳性预测值、阴性预测值
本研究的200例患者中,LAMP诊断结核性脑膜炎的敏感度为43.02%(74/172)、特异度为92.86%(26/28)、阳性预测值为97.37%(74/76)、阴性预测值为20.97%(26/124);LAMP法与涂片法、MGIT 960培养法相比,敏感度明显增高,差异有统计学意义(χ2=75.11,P=0.000;χ2=43.88,P=0.002);与RTFQ PCR法相比,敏感度的差异无统计学意义(χ2=2.08,P=0.130)。具体见表3。
三、LAMP与其他3种方法检测结果比较
以RTFQ PCR阳性为标准,PCR阳性者LAMP的敏感度为94.92%(56/59),PCR阴性者LAMP的特异度为85.82%(121/141)。2种方法具有较强的一致性符合率88.50%(177/200),Kappa系数为0.87;以BACTEC MGIT 960培养法阳性为金标准,培养阳性者LAMP的敏感度为90.91%(20/22),培养阴性者LAMP的特异度为68.54%(122/178),2种方法的一致性符合率为71.00% (142/200),Kappa系数为0.73;以涂片法为标准,涂片阳性者LAMP的敏感度为80.00%(4/5),涂片阴性者LAMP的特异度为65.08%(123/195),两者一致性符合率为63.5%(127/200),Kappa系数为 0.59(表4)。

表2 不同检测方法检测TBM及非TBM患者的结果分析
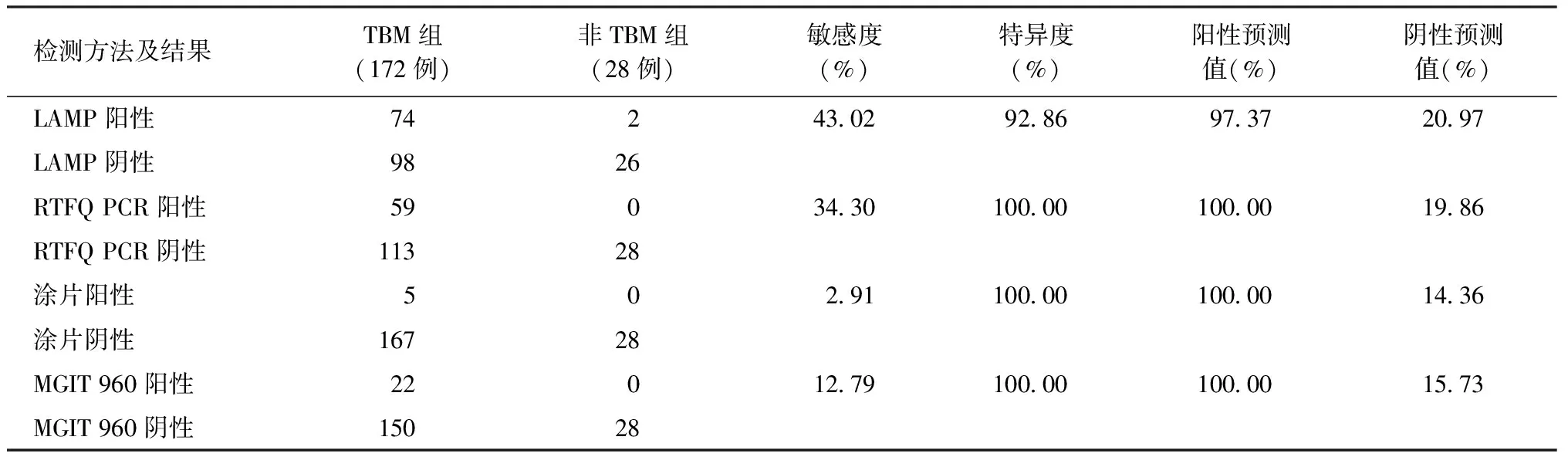
表3 4种方法诊断结核性脑膜炎的敏感度、特异度、阳性预测值、阴性预测值
注 敏感度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%;阴性预测值=真阴性例数/(真阴性例数+假阴性例数)×100%

表4 其他3种方法检测结果与LAMP检测结果的比较
讨 论
结核病已成为全世界范围内危害人类生命安全的主要传染性疾病之一,并位列感染性疾病死因第二名[7]。TBM是结核分枝杆菌感染后经血行播散种植于脑膜和软脑膜,进而侵入蛛网膜下隙引起脑血管或脑实质病变的中枢神经系统感染性疾病。但部分患者发病隐匿,临床表现不典型,其危害比较严重,预后差。因此,提高TBM的早期诊断已经成为目前TBM诊疗环节中急需解决的临床问题之一。据最新国际TBM诊断标准[4],指出CSF中镜检查到抗酸杆菌、分离培养法或RTFQ PCR法检测到MTB均可作为临床确诊TBM的标准,但由于脑脊液标本中MTB荷菌量低,涂片法检测的敏感度低、特异度差,不能区别死菌或活菌,而培养法检测虽精确可靠,但所需时间较长,极易错失最佳的治疗时期[8]。所以,目前TBM的临床诊断主要依赖于对患者的临床表现、脑脊液检查、影像学检查及对治疗效果的综合判断[9];但由于近年来抗生素和糖皮质激素的不规范使用,使一些TBM患者在未得到规范的抗结核药物治疗前病情就得到了暂时的缓解[10],干扰了对结核病的诊断。因此,笔者认为探索如何在TBM早期诊断中提高早期病原学诊断效率具有极大意义。
MGIT 960培养法是近年研制的专门用于MTB快速培养的方法,主要通过连续检测接种标本培养基所显示的荧光强度变化来判断是否有分枝杆菌生长,平均检出时间明显缩短,平均为2~4周,目前已成为临床上最有效的结核病病原学确诊方法之一[5],是细菌学培养检测的主要发展方向[11]。本研究中,MGIT 960培养法诊断TBM的敏感度仅为12.79%(22/172),虽远远高于常规涂片法[2.91%(5/172)],但显然无法满足临床需求。
PCR技术是通过对基因的选择性片段进行体外高效扩增,实现目的基因的检测,是目前临床上广泛应用于结核病病原学诊断的分子生物学技术;而RTFQ PCR法是在PCR技术的基础上,加入荧光标记的探针,把核酸扩增、杂交及光谱技术结合在一起,从而提高检测的敏感度和特异度。目前,RTFQ PCR法已成功用于检测痰标本和肺泡灌洗液标本,特别是含菌量较低的标本。已有研究显示,RTFQ PCR法检测脑脊液中的结核分枝杆菌具有较高的敏感度(68%,95%CI=62%~74%)与特异度(100%)[12],因此本研究选取RTFQ PCR法作为检测手段之一,并与LAMP法进行对照研究。
2000年,Notomi等[13]开发出一种新的DNA扩增技术-LAMP,之后Nagamine等[14]的研究也表明,通过设计两条环形引物可使反应速度提升1/2~1/3,其技术特点为:(1)仪器简便:扩增反应在恒定温度下就能进行,不需要PCR仪和其他检测仪器,仅水浴锅即能完成反应。(2)高特异性:针对靶基因的6个区段,设计4条引物。若有一条引物不匹配,则不能进行反应。(3)快速、高效扩增:整个扩增过程在60 min内即可完成。(4) 敏感度高:最低检测值为1~10拷贝,比PCR最低检测值高2~3个数量级。(5)步骤简单:所有试剂在反应前加入即可,实现一步法核酸扩增。(6)鉴定简便:目测即可判断是否发生了反应。即使没有分子生物学基础的检验人员在经过1周培训后也能掌握该技术[15]。
目前,LAMP法对MTB的检测主要是针对MTBC靶基因gyrb和IS6110[16-17],本研究基于IS6110设计引物,利用LAMP技术对临床疑诊为TBM的患者CFS标本进行分析,最终发现LAMP法诊断TBM的敏感度为43.02%,明显高于涂片法(2.91%)及MGIT 960快速培养法(12.79%),差异均具有统计学意义(χ2=75.11,P=0.000;χ2=43.88,P=0.002),且具有较高的特异度(92.86%),证明LAMP法对于早期诊断TBM可能具有较高的临床价值。Nagdev等[18]通过LAMP法检测CFS标本,结果表明LAMP对TBM的诊断敏感度高达88.23%,特异度达80.00%,这是首次运用LAMP法检测CFS中MTB的研究,但该研究样本量较小,仅为27例;本研究结果中LAMP法对MTB的敏感度(43.02%)远远低于上述国外同类研究,这可能与我国是结核病高发的发展中国家,在临床诊治、流行病学研究、检测技术条件上与发达国家存在较大差异有关;再则,LAMP技术应用于检测CFS诊断 TBM的研究较少,本研究是全球第二次、国内首次,除可查寻文献外,缺乏可借鉴资料,且操作人员检测CFS经验也较少,可能存在一定的实验室误差。以上原因可能导致了本研究与国外类似研究结果的差距。但本研究结果显示,LAMP技术对TBM诊断具有较MTB涂片法、培养法更高的价值,与PCR法具有一致的临床诊断价值,但成本更低廉,与国外研究[18]结论相一致。提示我们对LAMP技术有进一步深入研究的理由和空间。
近年来,已经出现了LAMP法检测MTB技术的改进与创新,如将rimM(16SrRNA蛋白)作为靶目标设计为LAMP引物,使检测方法的敏感度达到1 pg/μl基因组DNA[19];将LAMP技术与其他技术结合在一起的方法(如逆转录环介导等温扩增结合免疫吸附杂交技术)快速检测体液标本MTB的16SrRNA,该方法可以重复检测单一拷贝[20],Ustar生物技术有限公司通过固定在塑料盒内的条带侧向流动检测LAMP扩增产物,有效防止了扩增产物的泄漏[21]。这些研究将进一步有助于提高LAMP技术的准确性,有助于提高检测的敏感度。
已有研究表明,LAMP法比PCR法的最低检测浓度提高了10倍[22],提示对于荷菌量更低的标本(如菌阴痰标本、CFS标本等)进行LAMP法检测可能更具优势。本研究中,将LAMP技术与RTFQ PCR法检测结果相比较,两者敏感度的差异无统计学意义 (χ2=2.08,P=0.130),且具有较高的一致性符合率(88.50%),Kappa系数为0.87。笔者认为RTFQ PCR法本身是PCR经过改良的技术,其敏感度较PCR检测高,因此RTFQ PCR与LAMP技术敏感度相似。但RTFQ PCR法的检测时间仍需5~6 h,且需要价格较为昂贵的设备;通过对扩增反应曲线图谱来判读结果,对操作人员的技术水平要求较高。而LAMP法具有检测时间更短(1.2 h)、仪器更简便、对检测人员技术水平要求更低的优势,更适合在发展中国家和基层广泛开展。
本研究还发现一个现象,将LAMP法分别与MGIT 960培养法和RTFQ PCR法作对比,其敏感度明显高于MGIT 960培养法(χ2=43.88,P=0.002),但与RTFQ PCR法差异无统计学意义(χ2=2.08,P>0.05),且在诊断的一致率方面,LAMP与RTFQ PCR法的一致性符合率(88.50%,Kappa=0.87)也高于与MGIT 960培养法的一致率(71.00%,Kappa=0.73),其原因可能是由于RTFQ PCR法和LAMP法等分子生物学检测法对活菌或死菌的检测结果均为阳性,而常规培养法只有活菌才能培养阳性,这也提示临床医生在TBM治疗转归的评价方面,LAMP等生物学检测方法可能参考意义不大。
根据本研究结果,在LAMP法检测阳性的标本中,最终排除TBM的患者有2例,提示本研究存在一定的假阳性率,这主要是LAMP技术反应的高敏感性极易使样品与反应体系污染。如:在打开装反应液的管盖时, 反应产物容易形成气溶胶污染环境、试剂和实验器材,从而造成假阳性。因此,为了防止假阳性结果的出现,我们在LAMP 操作的整个过程中要谨慎小心, 提高实验者的操作水平;将配制反应液的实验区域和加入模板的实验区域,以及观察结果的实验区域分开, 实行分区操作,注意防止样品间的交叉污染,严格控制可能导致污染的机会。
[1] 薛承岩,刘怀深,杜新生,等.实验室诊断结核性脑膜炎6种方法的比较研究.临床检验杂志,2004,22(3):196-197.
[2] Iwamoto T, Sonobe T, Hayashi K. Loop-mediated isother mal amplification for direct detection ofMycobacteriumtuberculosiscomplex,M.avium, andM.intracellularein sputum samples. J Clin Microbiol, 2003, 41(6):2616-2622.
[3] 于霞,马异峰,付育红,等. 环介导等温扩增法检测临床标本中结核分枝杆菌的系统评价.中国防痨杂志, 2014, 36(4): 260-266.
[4] 中国防痨协会基础委员会.结核病诊断实验室检验规程.北京:中国教育文化出版社,2006:13-51.
[5] Marais S, Thwaites G, Schoeman JF, et al.Tuberculous meningi-tis:a uniform case definition for use in clinical research.Lancet Infect Dis,2010,10(11):803-812.
[6] Chen P,Shi M,Feng GD,et al.A highly efficient Ziehl-Neelsen stain: identifying de novo intracellular and improving detection of extracellularMycobacteriumtuberculosisin cerebrospinal fluid.J Clin Microbiol,2012,50(4): 1166-1170.
[7] Zumla A, George A, Sharma V, et al. The WHO 2014 global tuberculosis report-further to go. Lancet Glob Health, 2015, 3(1): e10-12.
[8] Thwaites G,Chau TT,Mai NT,et al.Tuberculous meningitis.J Neurol Neurosurg Psychiatry,2000,68(3): 289-299.
[9] Trusov A, Bumgarner R, Valijev R, et al. Comparison of Lumin LED fluorescent attachment, fluorescent microscopy and Ziehl-Neelsen for AFB diagnosis. Int J Tubercu Lung Dis, 2009, 13(7): 836-841.
[10] Brancusi F,Farrar J,Heemskerk D.Tuberculous meningitis in adults:a review of a decade of developments focusing on prognostic factors for outcome.Future Mierobiol,2012,7(9):1101-1116.
[11] Koh WJ,Ko Y,Kim CK,et a1.Rapid diagnosis of tuberculosis and multidrug resistance using a MGIT 960 system.Ann Lab Med,2012,32(4):264-269.
[12] Chaidir L, Ganiem AR, vander Zanden A, et al. Comparison of real time IS 6110-PCR, microscopy, and culture for diagnosis of tuberculous meningitis in a cohort of adult patients in indonesia. PLoS One, 2012, 7(12): e52001.
[13] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res, 2000, 28(12): E63.
[14] Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Mol Cell Probes, 2002, 16(3): 223-229.
[15] Boehme CC, Nabeta P, Henostroza G, et al. Operational feasibility of using loop-mediated isothermal amplification for dia-gnosis of pulmonary tuberculosis in microscopy centers of developing countries. J Clin Microbiol, 2007, 45(6): 1936-1940.
[16] Piatek AS, Van Cleeff M, Alexander H, et al. GeneXpert for TB diagnosis: planned and purposeful implementation. Glob Health Sci Pract, 2013,1(1):18-23.
[17] Ou X, Li Q,Xia H,et al. Diagnostic accuracy of the PURE-LAMP test for pulmonary tuberculosis at the county-level laboratory in China. PLoS One, 2014,9(5):e94544.
[18] Nagdev KJ, Kashyap RS, Parida MM, et al. Loop-mediated isothermal amplification for rapid and reliable diagnosis of tuberculous meningitis. J Clin Microbiol, 2011, 49(5): 1861-1865.
[19] Zhu RY, Zhang KX, Zhao MQ, et al. Use of visual loopme-diated isotheral amplification of rimM sequence for rapid detection ofMycobacteriumtuberculosisandMycobacteriumbovis. J Microbiol Methods, 2009, 78(3): 339-343.
[20] Lee MF, Chen YH, Peng CF. Evaluation of reverse transcription loop-mediated isothermal amplification in conjunction with ELISA-hybridization assay for molecular detection ofMycobacteriumtuberculosis. J Microbiol Methods, 2009,76(2): 174-180.
[21] Fang R, Li X, Hu L, et al. Cross-priming amplification for rapid detection ofMycobacteriumtuberculosisin Sputum Specimens. J Clin Microbiol,2009,47(3):845-847.
[22] 刘威, 李奉京, 黄留玉,等. 基于颜色判定的LAMP方法快速检测结核分枝杆菌. 中国医疗器械信息, 2014(10):7-10,25.
(本文编辑:孟莉 范永德)
Exploration of loop-mediated isothermal amplification in early diagnosis of tuberculous meningitis
SUNWen-wen,XIAOHe-ping.
ClinicandResearchCenterofTuberculosis,ShanghaiKeyLaboratoryofTuberculosis,ShanghaiPulmonaryHospital,TongjiUniversitySchoolofMedicine,Shanghai200433,China
Correspondingauthor:XIAOHe-ping,Email:xiaoheping_sars@163.com
Objective To evaluate the LAMP assay for rapidly detection ofMycobacteriumtuberculosis(MTB) in cerebrospinal fluid (CSF) and diagnose TBM in early stage. Methods The CSF samples were collected from patients who were clinical suspected tubercular meningitis before treatment from January 2014 to December 2015 in Shanghai pulmonary hospital. The CSF samples were tested by acid-fast bacillus (AFB) staining, BACTEC MGIT 960 culture, RTFQ PCR and LAMP. The clinic information and the final clinical diagnosis were recorded. Statistical analysis was done by SPSS 17.0,the sensitivity,specificity, positive predictive value (PPV),negative predictive va-lue (NPV) of the LAMP assay in the diagnosis of TBM were calculated; The sensitivity comparison among the four methods were performed using Chi-squared test,P<0.05 was considered statistically significant. The concordance between AFB, RTFQ PCR, BACTEC MGIT 960 cultureand and LAMP was evaluated byKappatest. Results A total of 200 CSF specimens were evaluated retrospectively using the LAMP assay,172 (86.00%) of them were diagnosed TBM finally. The sensitivity of the four methods (AFB staining, BACTEC MGIT 960 culture, RTFQ PCR and LAMP) were respectively: 2.91% (5/172),12.79% (22/172),43.02% (74/172),34.30% (59/172). The sensitivity of LAMP was significance higher than AFB and BACTEC MGIT 960 culture (χ2=75.11,P=0.000;χ2=43.88,P=0.002);while no significant difference was found compared RTFQ PCR (χ2=2.08,P=0.130). The specificity of LAMP and other there methods for the diagnosis of TBM in this study were 92.86% (26/28) and 100.00%. The concordance of Lamp with BACTEC MGIT 960 culture and RTFQ PCR were 71.00% (142/200) and 88.50% (177/200),theKappavalue were 0.73 and 0.87 respectively. Conclusion LAMP assay has a high sensibility and specificity in patients diagnosed TBM,the performance of LAMP was high consistency with RTFQ PCR and BACTEC MGIT 960 culture; LAMP could be a valuable method in early diagnosis of TBM.
Tuberculosis, meningeal; Diagnosis; Laboratory techniques and procedures; Nucleic acid amplification techniques; Comparative study
10.3969/j.issn.1000-6621.2016.12.018
上海市卫生和计划生育委员会科研课题(20134Y153)
200433 同济大学附属上海市肺科医院结核病临床研究中心 上海市结核病(肺)重点实验室
肖和平,Email:xiaoheping_sars@163.com
2016-06-28)

