Smad1在C57BL/6小鼠形觉剥夺性近视中的作用机制
崔 倩,杨 先,车成业,刘桂波,王 青
·实验论著·
Smad1在C57BL/6小鼠形觉剥夺性近视中的作用机制
崔倩,杨先,车成业,刘桂波,王青
Study of Smad1 in C57BL/6 mice with form-deprived myopia
Qian Cui, Xian Yang, Cheng-Ye Che, Gui-Bo Liu, Qing Wang
Foundation item:the National Natural Science Foundation of China(No.81300790)
Department of Ophthalmology,the Affiliated Hospital of Qingdao University, Qingdao 266003, Shandong Province, China
Correspondence to:Xian Yang. Department of Ophthalmology, the Affiliated Hospital of Qingdao University, Qingdao 266003, Shandong Province, China. yangxian_zhao@126.com
Received:2016-01-11Accepted:2016-03-16
Abstract
•AIM: To explore the mechanism of Smad1 during form-deprivation myopia development in C57BL/6 mice model.
•METHODS: Sixty 3-week-old C57BL/6 mice were randomly divided into experimental groups and normal groups (NC) which totally include four groups: form-deprived 3wk group (FDM3W,n=20), form-deprived 4wk group (FDM4W,n=20), FDM3W normal control group (FDM3W-NC,n=10) and FDM4W normal control group (FDM4W-NC,n=10). Mice in experimental groups were treated with diffuser wearing on right eyes (MD-T), and their left eyes were naturally exposed as their self-control group (MD-C). The normal control groups were free of all the treatments, but the same measurements were performed at the same time-point. Refractive status was examined at 3 and 4wk after treatments in all mice. The histological analysis was applied to assess the changes of the sclera and the retina. The immunohistochemical staining and quantitative real-time PCR (QRT-PCR) were applied to investigate the expression of Smad1 protein and mRNA in retina.
•RESULTS: (1)There was no significant difference between right and left eyes in every group before experiment. The normal control eyes showed physiological farsighted development and the MD eyes demonstrated relatively myopization. After experiments, a significant myopia shift had been induced in MD-T compared with MD-C and NC(P<0.05). (2) Histopathologic examination showed posterior sclera and retina in MD-T were thinner than in MD-C and NC groups. Compared with MD-C and NC groups, the expression of Smad1 in retina in MD-T was significantly decreased(P<0.01).
•CONCLUSION:The expression of Smad1 in retina of form-deprived myopia was down-regulated, and Smad1 likely to be involved in the development of myopia through the transduction of retinal signal.
KEYWORDS:•Smad1; form-deprived myopia; refraction; retina; C57BL/6 mice
Citation:Cui Q, Yang X, Che CY,etal. Study of Smad1 in C57BL/6 mice with form-deprived myopia.GuojiYankeZazhi(IntEyeSci) 2016;16(4):617-621
摘要
关键词:Smad1;形觉剥夺性近视;屈光度;视网膜;C57BL/6小鼠
引用:崔倩,杨先,车成业,等.Smad1在C57BL/6小鼠形觉剥夺性近视中的作用机制.国际眼科杂志2016;16(4):617-621
0引言
研究发现,近视是目前全球发生率最高的屈光不正[1]。已有大量研究确定高度近视患者并发青光眼、白内障和视网膜脱离等疾病的危险性显著增加,进而会导致不可逆性视力损失甚至致盲,但其发病机制目前尚不明确。目前近视发生机制研究中公认的两种学说“巩膜主动重塑机制”学说[2]和“局部视网膜调控机制”学说[3]均认为近视眼的形成是受局部视网膜信息调控引起巩膜细胞外基质主动重塑的结果。但视网膜与巩膜之间具体的信号转导通路仍需进一步探索。McBrien[4]研究已证实BMP/TGF-β信号通路通过调控巩膜重塑过程参与了近视的发生发展过程。
作为BMP/TGF-β信号通路中主要的下游信号转导因子[5],Smads转录因子在BMP/TGF-β信号转导中起着关键作用,其中Smadl已被确定为BMP-2的重要信号转导分子。本实验通过建立C57BL/6小鼠形觉剥夺性近视(form deprivation myopia,FDM)模型,观察屈光度及眼球后壁形态学改变以及Smad1在视网膜中的表达变化,分析Smad1与屈光度及视网膜变化之间的联系,探讨Smad1在近视眼中的作用机制,以期通过此次探索能够为近视发病机制的研究提供更多的实验基础和依据。
1材料和方法
1.1材料
1.1.1实验动物近交系SPF级健康雄性C57BL/6小鼠60只,21日龄,体质量13.6±0.8g,动物购自常州卡文斯实验动物有限公司。0.5%复方托吡卡胺滴眼液散瞳后裂隙灯下检查所有小鼠眼部情况,排除标准包括:(1)角膜混浊、晶状体混浊及眼部感染的小鼠;(2)小瞳孔、小角膜、眼部畸形的小鼠;(3)双眼屈光参差>10D,或1眼有明显远视或近视。实验动物饲养室温控制在20℃~25℃,通风良好,室内自然光照,12h/12h光照/黑暗环境每日交替,小鼠自由进水、摄食。动物的饲养及处理经青岛大学医学院动物伦理委员会审批通过。
1.1.2主要试剂与仪器带状光检影验光仪(苏州六六视觉科技股份有限公司)、Olympus光学显微镜(日本Olympus公司)、Smad1兔多克隆抗体(武汉博士德生物技术有限公司)、PCR引物(大连宝生物工程有限公司)、Ver.3.0型RNA PCR试剂盒(大连宝生物试剂公司)、SYBR(日本TaKaRa公司)、实时荧光定量PCR仪(德国Eppendorf公司)、SP试剂盒购于北京中杉金桥生物技术有限公司。
1.2方法
1.2.1实验小鼠分组将60只3周龄健康C57BL/6小鼠随机编号1~28,剪耳标记,利用随机数字表法将其分成4组,分别为:(1) 形觉剥夺遮盖3wk组(20只),记为FDM 3W;(2) 形觉剥夺遮盖4wk组(20只),记为FDM 4W;(3)形觉剥夺3wk正常对照组(10只),记为FDM 3W-NC;(4)形觉剥夺4wk对照组(10只),记为FDM 4W-NC。对照组周龄均与实验组相匹配。其中实验组右眼为实验眼(MD-T),左眼为自身对照眼(MD-C),正常对照组双眼不予任何处理。每3~4只小鼠饲养在一个标准鼠笼内。
1.2.2形觉剥夺性近视小鼠模型的建立将半透明试管制成等大、直径约为8mm、周边边缘约为1mm的半透明眼罩进行形觉剥夺。经5%枸橼酸芬太尼注射液麻醉后,使用4-0缝线将眼罩缝合于小鼠右眼眼周。眼罩边缘距离眼睑的距离足够长,以免影响其功能。手工用塑料片制成的项圈(外直径为36mm,内直径为10mm)装在颈部周围,以防小鼠将眼罩抓脱。每天早、中、晚三次检查小鼠眼部情况,查看有无异常分泌物及感染、眼罩有无脱落,以保证小鼠实验眼一直处于形觉剥夺状态。必要时给予妥布霉素滴眼液预防感染。诱导3、4wk(即出生后6、7wk)后,检测实验动物的屈光度,并取视网膜组织进行检测。
1.2.3眼屈光度的测量小鼠的屈光度检查采用传统的带状光视网膜检影法。由同一位经验丰富的验光师在未知小鼠分组的情况下对其进行检查。测量前小鼠双眼予以0.5%复方托吡卡胺滴眼液点眼,每5min 1次,连续3次,使瞳孔充分散大,直径>1.5mm,验光时不进行麻醉。暗室条件下,实验者抓握小鼠使其暴露被检眼,验光师取50cm工作距离,以0.50D间隔手持验光镜片分别在水平及垂直子午线上检影,散光以半量等效球镜计算。测量3次,以D为单位,记录每只小鼠各眼的屈光度平均值。
1.2.4标本处理测量屈光度后,颈椎脱臼法处死全部小鼠。在显微镜下,迅速取出整个眼球,用眼科镊和眼科剪剥离眼球周围筋膜,沿角膜缘将眼球剪开,去除眼球内的玻璃体,分离巩膜留取视网膜。各组随机取5只小鼠眼球置于4%甲醛固定48h后行石蜡包埋,备用于常规HE染色及免疫组化染色;各组其它小鼠视网膜置于Trizol液中,并立即震荡充分裂解后,保存于-80℃,备用于实时荧光定量PCR反应。
1.2.5免疫组织化学染色法检测Smad1蛋白的表达在各组中随机取5只小鼠眼球,予以常规石蜡包埋,所有组织块于后极部以3μm的厚度连续切片4张,一张用于苏木素-伊红(HE)染色,1张用做阴性对照,2张用于免疫组化染色。按照SP试剂盒内说明书进行免疫组化染色,一抗工作浓度为1∶100,以PBS液代替一抗作阴性对照。显微镜下观察各组标本中Smad1的显色程度、分布范围及密度,以细胞核或细胞浆染成蓝色为阳性标准。对HE染色及免疫组织化学染色结果行描述性分析。
1.2.6实时荧光定量PCR检测Smad1 mRNA从-80℃冰箱内取出冻存的小鼠视网膜组织,用Trizol法提取总RNA。目的基因应用primer design基因分析软件设计引物,并由TaKaRa生物公司合成。Smad1上下游引物分别为:5’-GGAATGCTGTGAGTTCCCATTTG-3’、5’-TGCTGAGGATTGTACTCGCTGTG-3’,产物片段长为23bp;内参β-actin上、下游引物分别为:5’-GATTACTGCTCTGGCTCCTAGC-3’,5’-GACTCATCGTACTCCTGCTTGC-3’,产物长度301bp。常规提取总RNA,采用紫外分光光度计分别测定光密度OD260与OD280,OD260与OD280比值在1.8~2.0之间,表明提取的RNA蛋白污染少,纯度较好。逆转录获得cDNA,以cDNA为模板扩增Smad1目的基因,Syber Green荧光定量PCR检测:PCR热循环参数为95℃ 30s,95℃ 5s,然后第二步反应60℃ 30s,95℃ 15s,进行40个循环,于每个循环的第二步(95℃ 15s)收集荧光信号。扩增结束后,进入分析结果界面,以β-actin作为内参照基因,与对照组相比较,得到Smad1相对定量值(RQ值)。
统计学分析:采用SPSS 17.0软件进行统计学分析,实验组内形觉剥夺眼(MD-T)与对侧眼(MD-C)的比较采用配对样本t检验;不同组间的两两比较采用独立样本t检验。以P<0.05为差异有统计学意义;以P<0.01为差异有显著统计学意义。
2结果
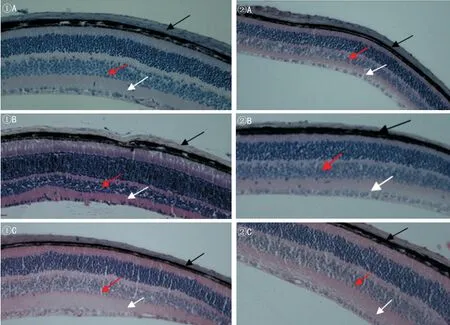
2.1各组小鼠实验前后屈光度比较各组小鼠实验前后实验眼、自身对照眼及正常对照眼屈光度的比较见表1。图1形觉剥夺不同时间眼球后壁的改变(HE,×200 )A:形觉剥夺3wk;B:形觉剥夺4wk组;①:自身对照眼;②:实验眼;③:正常对照眼;黑色箭头所指为巩膜,红色箭头所指为内核层,白色箭头所指为内从状层。
表1各组小鼠实验前后实验眼、自身对照眼及正常对照眼屈光度的比较

±s,D)
实验前,正常对照组小鼠左右眼屈光度在统计学上无统计学差异(P>0.05),由于是随机分组,根据正常对照组小样本推断所有实验动物在实验前的屈光度无统计学意义。FDM 3W组、FDM 4W组中,自身对照眼和正常对照组均呈生理性远视化发展。实验眼均呈相对近视化发展,FDM 3W组屈光度分别与自身对照眼、正常对照眼相比,差异均具有统计学意义(t=-40.52,P<0.01;t=-20.49,P=0.032);FDM 4W组屈光度分别与自身对照眼、正常对照眼相比,差异具有显著统计学意义(t=-49.356,P<0.01;t=-48.992,P<0.01)。FDM 3W组中实验眼与FDM 4W组相比差异具有统计学意义(t=-5.968,P=0.006),这表明随着形觉剥夺时间的延长,实验眼向近视方向漂移程度越高。在不同时间自身对照眼和正常对照眼屈光度在统计学上均无明显差异。
2.2光镜下眼球后壁的改变眼球后壁石蜡切片行HE染色,光镜下观察可见小鼠巩膜由多层纤维结缔组织构成(图1)。与自身对照眼和正常对照眼相比,FDM 3W时实验眼巩膜变薄,成纤维细胞排列紊乱;FDM 4W时巩膜明显变薄,胶原纤维紊乱、粗细不均。实验组视网膜厚度变薄,尤其是内核层和内丛状层。而自身对照眼及正常对照眼巩膜厚度无明显差异。各图中眼球后壁分层均清晰可见,从上至下分别为:巩膜-脉络膜-视网膜色素上皮层-外节-内节-外核层-外丛状层-内核层-内丛状层-神经节细胞层-神经纤维层。
2.3各组小鼠眼球后壁Smad1蛋白的表达各组小鼠实验眼及对照眼Smad1蛋白的表达变化见图2。图中可见对照组中Smad1阳性蛋白表达于视网膜,呈棕黄色颗粒状,染色明显。而在FDM 3W及FDM 4W后,Smad1表达逐渐下调,胞浆着色明显降低。
2.4各组小鼠视网膜Smad1 mRNA的表达根据实时荧光定量PCR结果显示,各组视网膜均有Smad1 mRNA的表达。单因素方差分析结果显示,差异有显著统计学意义(F=31.65,P<0.01)。与正常对照组及自身对照组比较,FDM 3W组实验眼Smad1 mRNA表达呈下调趋势(t=7.263,P<0.01;t=-9.487,P<0.05),FDM 4W组实验眼Smad1 mRNA表达显著减少(t=12.778,P<0.01;t=-15.573,P<0.01),差异均具有统计学意义。FDM 3W组中实验眼与FDM 4W组相比差异具有统计学意义(P<0.05)。在不同时间自身对照眼和正常对照眼Smad1的表达在统计学上均无统计学差异(P>0.05)。各实验组视网膜Smad1mRNA表达量比较分别见表2、图3。
3讨论
近视是一类受遗传、环境等多因素共同作用的复杂性疾病[6-7],有关其发病机制的研究也众说纷纭。Smad1是BMP/TGF-β信号通路中BMP-2下游的主要信号转导因子[8-9],在近视形成过程中发挥着不可或缺的信号转导作用。Guo等[10]研究发现近视诱导过程中BMP/TGF-β信号通路的下游转录因子Smad1表达出现下调趋势。此外Wang等[11]研究发现信号转导蛋白phospho-Smad 1的表达在刺激BMP-2之后明显升高。这些研究均充分暗示出Smad1信号转导通路参与了巩膜重塑过程。之前有关此方面的研究基本是体外细胞培养进行[12-13],本实验的创新之处在于采用C57BL/6小鼠不同时间段的形觉剥夺性近视模型观察Smad1的动态表达变化,探究其与屈光度、眼球后壁形态之间的关联以及其在近视中的作用机制。

图2各组小鼠Smad1蛋白的表达情况(SP,×400)
A:FDM 3W自身对照眼;B:FDM 3W实验眼:C:FDM 4W自身对照眼;D:FDM 4W实验眼;E:以PBS液代替一抗作阴性对照。
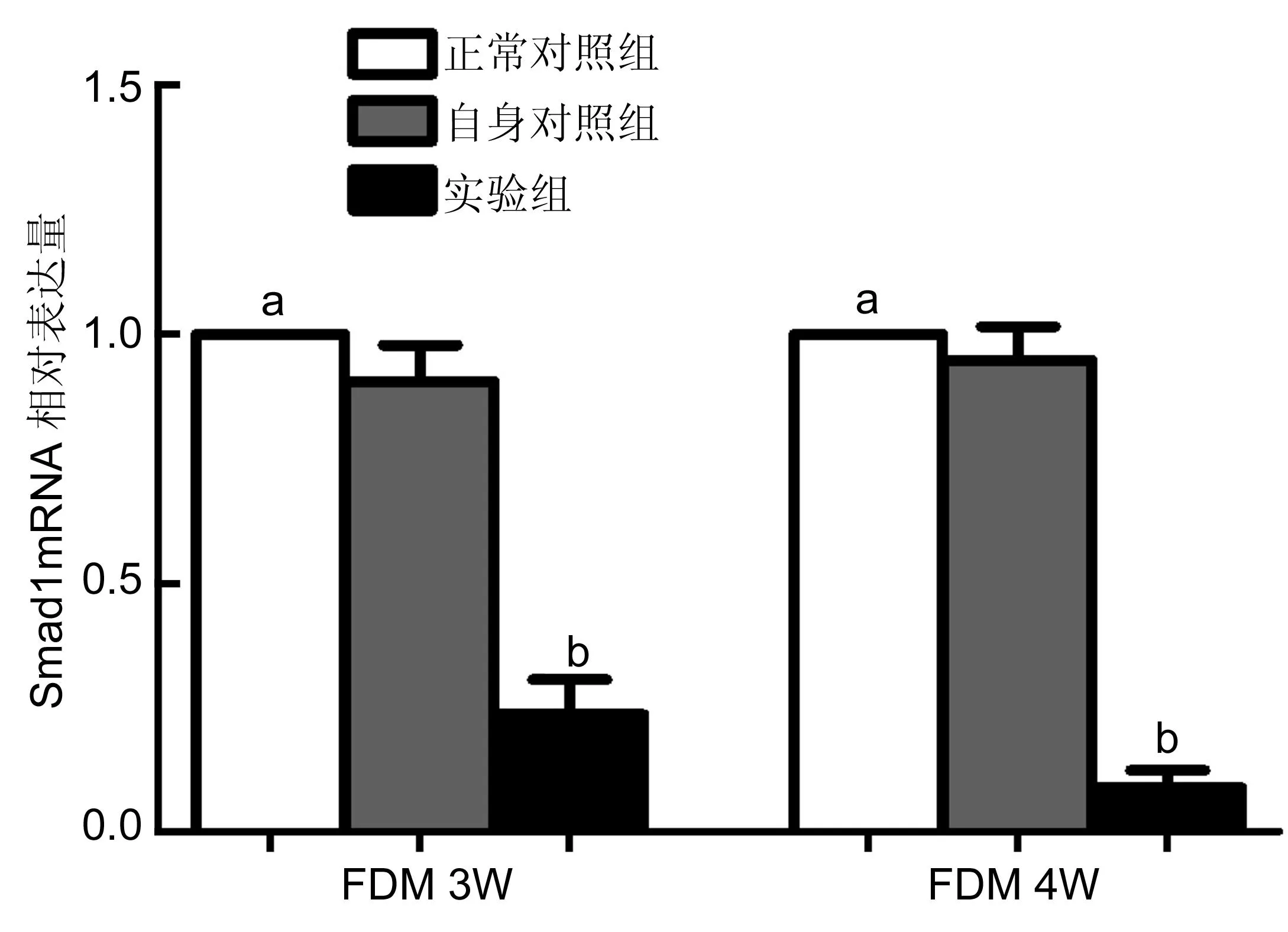
图3各组FDM 3W、FDM 4W小鼠实验组视网膜Smad1 mRNA的表达
bP<0.01vs正常对照组、自身对照组;aP>0.05vs自身对照组。
表2各组小鼠实验后实验眼、自身对照眼及正常对照眼Smad1 mRNA相对表达量比较

±s
本实验中屈光度结果显示实验眼与自身对照眼及正常对照组相比明显向近视方向漂移,这一趋势与之前的相关研究结果相一致[14]。在本实验中,我们还观察到Smad1表达于视网膜各层,而且随着剥夺时间的延长、向近视方向漂移程度的加深,实验组视网膜中Smad1的表达量明显呈渐进性减少,巩膜及视网膜(特别是内核层和内丛状层)也随之逐渐变薄。Ehrlich等[15]曾报道在鸡形觉剥夺性近视眼中视网膜较对照组明显变薄,尤其是外核层、内核层以及内丛状层。Fujikado等[16]曾推断视网膜内层区参与了形觉剥夺性近视形成过程。
目前儿童和青少年近视不仅发生率大幅度增高,逐渐向低龄化发展,且发生后呈进展趋势。神经、肌肉异常导致的上睑下垂,或先天性屈光间质混浊,都可以导致FDM的发生[17]。研究发现,长时间的光线照射和羟多巴胺等可以抑制FDM的形成,但其并不因割断视神经而被抑制,所以FDM的形成为局部视网膜变化的结果,所以在此实验基础上我们进一步推测在形觉剥夺性近视中视网膜接受信号释放出的信号因子调控Smad1的表达下调,继而引起视网膜细胞数目减少或发生形态学改变使视网膜厚度变薄,并且Smad1的表达减少导致BMP/TGF-β信号通路的信息传导受阻,最终影响到BMP-2对巩膜重塑的调控作用,形成近视。
综上所述,在形觉剥夺性近视中Smad1的表达呈下调趋势,且其表达量与屈光度、视网膜及巩膜表现出相关性,因此我们推测随着近视的加重,视网膜释放出信号之后通过Smad1调控信号通路的传导最终影响巩膜的重塑过程,并借此参与近视的形成过程。虽然目前大量国内外研究证实形觉剥夺性近视为巩膜重塑的结果[18],而且Scheaffel等[19]表明形觉剥夺性近视与局部视网膜的作用密切相关,但是其具体是如何通过局部视网膜信息调控的机制仍未有定论。有研究报道Smad1介导的信号转导途径可以调控胚胎发育和细胞环境稳态[20],同时大量研究发现,在小鼠及其它动物,幼年改变其视觉环境则容易诱导出近视,所以考虑到在实验性近视研究中环境是一个很好的可控制因素,我们大胆猜测能否在幼年时期从基因水平或者细胞水平上调节Smad1的表达来达到近视的防治作用,在今后的研究工作中我们将做进一步的探索。
参考文献
1 Andrei V, Tatiana V, Guggenheim Jeremy A,etal. ALPL2 regulates refractive error and myopia development in mice and humans.PlosGenetics2015;11(8):e1005432
2 Rada JA, Shelton S,Norton TT.The sclera and myopia.ExpEyeRes2006;82(2):185-200
3 Wallman J,Winawer J.Homeostasis of eye growth and the question of myopia.Neuron2004; 43(4):447-468
4 McBrien NA. Regulation of scleral metabolism in myopia and the role of transforming growth factor-beta.ExpEyeRes2013;114:128-140
5 Wordinger RJ, Sharma T, Clark AF. The Role of TGF- β2 and Bone Morphogenetic Proteins in the Trabecular Meshwork and Glaucoma.OculPharmacolTher2014;30(2-3):154-162
6 Morgan G, Ohno M, Saw SM. Myopia.Lancet2012;379:1739-1748
7孙明甡,张丰菊.病理性近视发病机制相关研究新进展.中国实用眼科杂志 2014;32(4):393-397
8 Liu HP, Lin YJ, Lin WY,etal. A novel genetic variant of BMP2K contributes to high myopia.ClinLabAnal2009;23(6):362-367
9 Miyazono K, Maeda S, Imamura T. BMP receptor signaling: transcriptional targets, regulation of signals, and signaling cross-talk.CytokineGrowthFactorRev2005;16(3):251-263
10 Guo H, Jin X, Zhu T,etal. SLC39A5 mutations interfering with the BMP/TGF-beta pathway in non-syndromic high myopia.MedGenet2014;51(8):518-525
11 Wang Q, Zhao G, Xing S,etal. Role of bone morphogenetic proteins in form-deprivation myopia sclera.MolVis2011;17:647-657
12 Kurisaki A, Kose S, Yoneda Y,etal. Transforming growth factor-beta induces nuclear import of Smad3 in an importin-beta1 and Ran-dependent manner.MolBiolCell2001;12(4):1079-1091
13 Xu L, Kang Y, Col S,etal. Smad2 nucleocytoplasmic shuttling by nucleoporins CAN/Nup214 and Nup153 feeds TGFbeta signaling complexes in the cytoplasm and nucleus.MolCell2002;10(2):271-282
14 Zhou X,Ji F,An J,etal. Experimental murtin myopia induces collagen type lα1 (COLlAl)DNA methylation and altered COLIAl messenger RNA expression in sclera.MolVis2012;18:1312-1324
15 Ehrlich D,Sattayadai J,Zappia J,etal. Effects of selective neurotoxins on eye growth in the young chick.CibaFoundSymp1990;155:63-84
16 Fujikado H,Hosohata J,Omoto T.ERG of form deprivation myopia and drug induced ametropia in chicks.CurrEyeRes1996;15(1):79-86
17 Leist M, Ghezzi P, Grasso G,etal. Derivatives of erythropoietin that are tissue protective but not erythropoietic.Science2004;305(5681):239-242
18张艳明,瞿佳,周翔天.形觉剥夺性近视中巩膜重塑的研究. 眼科研究 2007;25(5):390-392
19 Scheaffel F, Barmann M, Hagel G,etal. Studies on the role of the retinal dopamine/melatonin system in experimental refractive errors in chickens.VisRes1995;35(9):1247-1264
20 Lan Xu, Xiaohao Yao, Xiaochu Chen,etal. Msk is required for nuclear import of TGF-β/BMP activated Smads.JCellBiol2007;178(6):981-994
DOI:10.3980/j.issn.1672-5123.2016.4.07
收稿日期:2016-01-11 修回日期: 2016-03-16
通讯作者:杨先,博士,教授,副主任医师,硕士研究生导师,研究方向:小儿斜视、弱视.yangxian_zhao@126.com
作者简介:崔倩,硕士研究生,研究方向:小儿斜视、弱视。
基金项目:国家自然科学基金资助项目(No.81300790)
作者单位:(266003)中国山东省青岛市,青岛大学附属医院眼科
目的:通过建立C57BL/6小鼠形觉剥夺性近视模型,探究Smad1在近视形成中的作用机制。
方法:将60只3周龄C57BL/6小鼠随机分为实验组和正常对照组(NC),包括形觉剥夺3wk组(FDM 3W,n=20),形觉剥夺4wk组(FDM 4W,n=20),FDM3W正常对照组(FDM 3W-NC,n=10)和FDM4W正常对照组(FDM 4W-NC,n=10),实验组右眼遮盖,左眼自然暴露作为自身对照,正常对照组不予任何处理。在实验3wk及4wk时检测所有小鼠屈光状态,HE染色观察巩膜及视网膜组织结构变化,免疫组织化学方法及实时荧光定量PCR观察Smad1在视网膜中的表达情况。
结果:(1)自身对照眼和正常对照组呈生理性远视化发展,FDM3W、FDM4W实验眼均呈相对近视化发展,差异具有统计学意义(P<0.05);(2)与自身对照组及正常对照组比较,FDM3W、FDM4W实验眼巩膜及视网膜明显变薄;实验眼视网膜中Smad1表达明显下降,差异具有显著统计学意义(P<0.01)。
结论:小鼠形觉剥夺性近视眼视网膜(尤其是内核层及内丛状层)中Smad1的表达呈下调趋势,Smad1极有可能通过转导视网膜信号参与了近视发生发展过程。

