双氢青蒿素对实验性小鼠肝纤维化的抑制作用
郭永泽 单铁英 任海霞 蔡莉 李校天 王建华 刘晓东 崔星亮
056002 河北省邯郸市,河北工程大学附属医院(郭永泽、任海霞、蔡莉、李校天、王建华、刘晓东、崔星亮);河北工程大学(单铁英)
·论著·
双氢青蒿素对实验性小鼠肝纤维化的抑制作用
郭永泽单铁英任海霞蔡莉李校天王建华刘晓东崔星亮
056002河北省邯郸市,河北工程大学附属医院(郭永泽、任海霞、蔡莉、李校天、王建华、刘晓东、崔星亮);河北工程大学(单铁英)
【摘要】目的探讨双氢青蒿素对胆总管结扎引起的小鼠肝纤维化的抑制作用及其作用机制。方法50只C57BL-6小鼠随机分为假手术组(n=10)、模型组(n=20)和治疗组(n=20)。模型组:采用胆总管结扎的方法建立小鼠肝纤维化模型;治疗组:在胆总管结扎术后第3周开始以20 μg/g的双氢青蒿素灌胃,1次/d,共12次。假手术组:只是分离出胆总管,置线不结扎并缝合腹腔后第3周开始以等剂量的DMSO 0.9%氯化钠溶液灌胃,1次/d,共12次。3组的肝组织切片经HE和天狼猩红染色法观察其组织学病理变化;Western blot方法检测Ⅰ型胶原和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)蛋白的表达水平。结果经HE和天狼星红染色法结果证实小鼠肝纤维化动物模型的成功建立。模型组小鼠肝内出现灶状坏死,汇管区纤维组织和胆总管明显增生,肝组织中Ⅰ型胶原蛋白和α-SMA含量增加,与假手术组相比其差异有统计学意义(P<0.05)。治疗组经过双氢青蒿素治疗后,小鼠肝内纤维组织增生降低,肝组织中Ⅰ型胶原蛋白和α-SMA含量降低,与模型组比较差异有统计学意义(P<0.05)。结论双氢青蒿素具有抗肝组织纤维化作用,提示可作为一种新型抗肝组织纤维化药物。
【关键词】肝纤维化;双氢青蒿素;胆总管结扎;天狼星红染色;Ⅰ型胶原;α-平滑肌肌动蛋白
肝纤维化是一种常见的严重威胁人类生命健康的疾病,是机体对慢性肝损伤刺激的一种修复反应,其病理学特征表现为:肝组织内以Ⅰ型胶原为主的细胞外基质(extracellularmatrix,ECM)过度增生与异常沉积[1,2],使肝脏的组织结构遭到破坏,最终导致肝硬化。因此,预防和治疗肝纤维化是许多医学研究者关注的焦点。双氢青蒿素(dihydroartemisinin,DHA)为青蒿素的衍生物,研究已经证实它具有多种生物学功能如:抗肿瘤、抗疟疾及调节机体免疫力等[3-5]。近年来,有实验研究表明,青蒿琥酯能抑制肝星状细胞的增殖而起到抗肝纤维化的作用[6]。本研究主要采用胆总管结扎制备小鼠肝纤维化动物模型,经过DHA治疗后观察并分析其对小鼠肝纤维化的抑制作用及其作用机制,为临床上寻找新的防治肝纤维化药物提供理论基础。
1材料与方法
1.1实验动物清洁级健康雄性C57BL-6小鼠50只,5~6周龄,平均体重(0.32±0.28)kg, 购自河北医科大学动物实验中心。许可证号:SCXK(冀)2014-1-005。实验过程符合中华人民共和国的《实验动物管理条例》及伦理要求。
1.2主要试剂DHA(标准品),购自上海纯优生物科技有限公司,用二甲基亚砜(DMSO)溶解,配成母液,4℃保存,实验前用0.9%氯化钠注射液配制,DMSO终浓度<0.1%。DMEM 和FBS 购自Gibco;Ⅰ型胶原多克隆抗体和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体购自Santa Cruz;SP试剂购自北京中山生物技术公司;天狼星红染色液购自北京Leagene 公司。
1.3方法
1.3.1肝纤维化动物模型制备:本实验采用胆总管结扎法制备小鼠肝纤维化模型,具体方法参照文献[7]:采用3%戊巴比妥钠40 mg/kg腹腔注射麻醉小鼠,在腹下部沿正中线至剑突下切开长约2 cm的切口,充分显露出胆总管及十二指肠上段,小心分离出胆总管并结扎缝合腹腔。假手术组只是分离出胆总管,置线不结扎并缝合腹腔。以上操作均在无菌条件下进行。术后分笼饲养。
1.3.2实验分组:将50只小鼠随机分成假手术组(n=10)、模型组(n=20)及治疗组(n=20)。模型组:按上述方法建立小鼠肝纤维化模型,常规饲养;治疗组:按上述方法胆总管结扎术后第3周开始以20 μg/g 的DHA灌胃,1次/d,共12次。假手术组:只是分离出胆总管,置线不结扎并缝合腹腔,第3周开始以等剂量的DMSO 0.9%氯化钠溶液灌胃(DMSO终浓度<0.1%),1次/d,共12次。
1.3.3标本采集及制备:最后1次灌胃后48 h,麻醉处死各组小鼠,打开腹腔,无菌下取肝组织,肉眼观测其颜色、质地等,用冰磷酸盐缓存液(PBS)洗去血迹,取相同部位的右肝组织,10%多聚甲醛固定24 h,常规梯度乙醇脱水,二甲苯透明,石蜡包埋。
1.3.4HE染色:上述各组肝组织采用石蜡包埋,并以5 μm的厚度连续切片,二甲苯脱蜡、梯度浓度乙醇至水、苏木精染色5 min、自来水洗3 min、1%盐酸乙醇30 s、自来水洗3 min、1%氨水30 s、伊红染色1 min、二甲苯透明和中性树胶封片。然后光学显微镜下观察肝组织结构改变情况。
1.3.5天狼星红染色:根据文献的操作步骤对肝组织进行天狼星红染色[8],然后光学显微镜下观察肝组织结构改变和胶原沉积情况,并采用image-Pro Plus软件对肝组织胶原沉积进行定量分析。
1.3.6Western blot检测肝组织中Ⅰ型胶原蛋白(Col Ⅰ)和α-SMA蛋白的表达水平:用上样缓冲液5×SDS与3组的肝组织总蛋白提取物50 μg均匀混合,100℃煮沸5 min,冰上冷却,加入PAGE凝胶孔内,进行恒压为120 V电泳。在100 V恒压和180 mA的条件下分别用45 min将凝胶上蛋白转移至PVDF膜,用TTBS 20 ml和1 g奶粉封闭2 h。将膜分别浸入Ⅰ型胶原蛋白和α-SMA抗体,抗体浓度均为1∶250,4℃过夜。TTBS溶液洗膜3次,10min/次,将膜浸入辣根过氧化物酶标记的二抗溶液(1∶10 000),37℃反应2 h,TTBS溶液洗膜3次,10 min/次,化学发光法显色。底片经扫描仪透扫后,用ImageJ2X软件对Western条带进行定量分析,以GAPDH作为内参矫正,用目的蛋白的吸光度与内参吸光度的比值代表目的蛋白的相对表达含量。

2结果
2.1HE染色法观察肝组织的病理学改变假手术组:肝小叶结构清晰,肝细胞大小均匀且排列整齐,无变性和坏死现象,汇管区无异常。模型组:多数肝小叶结构遭到破坏,紊乱,在中央静脉周围的肝细胞出现变性并发生片状坏死现象,炎性细胞浸润,结缔组织和小胆管增生、汇管区扩大,假小叶形成。治疗组:较少的肝小叶结构破坏,肝细胞排列较整齐可发现肝细胞再生现象,少量炎性细胞浸润和小胆管增生。见图1。
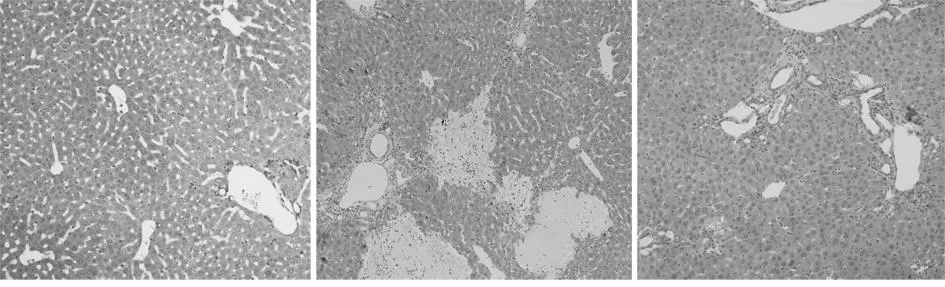

A 假手术组B 模型组C 治疗组
图1肝组织的病理学改变(HE×100)
2.2天狼星红染色法观察肝组织的病理学改变假手术组中央静脉周围和汇管区有少量胶原纤维;模型组在小叶周边、汇管区和中央静脉周围出现大量红色胶原纤维,表明肝纤维化、肝硬化已经形成。治疗组在小叶周边、汇管区和中央静脉周围胶原纤维明显减少。采用image-Pro Plus软件分析,结果显示,模型组狼星红染色阳性面积高于假手术组(P<0.05),治疗组天狼星红染色阳性面积明显低于模型组(P<0.05)。见图2,表1。
2.3双氢青蒿素抑制肝组织中Ⅰ型胶原蛋白和α-SMA蛋白的表达水平Western blot检测结果显示:假手术组肝组织中有少量Col Ⅰ和α-SMA阳性表达;模型组与之类似;与假手术组相比,模型组肝组织中Col Ⅰ和α-SMA表达明显增加(P<0.05);与模型组比较,治疗组肝组织中Col Ⅰ和α-SMA表达明显降低(P<0.05)。见图3、表2。
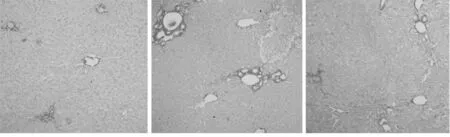

A 假手术组B 模型组C 治疗组
图2 观察肝组织的病理学改变(天狼星红×100)
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
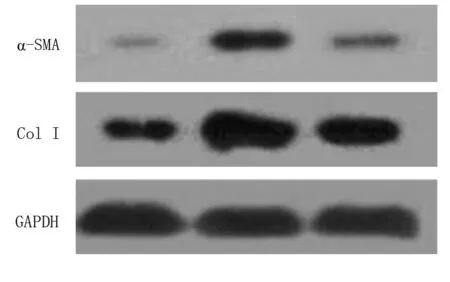
图3 Western blot显示肝组织中Ⅰ型胶原和α-SMA的蛋白表达水平
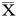
吸光度,±s
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
3讨论
DHA是青蒿素的一种衍生物,属于倍半萜内酯类化合物。吴苹等[9]实验研究显示,发生肾炎的小鼠经过DHA治疗后,发现其肾炎的程度减轻,其机制是DHA可以调节肾炎小鼠体内炎性因子的释放。袁晓梅等[10]建立肺纤维化的小鼠模型并采用DHA治疗,结果表明DHA可以呈剂量依赖性抑制小鼠肺纤维化。
本实验采用胆总管结扎的方法建立肝纤维化动物模型。该方法建立的肝纤维化模型所需时间短,稳定且不容易发生逆转,比较适合用于选择抗纤维化药物的实验研究[11]。
肝纤维化的主要病理特征是细胞外基质在肝组
织内异常增生和沉积,其中以Ⅰ型胶原最为主明显。实验研究已经证实,在肝纤维进展的过程中,肝星状细胞增殖活化,Ⅰ型胶原和α-SMA基因和蛋白表达上调,胶原合成增加[12]。经过PDGF-B 反义寡脱氧核苷酸、S-亚硝基-N -乙酰半胱氨酸等抗纤维化的药物治疗后,肝星状细胞失活并恢复到静止状态,而Ⅰ型胶原和α-SMA 的基因和蛋白表达也下调,肝纤维化程度逐渐减轻[13-16]。本实验的研究表明,肝纤维化的小鼠肝细胞出现灶状坏死,汇管区纤维组织和胆总管明显增生,肝组织中Ⅰ型胶原蛋白和α-SMA含量增加。经过双氢青蒿素治疗后,小鼠肝内纤维组织增生降低,Ⅰ型胶原蛋白和α-SMA含量降低。这说明DHA可能是通过抑制肝星状细胞增殖活化而抗肝纤维化,提示可作为一种新型抗肝组织纤维化药物。
参考文献
1Bataller R,Brenner DA.Liver fibrosis.J Clin Invest,2005,115:209-218.
2Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis.J Gastroenterol Hepatol,2007,22:79-81.
3Luo J, Chen X, Chen G, et al. Dihydroartemisinin induces radiosensitivity in cervical cancer cells by modulating cell cycle progression.Saudi Med J,2013,34:254-260.
4Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem,2000,275:2247-2250.
5周立文,贝文政,王建才.双氢青蒿素对恶性疟疾的疗效及免疫调节作用观察.热带病与寄生虫学,2008,6:138-139.
6张晓燕,马淑晶,徐亚洁,等.青蒿琥酯对人源肝星状细胞LX-2增殖、胶原产生以及KLF6表达的影响.天津医科大学学报,2014,20:258-259.
7姜慧卿,张晓岚.丹参单体IH764-3对胆总管结扎小鼠胶原降解的作用及其机制.胃肠病学和肝病学杂志,2003,4:336-338.
8王伯法,李玉松,黄高异,等主编.病理学技术.第1版.北京:人民卫生出版社,2001.144.
9吴苹,李启杰,夏增亮,等. 小鼠肾炎模型的制备及双氢青蒿素对其炎症因子释放的影响.华西医学,2011,26:1028-1031.
10袁晓梅,袁彬,马五林.双氢青蒿素对大鼠肺组织纤维化的干预作用.中华实用儿科临床杂志,2013,28:1253-1256.
11李志钢,杨晋翔,张伟,等. 肝纤维化实验动物模型的建立与评价. 北京中医药大学学报(中医临床版),2009,4: 43-46.
12朱跃科,王宝恩,申凤俊,等.肝纤维化过程中胶原基质金属蛋白酶及其抑制因子表达的动态变化及相互关系.中华肝脏病杂志,2010,88: 401-411.
13Vercelino R,Crespo I,de Souza GF,et al.S-nitroso-N-acetylcysteine attenuates liver fibrosis in cirrhotic rats.J Mol Med,2010,88:401-411.
14杨雅丽,韩跃武. PDGF-B 反义寡脱氧核苷酸对小鼠肝星状细胞增殖及Ⅰ型胶原合成的影响.中国病理生理杂志,2008,24: 582-585.
15Lee TF, Mak KM, Rackovsky O, et al. Down regulation of hepatic stellate cell activation by retinol and palmitate mediated by adipose differentiation - related protein (ADRP).J Cell Physiol,2010,223: 648- 657.
16Panakanti R,Pratap A,Yang N,et al.Triplex formingoligonucleotides against type alpha1 (I) collagen attenuates liver fibrosis induced by bile duct ligation.Biochem Pharmacol,2010,80:1718-1726.
The inhibitory effects of dihydroartemisinin on liver fibrosis in experimental mice
GUOYongze*,SHANTieying,RENHaixia*,etal.
*AffiliatedHospitalofHeibeiEngineeringUniversity,Hebei,Handan056002,China
【Abstract】ObjectiveTo investigate the inhibitory effects and action mechanism of dihydroartemisinin (DHA) on liver fibrosis induced by bile duct ligation in experimental mice.MethodsFifty C57BL-6 mice were randomly divided into sham-operation group (n=10),model group (n=20) and treatment group (n=20). The animal models with hepatic fibrosis were established by bile duct ligation,then,on the third week after bile duct ligation, the mice in treatment group were given DHA 20μg/g by gavage,once a day for 12 days. However the mice in sham-operation group were given equal dose of DMSO physiological saline by gavage, once a day for 12 days. The histopathological changes were observed by HE and sirius red staining for three groups,moreover, the expression levels of typeⅠcollagen and α-smooth muscle actin (α-SMA) were detected by Western Blot.ResultsThe results by HE and sirius red staining demonstrated that the animal models with hepatic fibrosis were successfully established in experimental mice. The focal cellular necrosis and fibrous tissue hyperplasia were found in liver of mice of model group,furthermore, the expression levels of type I collagen and α-SMA were obviously increased,there were significant differences between model group and sham-operation group (P<0.05). After treatment by DHA in treatment group,the fibrous tissue hyperplasia in liver was improved and the expression levels of type I collagen and α-SMA were significantly decreased, as compared with those in model group (P<0.05).ConclusionDHA has the effects of anti-fibrosis of liver tissues, thus, it suggests that DHA can be regarded as a potential therapeutic drug for liver fibrosis.
【Key words】liver fibrosis;dihydroartemisinin;bile duct ligation; sirius red staining; type I collagen;α-smooth muscle actin
(收稿日期:2015-09-14)
【中图分类号】R 975.5
【文献标识码】A
【文章编号】1002-7386(2016)06-0824-03
doi:10.3969/j.issn.1002-7386.2016.06.006
项目来源:邯郸市科学技术研究及发展项目(编号:1323108088-5)

