阿托伐他汀对人外周血淋巴细胞炎症相关基因mRNA水平的影响
冯丹阳 王力明
710032 西安市,西安电力中心医院
·论著·
阿托伐他汀对人外周血淋巴细胞炎症相关基因mRNA水平的影响
冯丹阳王力明
710032西安市,西安电力中心医院
【摘要】目的建立检测人培养外周血淋巴细胞炎性因子实时定量PCR实验,观察阿托伐他汀对相关炎性因子mRNA表达的影响。方法无菌采集志愿者静脉血15 ml,进行外周血淋巴细胞的培养,提取细胞总RNA及浓度纯度鉴定,用实时定量PCR技术对体外培养PBL细胞 mRNA表达水平进行动态观察,在培养体系中加入阿托伐他汀,与常规培养PBL的 mRNA表达水平进行比较。结果在经过阿托伐他汀培养后,人外周血淋巴细胞的CCL13、IL-8、PAI-1、TGF-2的mRNA表达显著下降(P<0.05); 人外周血淋巴细胞的羟甲戊二酰辅酶A(HMG-CoA)的mRNA表达显著上升(P<0.05),并且PBL中的低密度脂蛋白受体(LDL-R)数量也有明显的增加趋势(P<0.05)。在低浓度时24 h治疗后阿托伐他汀能显著降低CCL13的mRNA表达(P<0.05),而在高浓度的阿托伐他汀时表达CCL13 的mRNA表达增加(P<0.05);CCL13 mRNA表达下调有一定时间依赖性(P<0.05)。结论他汀类通过直接抑制一些趋化因子和细胞因子在外周血淋巴细胞中的炎性基因表达,对预防临床心血管疾病有一定作用。
【关键词】阿托伐醌;淋巴细胞;炎症
冠状动脉粥样硬化性心脏病(CAD),无论是心肌梗死、心绞痛、冠心病、心律失常或心脏衰竭都严重威胁着患者的健康和生命。但CAD启动和发展机制迄今仍未完全阐明。动脉粥样硬化是CAD的病理基础。除CAD的传统危险因素如高胆固醇血症、高血压、糖尿病、胰岛素、年龄、性别、吸烟、肥胖等外,炎症活动在CAD发生发展中的意义正日益受到关注。大规模的临床试验证明,在给予他汀类药物进行治疗后心血管炎症的症状有明显的改善[1]。他汀类药物的治疗效果也许远不止于以往人们预期的仅在降低血脂中的作用。阿托伐他汀是目前国内最新一代他汀类药物,为烈性羟甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,流行病学资料显示,他汀类药物降低血清超敏C-反应蛋白(hs-CRP)水平,降低高HsCRP、高胆固醇患者的病死率,并能有效改善急性冠状动脉综合征患者的预后,该效应除与他汀类调脂作用有关外,还和其非调脂作用密切相关。研究表明,他汀类药物抗动脉粥样硬化的机制除了其有效的减低低密度脂蛋白(LDL)以外,还具有抗炎症作用[1,2]。本研究的目的是要说明,在炎症基因表达与阿伐他汀孵化后,烈性HMG-CoA还原酶抑制剂在PBL中的变化 ,利用实时聚合酶链式反应(polymerase chain reaction, PCR)技术,以进一步研究他汀类的药物的抗炎机制。PCR即聚合酶链式反应,是指在DNA聚合酶催化下,以母链DNA为模板,以特定引物为延伸起点,通过变性、退火、延伸等步骤,体外复制出与母链模板DNA互补的子链DNA的过程。是一项DNA体外合成放大技术,能快速特异地在体外扩增任何目的DNA。可用于基因分离克隆,序列分析,基因表达调控,基因多态性研究等许多方面。
1材料与方法
1.1细胞与细胞培养外周血淋巴细胞(PBL)来自于用肝素抗凝后再用淋巴细胞分离剂(Nycomed Pharma AS, Oslo, Norway)从健康志愿者无菌静脉血(15 ml)中分离出来的。
1.2外周血淋巴细胞采集与培养(1)无菌采集志愿者静脉血15 ml,经肝素抗凝(每毫升血用15 U肝素抗凝),用不含血清的RPMI1640等体积稀释。(2)加人淋巴细胞分离液(约20℃)6 ml于无菌离心管,沿管壁将抗凝稀释血液缓慢加至分离液层面,保持勿使血液进入分离液内。(3)将离心管置水平离心机内,室温以2 000 r/min离心20 min,小心用吸管吸出灰白色层细胞,即外周血单个核细胞(peripheral blood mononuclear cell,PBMC),移入另一无菌离心管中。(4)用5倍体积PBS洗涤3次,每次于室温以1 500 r/min离心10 min。(5)用RPMI-1640 溶液(Gibco Life Technologies) 洗涤1次,于室温以1 500 r/min离心10 min。(6)用吸管轻轻吸取上层细胞悬液,即为除去单核细胞的淋巴细胞,转入无菌24孔板,供加药培养。(7)用吸管轻轻吸取上层细胞悬液,即为除去单核细胞的淋巴细胞,淋巴细胞培养于加入10%的胎牛血清(FCS)和1%青霉素或者链霉素(Penicilin or Stmycin,P/S)的RPMI-1640溶液的 35 mm的无菌培养皿上。(8)3 107个细胞被分为10组,给药组分别加入溶解于二甲基亚砜(DMSO,SIGMA,St.Louis,MO)的阿托伐他汀5、10、20 mg/L,不加入阿托伐他汀为阴性对照组。置于37℃、5% CO2饱和湿度的培养箱内培养。
1.3细胞总RNA提取(1)RNA的提取:在培养8、16、24 h后,分别用Trizol(Invitrogen,Tokyo,Japan)提取总RNA 1 300×g离心10 min收集加药孵育8、16、24 h后的细胞沉淀,彻底弃上清,加入1 ml RNAex试剂,用加样移液器抽打5次,移至1.5 ml EP管。(2)室温静置10 min,加入200 μl氯仿,用力颠倒EP管混匀。室温静置10 min,4℃ 12 000×g离心10 min。(3)用小体积移液器小心将上层水相(约450 μl)移至另一1.5 ml EP管,加入等体积的异丙醇,混匀室温静置10 min。(4)4℃ 12 000×g离心5 min,小心弃上清。(5)用预冷75%乙醇1 ml洗涤沉淀,4℃ 7 500×g离心5 min,弃上清。(6)室温静置使RNA沉淀恰好干燥,加入20 μl无RNA酶水充分溶解,保存于-80℃。
1.4RNA的浓度及纯度鉴定
1.4.1RNA浓度和纯度的测定:取1 μl RNA液溶于99 μl纯水中稀释,用多功能酶标仪分别在260 nm和280 nm处测定其吸光度A260和A280值。
1.4.2RNA浓度和纯度:RNA浓度(μg/μl)=A260×40×稀释倍数/1 000;RNA的纯度用A260/A280的比值反映,要求在1.7~2.0。
1.5实时定量逆转录聚合酶链反应分析绝对定量实时逆转录聚合酶链反应: 2 μg总RNA样品中加入随机引物和鼠莫洛尼(氏)白血病毒反转录酶使得最总体积为20 μl合成cDNA。用引物直接插入到pGEM-T Easy载体使之成为PCR扩增嵌入物,此PCR扩增嵌入物转化大肠杆菌JM109感受态细胞后,用MagExtractor质粒试剂盒(Toyobo, Osaka, Japan)分离重组质粒。稀释质粒和cDNA再加上用于制造质粒的同一引物对以及LightCycler-FastStart DNA Master SYBR Premix Ex Taq (Takara, Otsu, Japan)通过带有lightcycler (Roche)的实时RT-PCR进行扩增。 经95℃初步变性步骤10 min,执行周期数为45的一个三步骤的循环程序(其中95℃变性10 s,62℃退火10 s以及72℃延伸13 s)。使用标准曲线的方法用LightCycler 软件计算转录的绝对拷贝数量。以定量RT-PCR分析为条件的培养细胞的cDNA与作为内部对照的胆色素原脱氨酶mRNA的表达水平进行比较,其结果用ABI序列检测软件2.1版的2-ΔΔCT方法进行分析作为相对定量。相对定量实时逆转录聚合酶链反应:用2 μg总RNA样品以及RevertAidTM H Minus Frist Strand cDNA Synthesis试剂盒(fermentas)使得最终体积为20 μl 合成培养细胞的cDNA。实时PCR技术,对重复样品用Applied Biosystems 7300 PCR实时系统与引物Power SYBR Green PCR Master Mix(Applied Biosysterm,U.S.)。见表1。

表1 RT-PCR引物列表
1.6观察指标
1.6.1阿托伐他汀对人外周血炎性因子影响:为了估计阿托伐他汀对外周血淋巴细胞的影响,2组细胞分别以5 mg/L的阿托伐他汀和无阿托伐他汀培养24 h后,收集和提取细胞总RNA。用实时定量RT-PCR检测炎性基因的绝对拷贝数并与阴性对照计算减少数量。
1.6.2阿托伐他汀对HMG-CoA和LDL受体的影响:2组细胞分别以5 mg/L的阿托伐他汀和无阿托伐他汀培养24 h后,收集和提取细胞总RNA。用实时定量RT-PCR检测LDL受体和HMG-CoA的绝对拷贝数。
1.6.3外周血淋巴细胞对阿托伐他汀的时间依赖和剂量依赖:在阿托伐他汀治疗后,分别在8、16、24 h时分析实时聚合酶链反应,ccl13的mRNA水平浓度分别为5、10、20 mg/L。

2结果
2.1阿托伐他汀对外周血炎性因子的影响在经过阿托伐他汀培养后,人外周血淋巴细胞的CCL13、IL-8、PAI-1、TGF-2的mRNA表达显著下降(P<0.05)。见图1。

图1 阿托伐他汀对人外周血炎性因子的影响
2.2阿托伐他汀对HMG-CoA和LDL受体的影响在经过阿托伐他汀培养后,人外周血淋巴细胞的HMG-CoA的mRNA表达显著上升,并且PBL中的LDL受体数量也有明显的的增加趋势(P<0.05)。见图2。
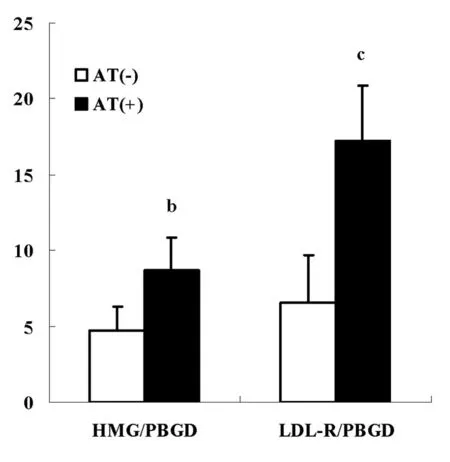
图2 阿托伐他汀对HMG-CoA和低密度脂蛋白受体的影响
2.3阿托伐他汀治疗后PBL中CCL13的mRNA水平随剂量复化在低浓度时24 h治疗后阿托伐他汀能显著降低CCL13的mRNA表达,而在高浓度的阿托伐他汀时表达CCL13 的mRNA表达增加。见图3。
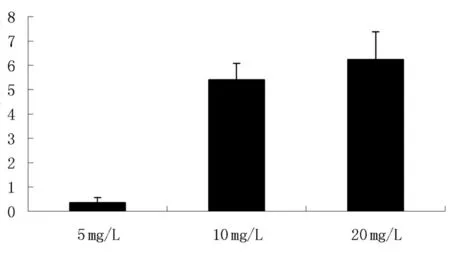
图3 在阿托伐他汀治疗后PBL中CCL13的mRNA水平随剂量变化
2.4阿托伐他汀治疗后PBL中CCL13的mRNA水平随时可变化研究结果表明CCL13 mRNA表达下调有一定时间依赖性。见图4。
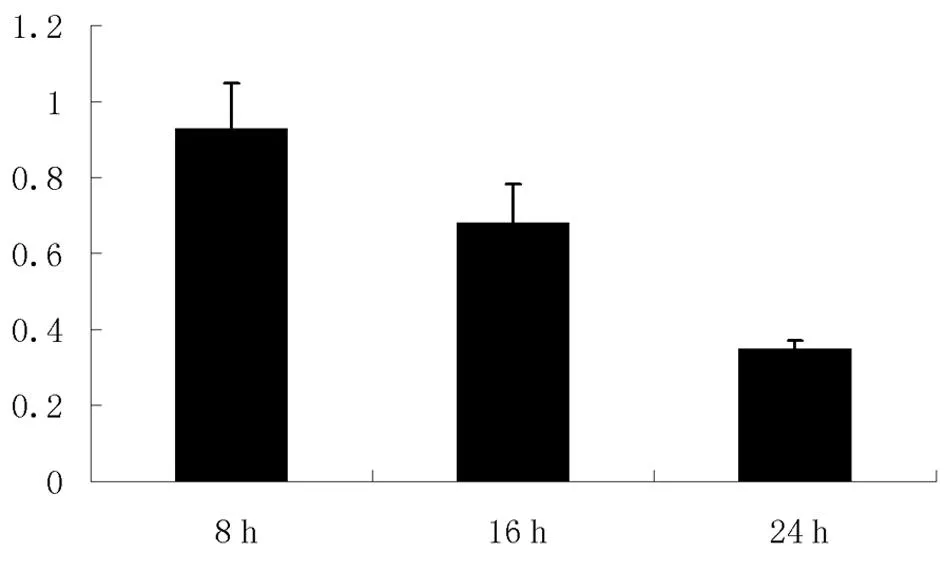
图4 在阿托伐他汀治疗后PBL中CCL13的mRNA水平随时间变化
3讨论
急性心肌梗死(AMI)是CAD的主要类型。AMI发生后常伴有梗死区及其周边区的炎性反应,并由纤维组织逐渐取代原梗死区内坏死自肌组织,形成瘫痕修复。干预这一炎症过程,可能会对AMI后心功能改善产生有益的作用,同时也可能有不利的影响。AMI临床治疗中干预该炎症过程是一个待开发的领域。

在高胆固醇血症患者的血清中的某些炎症趋化因子(IL-1,IL-6,TNF-α)有升高的现象[2]。临床研究表明,血浆中这些细胞因子的上调水平和心血管疾病的增长有关[2]。 T-淋巴细胞的活化在炎症发生过程中起着及其重要的作用。人单核细胞趋化因子4(CCL13)基因位于17号染色体长臂Cys-Cys (CC)细胞因子基因簇中。细胞因子是参与免疫调节和炎性反应的一类分泌蛋白家族。CC细胞因子具有特征性的两个临近半胱氨酸。CCL13对单核细胞、淋巴细胞、嗜碱细胞和嗜曙红细胞有趋化活性,但对嗜中性粒细胞没有趋化活性。这一趋化因子在过敏及非过敏性炎性反应中起到聚集白细胞的作用,也有可能在动脉粥样硬化中起到单核细胞招募的作用。研究表明,CCL13在遗传过敏性皮炎的发病早期和正常组织中的转录存在差异,这对于遗传过敏性皮炎的研究具有一定意义[2]。
他汀类药物抑制羟甲戊二酰辅酶A(HMG-CoA)和胆固醇的合成,上调LDL感受器从而提高动脉粥样硬化患者的个体存活率[3]。此外,其他活性有待进一步证明,包括内皮细胞功能的改进[4]、免疫调节[5]、增加纤维蛋白的溶解[6]、血栓症[7]以及糖尿病等。无论他汀类是否可能产生有益的改造,在培养人外周血淋巴细胞(PBL)的基因表达谱中,都可发挥重要作用。
最近的研究表明,他汀类降低致炎细胞因子 (TNF,IL-1,IL-6,IL-8,TGF-1,PAI-1)和趋化因子(CCL2)的表达[8-10]。相似于我们的研究结果,在人脐静脉内皮细胞中,他汀类治疗后,IL-8、CCL2 和 PAI-1的基因表达被抑制,而HMG-CoA 和 LDL-R的表达增加,推测由于他汀类多效性的影响,固醇介导调节元件结合蛋白,或参与其他转录调节机制。所有这些效应很可能有助于防止动脉粥样硬化性疾病。
趋化因子是一类控制涉及到各方面的炎症应答反应的免疫细胞移行和激活的蛋白质。他们已经确定为C、CC、CXC和CX3C亚科。 CCL2(单核细胞趋化蛋白-1的MCP-1),一个典型的促炎性趋化因子,在招募单核细胞到损伤和炎症部位的过程中起着重要的作用。据报道,阿托伐他汀能够降低急性冠脉患者血浆CCL2的含量。CCL7(MCP-3)能抑制粒细胞的招募并且与多项免疫性疾病有关[11]。
在系统性硬化症早期阶段,CCL7的过度表达表明它促进炎性细胞反应并且在炎症过程中招募巨噬细胞[12]。CCL13 (MCP的-4),是有关于免疫调节和炎症过程的一种分泌蛋白CCL18(肺活化调节趋化因子),是与巨噬细胞炎性蛋白1 α最具有同一性的[12]。 CXCL1有血管原活性[13]。已有报道表明细胞因子IL-1α,IL-6 和 IL-8日已被确定为促炎性反应的标志物,它们在阿托伐他汀治疗后的高胆固醇血症患者血浆中的水平下降[14],这正和我们从这项研究中得到的结论一致。这些都表明,阿伐他汀的抗发炎作用可能与直接抑制一些炎性趋化因子和细胞因子表达有关。
此外,我们发现了与炎性反应相关的新基因几个新基因,如PAI-2 (纤溶酶原激活物抑制因子-2),主要在活性炎症单核细胞和巨噬细胞的主要产物,是已被证明的外尿激酶型纤溶酶原激活剂(uPA)的抑制剂,参与抵抗细胞凋亡和调节转录[15]。SOCS2(抑制细胞因子的信号-2)是一个负调节的生长激素信号[16]。TGFβ1和TGFβ2(转化生长因子β1和β2)是管理增殖、分化和组织修复的多效肽[17]。TGF-β的整合素介导局部活化对急性肺损伤肺水肿的发生发展是至关重要的[18],因此,TGF-β的封锁或活化可能是有效的临床治疗手段。
总之,我们的初步结果表明,他汀类由于能够影响培养24 h的炎性细胞的基因表达,所以在临床上是有效的。通过直接抑制一些趋化因子和细胞因子在外周血淋巴细胞中的炎症基因表达而预防临床心血管疾病时,阿托伐他汀可能是有贡献的。
参考文献
1Cheng X,Liao YH,Zhang J,et al.Effects of Atorvastatin on Th polarization in patients with acute myocardial infarction. Eur J Heart Fail,2005,7:1099-1104.
2Alber HF,Frick M,Suessenbacher A,et al.Effect of atorvastatin on circulating proinflammatory T-lymphocyte subsets and soluble CD40 ligand in patients with stable coronary artery disease-a randomized, placebo-controlled study. Am Heart J,2006,151:139.
3Morikawa S,Takabe W,Mataki C,et al.The effect of statins on mRNA levels of genes related to inflammation, coagulation, and vascular constriction in HUVEC. Human umbilical vein endothelial cells. J Atheroscler Thromb,2002,9:178-183.
4Lefer AM,Campbell B,Shin YK,et al.Simvastatin preserves the ischemic-reperfused myocardium in normocholesterolemic rat hearts. Circulation,1999,100:178-184.
5Essig M,Nguyen G,Prie D,et al.3-Hydroxy-3-methylglutaryl coenzyme A reductase inhibitors increase fibrinolytic activity in rat aortic endothelial cells: role of geranylgeranylation and Rho proteins. Circ Res,1998,83:683-690.
6Undas A,Brummel KE,Musial J,et al.Simvastatin depresses blood clotting by inhibiting activation of prothrombin, factor V, and factor XIII and by enhancing factor Va inactivation. Circulation,2001,103:2248-2253.
7Takemoto M,Liao JK.Pleiotropic effects of 3-hydroxy-3-methylglutaryl coenzyme a reductase inhibitors. Arterioscler Thromb Vasc Biol,2001,21:1712-1719.
8Ascer E,Bertolami MC,Venturinelli ML,et al.Atorvastatin reduces proinflammatory markers in hypercholesterolemic patients. Atherosclerosis,2004,177: 161-166.
9Petr N,Gabriela J,Nada P,et al.Atorvastatin has distinct effects on endothelial markers in different mouse models of atherosclerosis. J Pharm Pharmaceut Sci,2006,9: 222-230.
10Xu ZM,Zhao SP,Li QZ,et al.Atorvastatin reduces plasma MCP-1 in patients with acute coronary syndrome. Clin Chim Acta,2003,338:17-24.
11Simi Ali,Graeme O’Boyle,Paul Mellor,et al.Chemokine receptor agonists can be used for anti-inflammatory therapy. The Journal of Immunology,2005,175:1257-1266.
12Ong VH,Evans LA,Shiwen X,et al.Monocyte chemoattractant protein 3 as a mediator of fibrosis: Overexpression in systemic sclerosis and the type 1 tight-skin mouse. Arthritis Rheum,2003,48:1979-1991.
13Iwamoto T,Okamoto H,Iikuni N,et al.Monocyte chemoattractant protein-4 (MCP-4)/CCL13 is highly expressed in cartilage from patients with rheumatoid arthritis. Rheumatology (Oxford),2006,45:421-424.
14Hieshima K,Imai T,Baba M,et al.A novel human CC chemokine PARC that is most homologous to macrophage-inflammatory protein-1-alpha/LD78-alpha and chemotactic for T lymphocytes, but not for monocytes. J Immun,1997,159:1140-1149.
15Barcelos LS,Talvani A,Teixeira AS,et al.Production and in vivo effects of chemokines CXCL1-3/KC and CCL2/JE in a model of inflammatory angiogenesis in mice. Inflamm Res,2004,53:576-584.
16Darnell GA,Antalis TM,Johnstone RW,et al.Inhibition of retinoblastoma protein degradation by interaction with the serpin plasminogen activator inhibitor 2 via a novel consensus motif. Mol Cell Biol,2003,23:6520-6532.
17Greenhalgh CJ,Rico-Bautista E,Lorentzon M,et al.SOCS2 negatively regulates growth hormone action in vitro and in vivo. J Clin Invest,2005,115: 397-406.
18Pittet JF,Griffiths MJ,Geiser T,et al.TGF-beta is a critical mediator of acute lung injury. J Clin Invest,2001,107: 1537-1544.
Effect of atorvastatin on the levels of inflammation-related factors mRNA in human peripheral blood lymphocyte in vitro
FENGDanyang,WANGLiming.
Xi’anElectricityCentralHospital,Xi’an710032,China
【Abstract】ObjectivesTo observe the effects of atorvastatin on the levels of inflammation-related factors mRNA in human peripheral blood lymphocyte (PBL) in vitro.MethodsThe venous blood 15ml of volunteers was collected and PBL was separated and cultured in vitro,then,the total RNA of cells was extracted and identified for its density and purity.The expression levels of inflammation-related factors mRNA were dynamically detected by Real-time PCR. The results were analyzed and compared between atorvastatin group and control group.ResultsAfter PBL was cultured in the medium with atorvastatin,the expression levels of CCL13,IL-8,PAI-1,TGF-2 mRNA were significantly decreased (P<0.05),however, the expression levels of HMG-CoA mRNA were obviously increased (P<0.05),furthermore, the numbers of low density lipoprotein receptor (LDL-R) were significantly increased (P<0.05). After 24-hour treatment with low-dose atorvastatin,the expression levels of CCL13 mRNA were significantly obviously decreased (P<0.05), however,the expression levels of CCL13 mRNA in high-dose atorvastatin were increased (P<0.05),moreover,the down-regulation of expressions of CCL13 mRNA was time-dependent at some extent (P<0.05).ConclusionThe statins can inhibit the expressions of inflammation genes of some chemotactic factors and cytokines in PBL,thus,which play a certain role in preventing cardiovascular events in clinic.
【Key words】atovaquone;peripheral blood lymphocyte;inflammation
(收稿日期:2015-09-22)
【中图分类号】R 331.125
【文献标识码】A
【文章编号】1002-7386(2016)06-0816-05
doi:10.3969/j.issn.1002-7386.2016.06.004

