丹参酮Ⅱ对乳鼠窦房结细胞快激活延迟整流钾电流的作用
张 宇,傅义程,王 瑞,赵晓静,蔡钟奇,陈 曦,徐 斌,赵 颖,李 泱*
(1解放军总医院心内科,北京 100853;2解放军第451医院门急诊科,西安 710054)
心脏的正常起搏点位于窦房结[1],窦房结起搏细胞的自发性搏动调控心脏的正常生理活动,细胞膜上各种离子通道的复杂活动构成窦房结电生理机制的基础[2−4]。病态窦房结综合征[5,6]以≥65岁老年人多见,发病率约为0.17%。窦房结细胞(sinoatrial node cells,SNC)为节律性活动细胞,其动作电位(action potential,AP)幅度小,无动作电位平台,静息电位绝对值低,4期不稳定,存在缓慢地自动除极[7,8]。研究表明,快激活延迟整流钾电流(IKr)对于该类细胞的复极起着重要作用,直接关系到细胞的搏动频率,从而对心率和节律产生主要的作用。
丹参酮Ⅱ(sodium tanshinoneⅡA sulfonate,STS)是从丹参根中提取并分离出的二萜醌类化合物,是丹参中的主要有效成分,具有抗心肌缺氧、抗心律失常功效[9−11]。但目前尚未知STS是否对SNCIKr电流存在作用。故本研究应用STS对IKr电流的作用,观察药物对其效应及可能的通道门控机制,以期为其降低病态窦房结综合征的发生机制提供实验依据。
1 材料与方法
1.1 试剂
DMEM细胞培养基(Thermo公司),胰蛋白酶1∶250、胰蛋白酶−EDTA消化液(Sigma公司),羟乙基哌嗪乙磺酸(HEPES)、二甲基亚砜(Amresco公司),胎牛血清(fatal bovine serum,FBS)、Opti-MEM无血清细胞培养基(Invitrogen公司)。
1.2 溶液配制
记录AP的电极内液(mmol/L):K-Aspartate 120,KCl 20,MgCl25,Na2ATP 5,HEPES 10,KOH调pH值至7.2。记录AP的细胞外液(mmol/L):NaCl 137,CaCl21.8,KCl 4,MgCl21,HEPES 10,葡萄糖10,pH值用NaOH调至7.4;记录IKr电流电极内液成分(mmol/L):KCl 130,MgCl21,MgATP 5,EGTA 5,HEPES 10,pH值用KOH调至7.2。记录IKr电流细胞外液(mmol/L):NaCl 110,KCl 30,CaCl21.8,MgCl21,HEPES 10,葡萄糖5,NaOH调pH值至7.4。并加入阻断剂4-AP 50μmol/L阻断超快激活钾电流(IKur),阻断剂CdCl2100μmol/L阻断L型钙电流(ICa,L),阻断剂BaCl2100μmol/L阻断钠电流(INa)。0.08%胰蛋白酶配制(g/L):胰蛋白酶0.8,NaCl 8,NaHCO30.353,葡萄糖0.991,KCl 0.298,HEPES 2,无菌条件下,用0.22μm滤膜过滤除菌,4℃冰箱保存。
1.3 乳鼠窦房结细胞的分离与培养
将出生24h内的Wistar大鼠10只,消毒后仰卧位固定,开胸暴露心脏。解剖显微镜下分离心包膜,于界嵴中部静脉窦侧、前腔静脉根部取2mm×2mm×2mm的组织块于DMEM中,吹打5次,于PBS液中剪成0.3mm×0.3mm×0.3mm小块,吸弃上清。加0.08%胰蛋白酶8ml,37℃水浴中震荡5min,吹打1min,沉淀后吸弃上清。加0.025%Ⅱ型胶原酶8ml,37℃水浴中震荡10min,吹打1min,沉淀后吸取上清于含20ml的15%FBS的DMEM 50ml的离心管中,重复消化3次,每次7min。940r/min离心7min。弃上清加培养液,将单细胞悬液接种于60mm的培养皿中,台盼蓝检测活细胞率达95%以上。37℃、5%CO2培养箱中孵育90min,差速贴壁以除去成纤维细胞,后加5−溴脱氧尿嘧啶核苷(5-BrdU)使其终浓度为0.1mmol/L并继续培养。倒置显微镜下观察细胞形态,在膜片钳放大器的全细胞模式下,以电流钳方式记录SNC自发AP。
1.4 药物灌流方法
将分离出的乳鼠SNC分为两组:对照组和STS组,对照组细胞未进行干预,STS组细胞应用STS 30μmol/L灌流。STS购于索莱宝试剂公司,纯品是无色的,相对分子质量为162。将STS用二甲基亚砜溶解,并制备成储备液,临用时采用细胞外液稀释成结果部分所示终浓度。采用局部灌流装置于细胞外恒流灌流方式给药,为确保药物效应的一致性,待平衡5min后方可记录电流。同时,将空白溶解STS所需体积的二甲基亚砜溶液加入细胞外液,未发现对电流有影响。
1.5 全细胞膜片钳的电流记录
在倒置显微镜下,选择边缘清楚、表面光滑、梭形细胞。将Axon-700B膜片钳放大器同计算机连接。刺激信号及电压输入信号的采集应用Digidata 1440A数模转换器,均由软件(pCLAMP10.2)控制。GG-17玻璃毛坯经pp-83微电极拉制仪拉制成入液电阻为2.0~5.5MΩ的电极。电极入液后进行液接电位补偿校正,使其至<(±2)mV,调节三维操纵器使电极尖端移向细胞表面进行封接,使电阻达1GΩ以上形成高阻封接,进行快电容补偿以消除仪器引入的电容误差。采用脉冲式方式负压吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4V/s的斜坡刺激,测电流并按方程Cm=Ⅰ/(dV/dt)计算(Cm为膜电容,Ⅰ为电流值,dV/dt即电压斜率)。
采用全细胞膜片钳记录方法,在电流钳模式下,不给任何刺激,记录自发性AP;在电压钳制下记录IKr电流。为消除细胞间的误差,Ⅰ值以电流密度(pA/pF)表示。信号经截止频率为1kHz的四阶贝塞尔低通滤波器滤波,采样率为5kHz。串联电阻补偿90%~95%以消除电压偏差;应用仪器自动进行慢电容补偿约为85%~90%,细胞实验在室温下(22℃~24℃)进行。
1.4 统计学处理
采用SPSS15.0软件对数据进行统计学分析。所有数据以均数±标准差表示,数据处理采用pCLAMP 9.2处理,两组间数据比较采用独立样本的t检验,多组间数据比较用ANOVA方差分析,组间两两比较用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 STS对乳鼠窦房结细胞起搏频率的作用
选取梭形细胞,在电流钳模式下,不给任何电信号刺激,记录细胞自发性AP。图1所示,在无任何电流刺激下,可记录到自发性AP。与对照组比较,应用10μmol/LSTS后,自动除极加快。细胞的搏动频率增加,从对照组的(157.2±10.3)次/min增加至STS组的(268.1±12.6)次/min(P<0.01)。
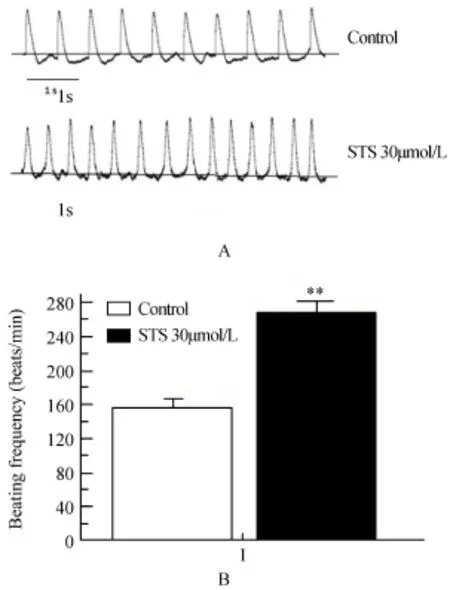
图1 STS对乳鼠窦房结细胞起搏频率的作用Figure 1 Effects of STS on the frequency of SNCs beatSTS:sodium tanshinoneⅡA sulfonate.A:the spontaneous action potentials of SNCs;B:comparison of beating frequency in control group and STS group.Compared with control group,**P<0.01
2.2 STS对乳鼠窦房结细胞IKr电流的作用及浓度依赖性
保持电位−40mV,施予+20mV,2000ms的去极化脉冲,记录IKr的时间依赖性电流(IKr,step),脉冲复极至−40mV时,时间为2000ms,记录IKr的尾电流(IKr,tail)。STS可以使窦房结细胞IKr,tail电流密度显著增加,在去极化为+60mV时,对照组细胞的IKr,tail电流密度为(54.6±4.7)pA/pF,而应用30μmol/LSTS后,IKr,tail电流密度增加至(86.3±8.3)pA/pF(P<0.01;图2A)。
将终浓度为1,3,10,30,100μmol/L的STS加入细胞外液,给予细胞与2.2相同的去极化电流刺激,观察药物对IKr电流的影响,发现其作用呈浓度依赖性特征,半数有效浓度(EC50)为(29.3±1.02)μmol/L,Hill系数为1.05(图2B)。
2.3 STS对乳鼠窦房结细胞IKr作用的电压依赖性
保持电位−40mV,施予−50mV~+60mV,2000ms的去极化脉冲,记录IKr,step电流,脉冲复极至−40mV时,时间为2000ms,记录IKr,tail。分别测量各组SNC在各电压时对应的IKr电流值,计算电流密度,并绘制Ⅰ-Ⅴ曲线图。结果表明,该电流随着刺激脉冲向去极化移动,IKr,step电流呈现出明显的内向整流特征,IKr,tail电流在+10mV以上呈现出的稳态现象。应用30μmol/L STS后使IKr,tail电流密度增加,尤其是在−10mV以上增加更加显著(图3)。
2.4 STS对乳鼠窦房结细胞IKr稳态激活和失活曲线的影响
保持电位−80mV,施予−60mV~+40mV,2000ms的去极化脉冲,阶跃为10mV,脉冲复极至−40mV时,时间为2000ms,记录IKr,tail。将尾电流标准化,以各电压下的刺激脉冲为横轴,以标准化尾电流为纵轴作图(图4A)。并用Boltzmann方程(I/Imax=1/{1+exp[(V1/2−Vm)/k]})进行曲线拟合求出半激活电压(V1/2,act)和激活曲线k值。30µmol/L STS灌流使V1/2,act由(−9.7±1.7)mV左移至(−17.8±3.4)mV(P<0.01);k值由(12.5±0.4)mV变为(10.9±0.2)mV。
保持电位−80mV,施予+40mV,500ms的预刺激,紧接着给予−120mV~+20mV,阶跃10mV,50ms的快速脉冲,紧接着在每一条件脉冲后紧跟一固定去极化至+40mV,2000ms的测试脉冲,记录IKr,tail。标准化各电流幅值,以相对电流对各膜电位作图得稳态失活曲线(图4B)。用Boltzmann方程(I/Imax=1/{1+exp[(Vm-V1/2)/k]})进行曲线拟合求出半失活电压(V1/2,inact)。30µmol/L STS灌流后,V1/2,inact由(−54.1±2.9)mV移至(−57.8±4.3m)V,k值由(21.0±2.3)mV变为(22.5±3.6)mV。

图2 STS对乳鼠窦房结细胞IKr电流的作用Figure 2 The effects of STS on IKrcurrents of SNCsSTS:sodium tanshinoneⅡA sulfonate.A:the concentration dependency of STS on SNCs;B:the effects of STS on tail currents of IKr;C:comparison of tail current densities in control group and STS group.Compared with control group,*P<0.05

图3 STS对乳鼠窦房结细胞IKr作用的电压依赖性Figure 3 The voltage dependency of STS on SNCsSTS:sodium tanshinoneⅡA sulfonate.A:the voltage dependency of STS on step currents of IKrin two groups.B:the voltage dependency of STS on tail currents of IKrin two groups
2.5 STS对乳鼠窦房结细胞IKr失活后恢复时间常数的影响
保持电位−80mV,施予+40mV,2000ms的预刺激,紧接着给予一个−120mV~−40mV,阶跃10mV,4000ms的系列测试脉冲,记录IKr,tail。按单项指数式{I(t)=A0[1-exp(1-t/τ)]}求算各电压下的失活后恢复时间常数(τ),以复活时间常数相对各膜电位作图得复活时间常数电压依赖性曲线(图5)。在各测试电压下,30µmol/L STS显著加速IKr失活后恢复(P<0.05)。

图4 STS对乳鼠窦房结细胞IKr稳态激活和失活曲线的影响Figure 4 Effects of STS on the steady-state curves of activation and inactivation of IKrcurrentSTS:sodium tanshinoneⅡA sulfonate.A:effects of STS on the steady-state curves of activation of IKrcurrent;B:effects of STS on the steady-state curves of inactivation of IKrcurrent
3 讨 论
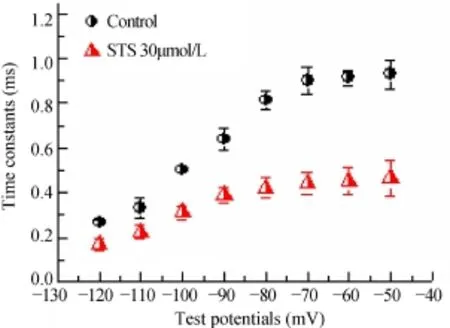
图5 STS对乳鼠窦房结细胞IKr失活后恢复的影响Figure 5 Effects of STS on the recovery after inactivation curves of IKrcurrentSTS:sodium tanshinoneⅡA sulfonate
本实验首先发现,中药单体STS对于SNC均有明显地增加细胞自律性的作用。我们知道,在窦房结疾病特别是窦性心律延缓或病态窦房结综合征时,SNC的自动节律性明显降低[12],心脏起搏异常,以致产生一系列心律失常,甚至导致血流动力学障碍[1,5,6]。而我们发现STS具有良好的加快SNC搏动的效应。丹参及其提取物已广泛用于治疗各种心血管疾病,Shan等[13]研究表明STS降低大鼠心肌梗死后心律失常发生率,减少室速和室颤的发生和持续时间,显著降低心肌梗死大鼠的死亡率。Sun等[14]研究表明HEK293细胞中STS能直接激活人IKr通道。我们之前研究表明,STS可以增加自发性高血压大鼠肠系膜动脉大电导钙激活钾通道(large conductance calcium-activated potassium channel,BKCa)电流的幅度和密度,且其激活作用呈电压依赖及浓度依赖性特征。鉴于此,本实验结果提示该药物对病态窦房结综合征等心律失常可能具有很好的应用前景。
本实验还发现,STS增加细胞自律性的原因主要与其缩短单细胞AP时程有关,而后者与药物明显升高IKr,tail电流密度关系密切。我们知道,IKr,tail电流作为窦房结起搏细胞的主要复极电流,参与AP快速相的形成。该通道的激活可以使AP时程缩短,自动除极加快,细胞的搏动频率增加。病理状态下,诸多原因导致IKr,tail电流减少,引起AP时程明显延长,细胞起搏频率降低。我们的研究结果显示,STS通过增加IKr,tail电流密度,显著缩短AP时程,进而加速了窦房结细胞的搏动频率。
通道门控机制研究结果显示,STS增加电流的效应主要与其使通道稳态激活曲线负移,加速通道激活有关。与对照组相比,STS组的稳态激活曲线向超极化方向移动,使半激活电压更接近静息电位,通道更易被激活。另外,也与药物在加快通道失活后恢复有密切关系。STS组SNCIKr,tail失活后恢复动力学加速,恢复时间常数缩短。提示在应用STS后,IKr通道将从失活状态迅速恢复。由于上述两种机制,导致STS显著增加IKr,tail电流。
众所周知,离子通道多分布于细胞膜上,之前需经过合成、迁移和定位过程[15,16]。而药物是否经过影响上述过程,还需进一步研究证明。尽管如此,本实验提供了STS通过增加IKr,tail电流,进而增加SNC自律性效应的结果。这对于降低病态窦房结综合征等心律失常的新药研发提供了部分实验依据。
【参考文献】
[1]Wu Y,Anderson ME.CaMKⅡ in sinoatrial node physiology and dysfunction[J].Front Pharmacol,2014,5:48.
[2]Perde FV,Atkinson A,Yanni J,et al.Morphological characteristics of the sinus node on postmortem tissue[J].Folia Morphol(Warsz),2015.doi:10.5603/FM.a2015.0087.[Epub ahead of print]
[3]Chen J,Makiyama T,Wuriyanghai Y,et al.Cardiac sodium channel mutation associated with epinephrine-induced QT prolongation and sinus node dysfunction[J].Heart Rhythm,2015.pii:S1547-5271(15)01035-8.doi:10.1016/j.hrthm.2015.08.021.[Epub ahead of print]
[4]Faggioni M,van der Werf C,Knollmann BC.Sinus node dysfunction in catecholaminergic polymorphic ventricular tachycardia:risk factor and potential therapeutic target[J]?Trends Cardiovasc Med,2014,24(7):273−278.
[5]Walsh-Irwin C,Hannibal GB.Sick sinus syndrome[J].AACN Adv Crit Care,2015,26(4):376−380.
[6]Morris GM,Kalman JM.Fibrosis,electrics and genetics.Perspectives in sinoatrial node disease[J].Circ J,2014,78(6):1272−1282.
[7]Zhao J,Liu T,LiG.Relationship between two arrhythmias: sinus node dysfunction and atrial fibrillation[J].Arch Med Res,2014,45(4):351−355.
[8]Kelder TP,Vicente-Steijn R,Harryvan TJ,et al.The sinus venosus myocardium contributes to the atrioventricular canal: potential role during atrioventricular node development[J]? J Cell Mol Med,2015,19(6):1375−1389.
[9]Wei B,Li WW,Ji J,et al.The cardioprotective effect of sodium tanshinoneⅡA sulfonate and the optimizing of therapeutic time window in myocardial ischemia/reperfusion injury in rats[J].Atherosclerosis,2014,235(2):318−327.
[10]Zhang MQ,Zheng YL,Chen H,et al.Sodium tanshinoneⅡA sulfonate protects rat myocardium against ischemia-reperfusion injuryviaactivation of PI3K/Akt/FOXO3A/Bim pathway[J].Acta Pharmacol Sin,2013,34(11):1386−1396.
[11]Shang Q,Wang H,Li S,et al.The effect of sodium tanshinoneⅡA sulfate and simvastatin on elevated serum levels of inflammatory markers in patients with coronary heart disease:a study protocol for a randomized controlled trial[J].Evid Based Complement Alternat Med,2013,2013:756519.
[12]Schweizer PA,Schroter J,Greiner S,et al.The symptom complex of familial sinus node dysfunction and myocardial noncompaction is associated with mutations in the HCN4 channel[J].J Am Coll Cardiol,2014,64(8):757−767.
[13]Shan H,Li X,Pan Z,et al.TanshinoneⅡA protects against sudden cardiac death induced by lethal arrhythmiasviarepression ofmicroRNA-1[J].BrJ Pharmacol,2009,158(5):1227−1235.
[14]Sun DD,Wang HC,Wang XB,et al.TanshinoneⅡA:a new activator of human cardiac KCNQ1/KCNE1[(I(Ks)]potassium channels[J].Eur J Pharmacol,2008,590(1−3):317−321.
[15]Yang KC,Nerbonne JM.Mechanisms contributing to myocardial potassium channel diversity,regulation and remodeling[J]. Trends Cardiovasc Med,2015. pii:S1050-1738(15)00183-8.doi:10.1016/j.tcm.2015.07.002.[Epub ahead of print]
[16]Moric-Janiszewska E,Glogowska-Ligus J,Paul-Samojedny M,et al.Expression of genes KCNQ1 and HERG encoding potassium ion channelsIkr,Iksin long QT syndrome[J].Kardiol Pol,2011,69(5):423−429.

