骨桥蛋白靶向磁性纳米探针对动脉斑块的分子成像
乔红玉,王亚斌,高 磊,徐 斌,江振华,梁 潇,田 捷,曹 丰,*
(1第四军医大学西京医院心内科,西安 710032;2解放军总医院心内科,北京 100853;3中国科学院自动化研究所,北京100190)
2013年中国心血管病报告显示,中国心血管病患病率处于持续上升阶段,截止到2013年,全国共有心血管病患者2.9亿。2012年心血管病死亡率为255/10万人,即每天9590人、每小时400人、每10秒钟1人死于心血管病。而病理研究结果显示:急性心肌梗死通常是由于动脉粥样硬化斑块的破裂所致[1,2],因此,识别易损斑块是预防急性心血管事件的重要内容。
临床研究表明,半数以上的动脉粥样硬化患者通常以突然死亡或急性心肌梗死为临床首发症状[3]。临床上现今用于心血管事件预防的方法有很多,但都不能达到理想的效果。举例来说,接近2/3的急性冠脉综合征患者在进行Framingham风险评分时,事实上都是属于中等风险的[4]。而临床上常用的辅助手段如血管造影、血管内超声(intravenous ultrasound,IVUS)及光学相干断层成像(optical coherence tomography,OCT)等也或多或少存在局限性。如:血管造影仅能检测出堵塞的血管,而IVUS和OCT仅能利用斑块成分的不同对比度进行分析来衡量斑块的性质,并不能从分子生物学的角度对动脉粥样硬化斑块的进展情况进行预测。
分子影像作为新兴的一项技术,为从分子生物学角度进行疾病诊断提供了工具[5]。而该技术的实现需要借助诸多成像设备如:光学、磁共振、正电子发射计算机断层显像(positron emission computed tomography/computed tomography,PET/CT)等,而其中荧光成像具有高灵敏度、易实现等特点,有良好的应用前景。理想的靶点是分子影像的一个重要组成因素。众所周知,易损斑块通常具有以下特征:薄纤维帽、巨噬细胞的大量聚集及巨大的坏死中心等[6]。骨桥蛋白(osteopontin,OPN)是一种具有多样功能的分泌性蛋白,在动脉粥样硬化斑块中有表达,且研究证实巨噬细胞来源的泡沫细胞能分泌产生大量OPN,以进一步地促进巨噬细胞的迁移和活化[7,8]。因此,OPN有希望作为一个靶点,通过靶向泡沫细胞进而识别易损斑块。本实验旨在构建一个偶联有OPN抗体和Cy5.5荧光染料的四氧化三铁纳米探针,通过光学三维成像来实现对动脉粥样硬化斑块的识别。
1 材料与方法
1.1 材料
实验所用6周大小雌性ApoE−/−小鼠及高脂饲料(15%脂肪,0.25%胆固醇)购买于北京维通利华公司。OPN抗体购自美国Abcam公司,N−羟基琥珀酰亚胺(NHS)、1−(3−二甲氨基丙基)−3−乙基碳二亚胺盐酸盐(EDC)均购自美国Sigma公司,Cy5.5-NHS购自美国GE公司,二巯基丁二酸修饰的四氧化三铁纳米颗粒(meso-2,3-dimercaptosuccinic acid-Fe3O4magnetic nanoparticles,DMSA-MNPs)购自南京东纳生物科技有限公司,TUNEL试剂盒购自上海罗氏,小动物活体成像仪购自美国Caliper公司,共聚焦显微镜购自日本(Olympus FV 10i)。
1.2 方法
1.2.1 模型建立 将20只C57BL/6J ApoE−/−小鼠分为模型组及对照组,模型组经高脂饲料喂养20周,建立动脉粥样硬化模型,对照组用普通鼠粮喂养。
1.2.2 Cy5.5-anti-OPN-DMSA-MNPs探针的构建 取10ml稀释为1g/L的DMSA-MNPs溶液,先后加入0.2ml浓度为10g/L的EDC溶液和0.3ml浓度为10g/L的NHS溶液,室温下固定于翻转摇床上摇晃30min。取0.4ml OPN抗体(25g/L)缓慢加入到DMSA-MNPs混合溶液中,置于4℃翻转摇床上低速摇晃12h。离心除去多余抗体,加入100μl NHS-Cy5.5溶液(20g/L),避光在室温下置于摇床上摇晃4h。离心,用强力磁铁收集沉淀即为备用的探针。
1.2.3 DMSA-MNPs的表征 透射电镜观察DMSA-MNPs形态和粒径大小:将样品稀释,滴一滴溶液于透射电镜专用铜网上,常温下风干,在透射电镜下观察并拍照。
1.2.4 Cy5.5-anti-OPN-DMSA-MNPs探针经细胞摄取后的荧光成像 将小鼠的Raw264.7巨噬细胞系用1640培养基(加10%胎牛血清)培养,取对数生长期细胞,种于24孔板(105/孔),待细胞长至70%时,加入Ox-LDL(50mg/L)刺激24h,然后分别向其中加入不同浓度Cy5.5-anti-OPN-DMSA-MNPs:0,5,15,30,50mg/L。孵育12h后去离子水洗3min×3次,去除未被细胞摄取的颗粒。使用PBS将细胞吹下,转移至黑色96孔板,使用小动物活体成像仪进行荧光成像。参数设置如下:曝光时间(exposure time):30s,binning 4,f/stop 2,激发波长(excitation wavelength)640nm,emission Cy5.5。
1.2.5 Cy5.5-anti-OPN-DMSA-MNPs探针的细胞毒性检测 Cy5.5-anti-OPN-DMSA-MNPs探针对Raw264.7细胞活力影响的MTT检测:将对数生长期细胞以104/孔的数量接种至96孔板中,待细胞长至70%时,加入不同浓度探针:0,5,10,15,20,25,30mg/L,孵育24h后,每孔加入20μl MTT溶液,细胞培养箱中孵育4h后小心吸去上清,每孔加入150μl的DMSO,室温下水平摇床缓慢摇荡10min,酶标仪测定A490nm。
Cy5.5-anti-OPN-DMSA-MNPs探针对Raw264.7细胞凋亡的TUNEL检测:将对生长数期细胞以105/孔的数量接种至预先加有爬片的24孔板中,待细胞贴壁后,加入不同浓度的探针:0,10,20,25,30mg/L,细胞培养箱孵育24h,取出细胞爬片,PBS清洗3min×3次,使用4%多聚甲醛固定15min,PBS轻柔清洗后,使用0.1%Triton100透膜5min,PBS轻柔清洗,3min×3次;TUNEL工作液按说明书配置,滴至细胞爬片,于37℃孵育1h,PBS轻柔清洗,3min×3次;使用DAPI工作液滴于细胞爬片,室温孵育5min,PBS轻柔清洗,5min×3次;细胞爬片自然风干,中性甘油封片,荧光显微镜下观察。
1.2.6 动脉粥样硬化模型的大体油红染色 将血管自颈动脉到腹主动脉从小鼠体内分离后,用PBS洗净,剥去外膜,剪开后固定于4%多聚甲醛,24h后使用油红工作液固定2h,70%异丙醇脱色,直至血管壁变白为止,固定拍照。
1.2.7 动脉粥样硬化模型小鼠的在体3D荧光成像将小鼠用异氟烷麻醉后,脱去颈部的毛发,以仰卧位置于成像台上,探针经小鼠尾静脉注入(5mg Fe/kg),参数设置如下:曝光时间(exposure time):30s,binning 4,f/stop 2,激发波长(excitation wavelength)640nm,emission Cy5.5,以小鼠表面任意4个点为基点,选取仰卧位动物模板,进行三维成像。
1.2.8 组织切片的HE染色及Cy5.5激光共聚焦检测 在体成像结束后,将小鼠颈部血管取出做冰冻切片,通过HE染色鉴别斑块部位的同时将冰冻切片用PBS洗涤5min×3次,DAPI工作液染色3min之后,PBS清洗1min×3次,激光共聚焦显微镜照相,以确定探针富集部位。
1.3 统计学处理
利用GraphPad Prism-5软件进行数据分析,组间两两比较采用LSD-t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 探针的表征
DMSA-MNPs以串联的方式先后偶联OPN抗体和Cy5.5荧光染料,示意图见图1A,电镜结果显示,DMSA-MNPs核心颗粒大小为7.2nm(图1B),Cy5.5的偶联使得探针表现出明显的光学效应,且光学信号随着细胞探针的浓度增加表现出相应的线性增加(图1C)。
2.2 探针的毒性检测
MTT结果显示,不同浓度探针:0,5,10,15,20,25,30mg/L相较于对照组来说,细胞活性差异无统计学意义(A490nm:1.10±0.03,1.05±0.03,1.03±0.02,0.96±0.02,0.96±0.03,0.93±0.03vs1.11±0.05,P>0.05;图2A);TUNEL结果显示,不同浓度的探针:0,10,20,25,30mg/L与对照组比较来说,细胞凋亡率差异无统计学意义[(21.2±1.5)%,(21.8±1.1)%,(21.5±1.2)%,(22.3±1.2)%vs(20.5±1.0)%,P>0.05;图2B],综合以上结果可知,探针浓度即使加到30mg/L时仍未表现出明显的细胞毒性。
2.3 在体的小鼠3D荧光成像及离体鉴定
血管的大体油红染色结果显示,高脂喂养组小鼠血管壁有明显的动脉粥样硬化斑块,红色面积显著高于对照组(40%vs5%,P<0.05;图3A)。小鼠的在体3D荧光成像显示,在小鼠颈动脉处表现出明显的信号点(图3B),且体外激光共聚焦结果显示探针主要集中在斑块内(图3C)。
3 讨 论

图1 探针的相关表征Figure 1 Characterization of probesA:the schema of Cy5.5-anti-OPN-DMSA-MNPs;B:transmission electron microscope(TEM)images,average iron core size was 7.2nm;C:the fluorescence feature of probes and after incubation the probes with foam macrophages for 24h,which were induced by Ox-LDL(50mg/L),the signal intensity was linearly proportional to the concentration of probes
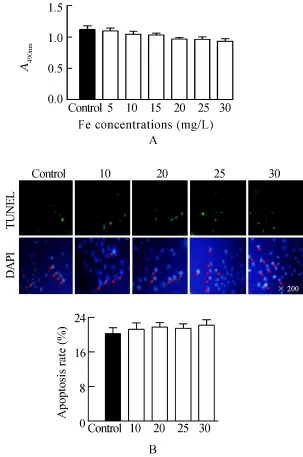
图2 探针的细胞毒性检测Figure 2 Cytotoxicity assessment of probesA:The MTT results showed that there was no significant discrepancy on cells’viability between different concentrations and control group(A490nm:1.10±0.03,1.05±0.03,1.03±0.02,0.96±0.02,0.96±0.03,0.93±0.03 vs 1.11±0.05,P>0.05);B:The TUNEL positive nuclei in each group were calculated and no significant difference was found[(21.2±1.5)%,(21.8±1.1)%,(21.5±1.2)%,(22.3±1.2)%vs(20.5±1.0)%,P>0.05]
如今,越来越多的研究都着眼于易损斑块的分子层面,寻找靶点,从而进行诊断。分子影像也因此成为热点工具[9]。良好的探针是分子影像能够实现的重要保证,纳米颗粒因具有以下优势而被广泛应用。首先,纳米颗粒的大小和诸多生物大分子大小一致,因此在血液循环过程中不会带来血管的阻塞;其次,纳米颗粒本身可以由很多材料组成,如:脂质,金属等,应用范围较为广泛;另外,纳米颗粒的合成和修饰过程都可以进行严格控制,一方面可以保证实验的需求,另一方面也可以提高自身的生物相容性[10]。本实验中采用的四氧化三铁纳米颗粒,除以上优势外,还具有安全性好、容易制备的特点[11]。
巨噬细胞被认为是斑块易损性的重要特征之一,而OPN的表达被认为与巨噬细胞的迁移和活化密切相关。先前的研究表明:OPN过表达时,动脉粥样硬化斑块的面积会增加,且巨噬细胞的聚集增多;反之,当OPN下调时,斑块的面积会较小,且伴随着巨噬细胞的聚集减少[12,13],因此OPN有望成为一个靶向动脉粥样硬化斑块的重要靶点。

图3 动脉粥样硬化模型的建立及探针注射后的荧光成像Figure 3 Fluorescence imaging of atherosclerotic modelsHFD:high fat diet.A:oil red staining of mice feeding with high fat diet and the control group,the area of plaques was significantly higher in atherosclerotic group(40%vs 5%,P<0.05);B:3D fluorescence imaging of atherosclerotic model after tail-vein injection of probes for 24h and predominant signal was observed in the carotid artery;C:images taken by confocal fluorescent microscope showed that our probes mainly located in the plaque,which was further characterized by HE staining
如今,临床上动脉粥样硬化斑块的破裂通常发生在症状发生之前,因此,如何有效且及时识别易损斑块,并有针对性地采取措施,是临床亟待解决的难题[14]。本实验中,我们采用OPN作为靶向分子,采用三维光学的成像手段,有效地识别了动物模型颈部斑块。虽然目前光学成像由于穿透力有限,尚不能有效地从体表获取动物体深部的信号,但是得益于血管内近红外荧光传感导管技术的发展,荧光成像将在未来有希望应用于临床[15]。
OPN靶向的四氧化三铁纳米颗粒在本实验中取得了较好的识别斑块效果,相较于之前的研究[16,17],三维光学成像能更直观地展示动脉粥样硬化斑块所在的位置,但是仍需要对所识别斑块的性质进行研究,我们希望能借助于OPN分子与巨噬细胞的密切联系,实现对易损斑块的识别和诊断,从而有效地降低急性心血管事件的发生率。
【参考文献】
[1]FinnAV,Nakano M,NarulaJ,etal.Conceptof vulnerable/unstable plaque[J].Arterioscler Thromb Vasc Biol,2010,30(7):1282−1292.
[2]Libby P.Mechanisms of acute coronary syndromes and their implications for therapy[J].N Engl J Med,2013,368(21):2004−2013.
[3]Zheng ZJ,Croft JB,Giles WH,et al.Sudden cardiac death in the United States,1989 to 1998[J].Circulation,2001,104(18):2158−2163.
[4]Naghavi M,Libby P,Falk E,et al.From vulnerable plaque to vulnerable patient:a call for new definitions and risk assessment strategies:PartⅠ[J].Circulation,2003,108(14):1664−1672.
[5]Qiao HY,Li S,Cao F.Molecular imaging of stem cell-based therapy for ischemic heart disease[J].Chin Heart J,2014,26(6):727−729,736.[乔红玉, 李 霜,曹 丰.干细胞治疗缺血性心脏病的分子影像评价[J].心脏杂志,2014,26(6):727−729,736.]
[6]Virmani R,Burke AP,Farb A,et al.Pathology of the vulnerable plaque[J].J Am Coll Cardiol,2006,47(8 Suppl):C13−C18.
[7]Giachelli CM,Lombardi D,Johnson RJ,et al.Evidence for a role of osteopontin in macrophage infiltration in response to pathological stimuliin vivo[J].Am J Pathol,1998,152(2):353−358.
[8]Bidder M,Shao JS,Charlton-Kachigian N,etal.Osteopontin transcription in aortic vascular smooth muscle cells is controlled by glucose-regulated upstream stimulatory factor and activator protein-1 activities[J].J Biol Chem,2002,277(46):44485−44496.
[9]Quillard T,Libby P.Molecular imaging of atherosclerosis for improving diagnostic and therapeutic development[J].Circ Res,2012,111(2):231−244.
[10]Cheng Z,Al Zaki A,Hui JZ,et al.Multifunctional nanoparticles:costversusbenefit of adding targeting and imaging capabilities[J]. Science,2012,338(6109):903−910.
[11]Bourrinet P,Bengele HH,Bonnemain B,et al.Preclinical safety and pharmacokinetic profile of ferumoxtran-10,an ultrasmall superparamagnetic iron oxide magnetic resonance contrast agent[J].Invest Radiol,2006,41(3):313−324.
[12]Bruemmer D,Collins AR,Noh G,et al.AngiotensinⅡ-accelerated atherosclerosis and aneurysm formation is attenuated in osteopontin-deficient mice[J].J Clin Invest,2003,112(9):1318−1331.
[13]Chiba S,Okamoto H,Kon S,et al.Development of atherosclerosis in osteopontin transgenic mice[J].Heart Vessels,2002,16(3):111−117.
[14]Arbab-Zadeh A,Fuster V.The myth of the“vulnerable plaque”:transitioning from a focus on individual lesions to atherosclerotic disease burden for coronary artery disease risk assessment[J].J Am Coll Cardiol,2015,65(8):846−855.
[15]Chen IY,Wu JC.Cardiovascular molecular imaging:focus on clinical translation[J].Circulation,2011,123(4):425−443.
[16]Briley-Saebo KC,Cho YS,Shaw PX,et al.Targeted iron oxide particles forin vivomagnetic resonance detection of atherosclerotic lesions with antibodies directed to oxidation-specific epitopes[J].J Am Coll Cardiol,2011,57(3):337−347.
[17]Skajaa T,Cormode DP,Jarzyna PA,et al.The biological properties of iron oxide core high-density lipoprotein in experimental atherosclerosis[J].Biomaterials,2011,32(1):206−213.

