番茄溃疡病病原菌致病性的鉴定
张庆萍,王燕春,徐 佳,周艳芳,邱廷艳
(1.内蒙古农牧业科学院植物保护研究所,内蒙古呼和浩特 010031;2.赤峰市农牧科学院 植保所,内蒙古赤峰 024000;3.喀喇沁旗植保植检站,内蒙古锦山 024400)
番茄溃疡病是一种由细菌引起的毁灭性病害,其病原为密执安棒杆菌番茄溃疡病致病型Clavibacter michiganensis subsp.Michiganensis(Smith)[1-2]。近几年在赤峰市松山区、红山区、元宝山区、喀喇沁旗及翁牛特旗等番茄种植基地均有不同程度发生,一般发病率10%~20%,严重的达50%以上,甚至造成毁棚,而且有扩展蔓延的趋势。
从2011年开始我们对番茄溃疡病综合防治技术进行了研究。研究发现,在不同地区采集的病菌其致病力有所不同,甚至在同一地区不同时间采集的病菌的致病力也存在差异,明确不同来源溃疡病菌的致病力差异是探索该病菌多态性以及开展其他相关研究的重要基础[3],对此我们进行了以下试验。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株 供试菌株包括不同年份分离自赤峰市不同地区番茄溃疡病发病田植株的菌株,共33株[4],见表 1。
1.1.2 植物材料 供试番茄品种为普罗旺斯。育苗基质经160℃干热灭菌5 h,冷却后装入50穴(5行×10列)育苗盘中,用水充分浸润基质24 h,随后播种番茄种子,每穴2粒,在温室中(日平均气温为26℃左右,夜间最低温度控制在15~18℃,白天最高温度为32~35℃;相对湿度控制在30%~60%,日平均相对湿度为42%)育苗;播种后7~10 d间苗,每穴选留1株长势均匀健壮的幼苗,培育至2~3片真叶期供接种用。

表1 供试菌株
1.1.3 培养基 523培养基:蔗糖10 g,酵母膏4 g,酸水解酪素8 g,磷酸氢二钾1 g,硫酸镁0.3 g,琼脂18 g(液体不加琼脂),水 1000 mL。
1.2 试验方法
1.2.1 病原菌鉴定 病株分别是从2011—2016年在呼和浩特市赛罕区、赤峰市松山区、红山区、元宝山区、喀喇沁旗、宁城县等采集的经分离鉴定所得。
1.2.1.1 培养基的配制 选用523培养基(番茄溃疡病专用培养基):蔗糖10 g,酸水解酪素8 g,酵母膏4 g,磷酸氢二钾1 g,硫酸镁0.3 g,琼脂15~18 g,水1000 mL,pH值6.8~7.1。
1.2.1.2 分离方法 将病茎用自来水和蒸馏水冲洗干净,剪成1~2 cm小段,在70%的酒精中浸泡30 s,用灭菌水冲洗3~4次,放入灭菌的研钵中,研磨挤压出组织液,向研钵中滴入1~2滴无菌水与组织液充分混合,吸取0.1 mL混合液,接入523平板培养基中,用玻璃刮铲涂抹均匀,放于28℃恒温培养箱中培养1~2 d。
1.2.1.3 病原菌形态特征观察 病原菌初分离成功后,对病原菌进行单菌落的分离,28℃下培养48 h后,观察单菌落的形状、大小、颜色等形态特征。
1.2.1.4 染色及镜检 采用革兰氏染色法,溃疡菌经染色后置显微镜下观察为棍棒状,紫色,为革兰氏阳性菌。
1.2.1.5 致病性测定 确定供试病原细菌的致病性,采用蘸根接种方法对番茄幼苗进行回接实验。盆栽番茄(番茄种子在0.01%醋酸中消毒24 h后,催芽,待露白芽后播种于灭菌土壤中)接种时期选择播种后2~3片真叶期番茄幼苗。将幼苗从土中拔出来伤根,在菌悬液中浸泡15 min,然后再重新栽种。在室温下培养、观察发病情况,一般14~21 d就可表现症状,表现为萎蔫。再将接种后的显症植株,进行病原菌分离,可得到与所接菌相同的病原菌,且培养基上的细菌生长情况、菌落情况都表现一致,确定此细菌即为番茄溃疡病的致病菌。
1.2.2 接种体的制备 冻存于-80℃超低温冰箱的Cmm菌株于523培养基平板上进行活化,活化好的菌株在523培养基上培养72 h后,挑取单菌落在523液体培养基中摇培24 h,通过平板计数法确定菌液浓度达到109cfu/mL后备用(菌液稀释倍数为10-9)。
1.2.3 接种方法[5-6]使用14 cm手术剪(型号:PTJ-3)的前端1 cm蘸取菌悬液后在番茄幼苗真叶上部1~2 cm处将主茎剪断,每株菌株的接种处理设3个重复,每个重复接种5株番茄幼苗,以无菌水为空白对照。接种的幼苗在温室中培养,适时浇水保证秧床土壤湿润。接种后30~40 d,调查记录发病情况,计算病情指数。参照罗来鑫等的方法对番茄幼苗的溃疡病进行分级:0级,不出现叶片(或子叶)萎蔫或茎坏死;1级,叶片(或子叶)轻度变黄或萎蔫;2级,叶片(或子叶)中度萎蔫或茎轻度坏死;3级,叶片(或子叶)严重萎蔫或茎严重坏死;4级,植株死亡。
1.2.4 病原菌的再分离 方法同1.2.1.2。
2 结果与分析
2.1 病原菌的形态特征
病原菌纯化后48 h,番茄溃疡病菌在523培养基上菌落呈凸圆形,不透明,鲜黄色,平滑,黏稠状,边缘无锯齿,直径1~3 mm。显微观察细菌体短杆状棍棒形,大小测定为(0.3~6.6)μm×(0.6~1.1)μm。经革兰氏染色,革兰氏反应阳性。经鞭毛染色后观察无鞭毛。
2.2 回接分离结果
再将接种后的显症植株,进行病原菌分离,可得到与所接菌相同的病原菌,且培养基上的细菌生长情况、菌落情况都表现一致,确定此细菌即为番茄溃疡病的致病菌。
2.3 病原菌致病力检测结果
由表2可以看出,不同菌株的致病力不同[7-8]。用病情指数来表示菌株致病力的大小,将菌株致病力分为4个等级,分别为致病力强(病情指数在80~100)、致病力中等(病情指数在 60~80)、致病力弱(病情指数在60以下)和无致病力(病情指数为0)。试验的33个菌株均有致病力,其中属于强致病力的菌株为以下 12 个:TDP14042602、TCF12032804、TNM13060301-2、TWNT13091403、TCF13061901、T CZ13061301、TWNT13091404、XTLS15052201、TBW 15042001、TDP15012101、TDP15012102 和 TDP15073101;属于中等致病力的菌株为以下18个:TDP13091402、TWNT13091405、TDP14022502、TDP13091401、TKTJ14072302、TCZ12103001、TYB12061302、TCZ13051501、TKTJ14062501、TAQ13061401、TGS15012701、TBW15042003、TCZ15042201、TBW15042004、TDP15042702、XTLMD15052202、TNC15020301 和 XTBDM 15062801;属于弱致病力的菌株为以下3个:TYB12061301、TDP14042601 和 TBW15020401。

表2 菌株致病性测定结果
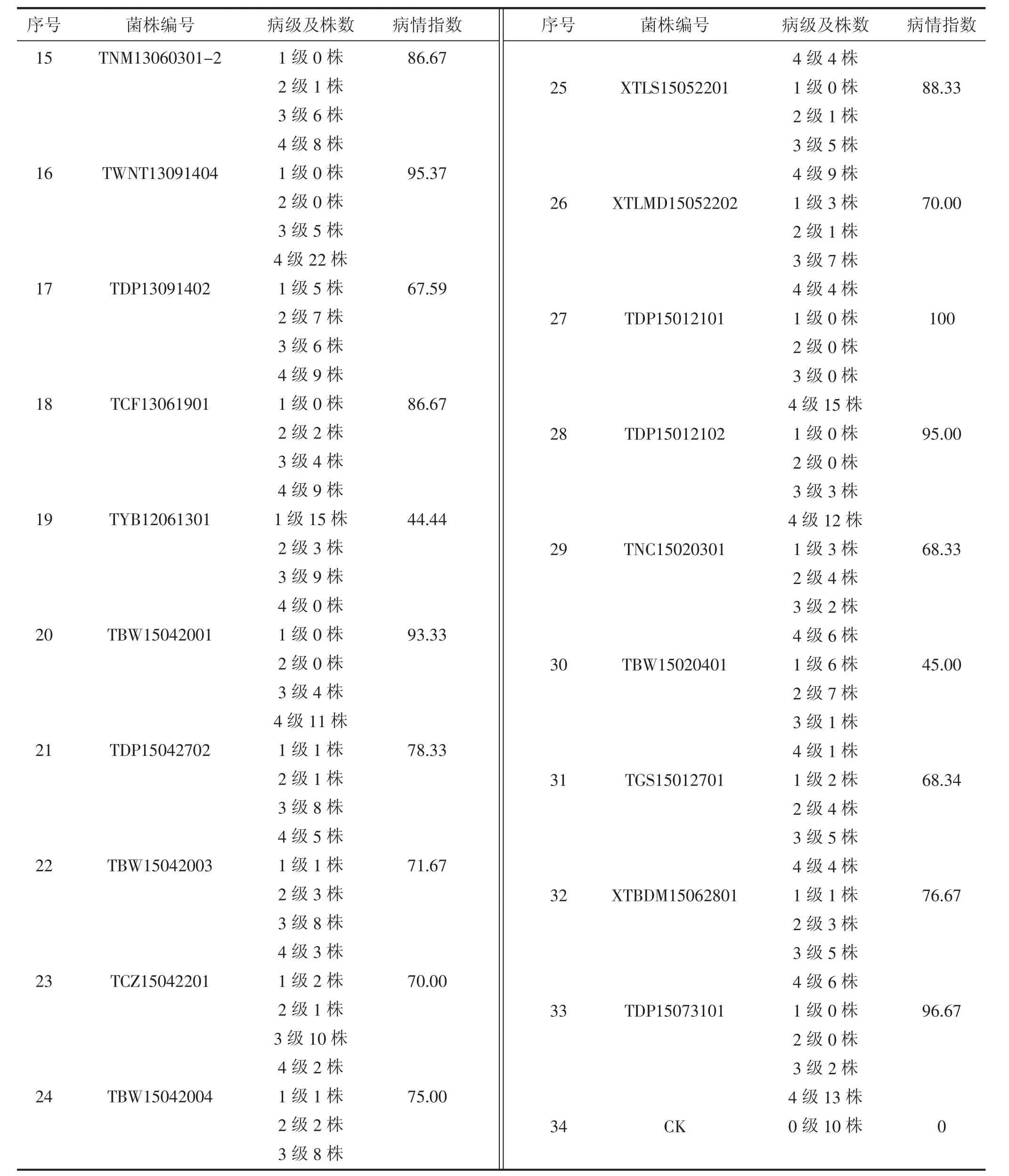
续表2
3 讨论
研究结果表明,在番茄幼苗真叶上部1~2 cm处将主茎剪断接种可较好地测定不同来源番茄溃疡病菌的致病力差异,根据病情指数可将病菌分为强(病情指数在 80~100)、中(病情指数在 60~80)、弱(病情指数在60以下)等不同的致病类型。不同菌株致病力不同,不同地区菌株致病力之间也存在差异。从发病幼苗分离Cmm时,使用523半选择性培养基可以避免其他杂菌及腐生菌的污染,从而有效地分离到目标菌。本研究中所选用的番茄品种普罗旺斯为赤峰地区主栽品种。目前国外虽然有文献报道[8-9],在一些与栽培番茄有亲缘关系的野生种中,发现了一些对Cmm具有中度抗性的种质资源,但世界上尚无商品化的番茄溃疡病抗性品种[10],这也是番茄抗病育种急需解决的难题之一。
参考文献:
[1]王溪桥,左佳妮,尤 佳,等.不同药剂处理种子对番茄细菌性溃疡病菌的除害效果[J].河南农业科学,2016,45(3):92-97.
[2]张留江,李荣博,刘蕴贤.设施农业发展与蔬菜病虫害防治策略[J].天津农业科学,2010,16(2):149-151.
[3]王 蕊,罗来鑫,李健强.不同来源番茄溃疡病菌致病力差异研究[J].植物保护,2010,36(1):73-76.
[4]赵廷昌,王 克,白金恺,等.东北地区番茄细菌性溃疡病的发生和端原菌鉴定研究[J].植物病理学报,1993,3(1):29-34.
[5]郝永娟,刘春艳,王 勇,等.天津市蔬菜病害发生动态及防治对策[J].天津农业科学,2009,15(1):69-71.
[6]李健强,罗来鑫,刘西莉,等.番茄病原细菌的接种方法[P].中国:ZL200510011433,2006.
[7]Louws F J,Bell J,Medina-Mora C M,et al.Rep-PCRMediated genomic fingerprinting:A rapid and effective method to identify Clavibacter michiganensis [J].Phytopathology,1998(88):862-868.
[8]罗来鑫,赵廷昌,李健强,等.番茄细菌性溃疡病研究进展[J].中国农业科学,2004,37(8):1144-1150.
[9]Luo L X,Bolkan H,Li J Q,et al.Quantification of viable cells of Clavibacter michiganensis subsp.michiganensis using a DNA binding dye and a real-time PCR assay[J].Plant Pathology,2008(57):332-337.
[10]程伯瑛.怎样防治番茄溃疡病[J].山西农业科学,1989,17(8):27.

