獭兔成纤维细胞生长因子5(FGF5)基因的多态性研究
刘 健,马义涛,潘俊龙,翁巧琴,张金枝*
(1.浙江大学动物科学学院,浙江杭州 310058;2.余姚市欣农兔业有限公司)
獭兔成纤维细胞生长因子5(FGF5)基因的多态性研究
刘健1,马义涛1,潘俊龙1,翁巧琴2,张金枝1*
(1.浙江大学动物科学学院,浙江杭州 310058;2.余姚市欣农兔业有限公司)
摘要:随机选择5月龄左右獭兔50只。采用直接测序方法检测獭兔成纤维细胞生长因子5(FGF5)基因第4个外显子的基因多态性;并对獭兔毛皮性状的相关数据进行方差分析和多重比较;将獭兔CDS编码区序列同其他物种进行比对。结果发现,所选獭兔群中,未发现碱基突变位点,在所有的个体中,仅发现一种单倍体型;獭兔的主要毛皮性状差异不显著(P>0.05);獭兔CDS序列同其他物种相比差异不大。
关键词:FGF5基因;多态性分析;毛皮性状;獭兔
獭兔,原名力克斯兔(Rex rabbit),原产于法国,是珍贵的裘皮用兔,因其皮毛酷似珍贵的毛皮兽—水獭,故称之为獭兔[1]。獭兔贵在毛皮,广泛用于服装业,制作成裘皮大衣、围巾等,具有良好的保暖作用,养殖前景十分广阔[2]。
成纤维细胞生长因子(FGF)广泛存在于各组织中,迄今为止已鉴定出23种FGFs,FGF5是FGF家族中的一员[3]。众多学者研究发现,兔毛生长发育过程与毛囊/毛乳头有着密切联系[4-9],FGF5是唯一通过影响毛囊生长期的长短从而影响被毛长度的调控因子[10],FGF5基因对兔的毛皮性状具有重要的调节作用,可以作为研究其毛皮性状的遗传标记[11-12]。
本研究通过PCR方法扩增出獭兔FGF5基因的第4个外显子后,采用直接测序方法检测并分析FGF5基因外显子4的多态性,分析獭兔群体毛皮性状的相关数据,并将獭兔的CDS序列同其他物种进行对比,以期为研究FGF5基因与獭兔毛皮性状的相关性提供理论依据。
1材料与方法
1.1试验动物试验在余姚市欣农兔业有限公司兔场进行,随机选择5月龄左右獭兔50只。屠宰测定毛皮性状前,颈静脉采血10 mL于抗凝管中备用;测定毛长及皮板长、皮板宽等主要毛皮性状。
1.2基因组DNA提取采用血液基因组DNA提取试剂盒提取獭兔血液基因组DNA,使用微量核酸仪检测所提取的DNA浓度,保证所提取的DNA浓度在80 ng/μL以上。
1.3引物设计使用Primer 5.0设计引物,扩增出兔FGF5基因外显子4的片段,片段长度为300 bp左右。引物由上海某生物技术有限公司合成。引物序列见表1。

表1 PCR扩增所用引物序列、产物长度
1.4PCR扩增PCR扩增总体积为50 μL,其中包括25 μL Premix TaqTM、21 μL ddH20、上下游引物各1 μL (10 pmol/gL)、2 μL模板DNA。PCR扩增程序:94℃预变性5 min;然后94℃ 45 s,复性温度54℃,72℃ 1 min,34个循环;72℃继续延伸10 min。PCR产物采用1%琼脂糖凝胶电泳检测,结束后采用UVP荧光成像系统分析检测扩增结果。
1.5产物纯化与测序未经纯化的PCR产物送上海某生物技术有限公司纯化并测序。测序结果使用Clustal x排定DNA序列,再经人工核对,并采用Bioedit,DNA man,DNA star等软件进行序列结构分析及序列峰图校正等。
1.6獭兔毛皮性状的统计分析供试獭兔按体重大小分为4组,利用Excel记录整理所得毛皮性状的相关数据(体重、毛纤维长、皮板长、皮板宽等)。采用SPSS 19.0统计分析软件进行单因子组内重复数等方差分析,对差异显著数据的组间采用LSD多重方法进行比较显著性分析。结果以平均值±标准误表示。
2结果与分析
2.1FGF5-4基因扩增以獭兔基因组DNA为模板,通过自行设计的引物,在PCR反应条件下,特异地扩增出FGF5第4个外显子基因,扩增产物经琼脂糖凝胶电泳(图1),扩增条带长度在300 bp左右。
2.2FGF5-4基因片段序列及峰图分析PCR产物直接测序得到300 bp左右的FGF5-4片段。测序结果使用Bioedit软件的Clustal x功能进行排定DNA序列,再经人工核对。测序所得序列,如图2所示;测序所得峰图,如图3所示。
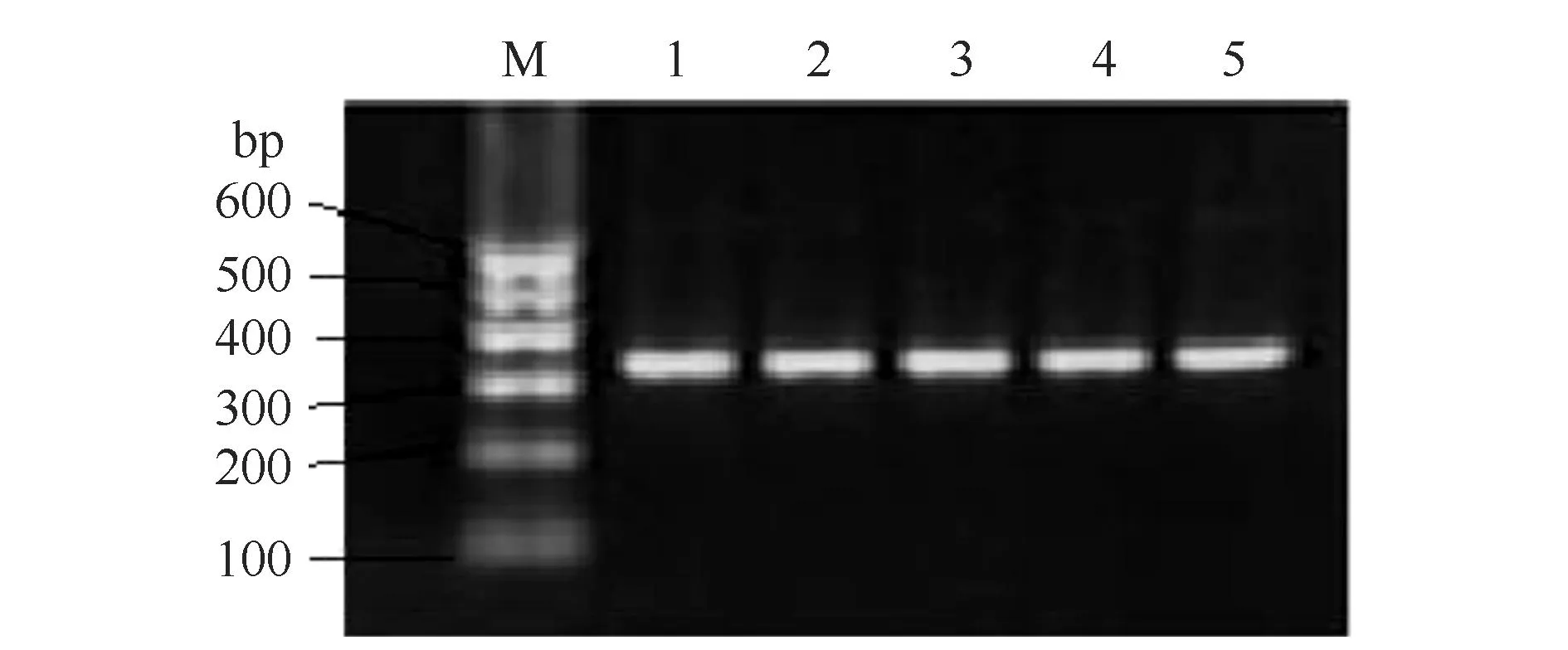
图1 PCR产物电泳图谱

图2 FGF5-4基因序列
由图2序列及图3峰图所示,在FGF5-4基因测序所得的有效序列当中,仅有一个单倍体型,且未见变异位点;FGF5-4基因片段的序列均无碱基插入和缺失。从以上序列及峰图可以看出,在FGF5-4基因片段上,所测獭兔群的分化程度很低。
2.3毛皮性状的相关分析详见表2。
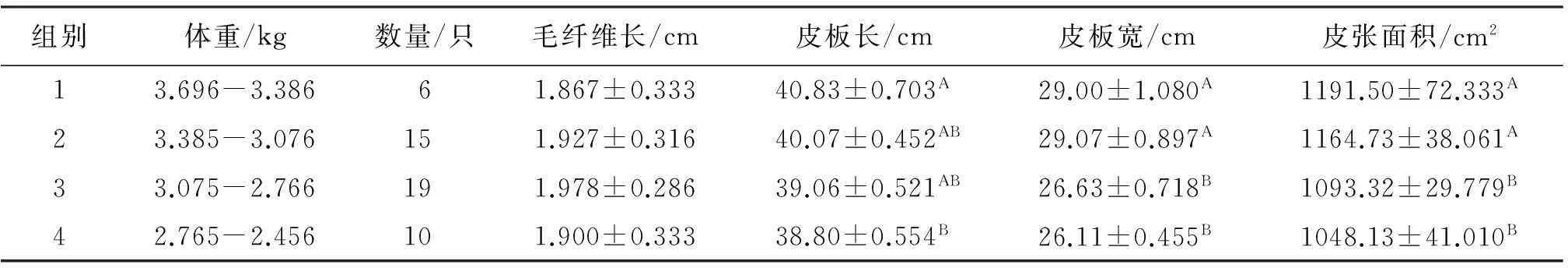
表2 獭兔毛皮性状方差分析表
注:同列数据不同大写字母肩标表示差异显著(P<0.05);肩标相同字母或无字母标注表示差异不显著(P>0.05)。
由表2可见,经方差分析和多重比较,不同组间獭兔的毛纤维长,差异不显著(P>0.05);皮板长度仅第1组(体重3.696~3.386 kg)显著高于(P<0.05)第4组(2.765~2.456 kg),与其他2组相比,则差异不显著(P>0.05);皮板宽和皮板面积则第1组(体重3.696~3.386 kg)和第2组(体重3.385~3.076 kg)明显高于第3组(体重3.075~2.766 kg)和第4组(体重2.765~2.456 kg),差异显著(P<0.05)。
2.4FGF5基因CDS序列与其他物种CDS序列比较详见图4。
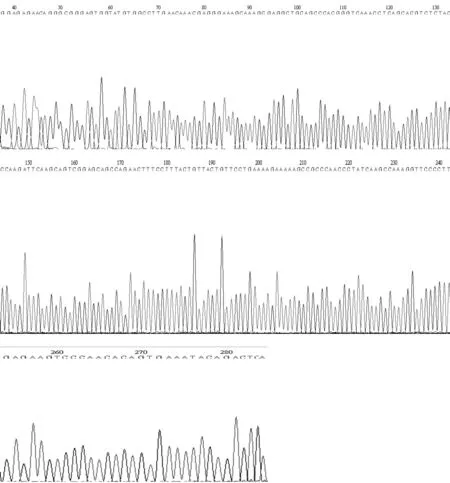
图3 FGF5-4基因测序峰图

图4 獭兔与其他物种FGF5氨基酸序列对比结果(前80位)
通过NCBI的GenBank中查找兔、狗、家猫、马、绵羊、牛、山羊、双峰驼、水牛、猪等物种CDS编码区序列所编码的氨基酸序列,分析对比不同物种的氨基酸序列发现,兔、狗、家猫、马、绵羊、牛、山羊、双峰驼、水牛、猪等物种CDS编码区序列所编码的氨基酸长度大都在270个左右,且不同物种氨基酸序列的差异主要集中在第10~80个氨基酸。在其他位点的对比中,不同物种间的氨基酸序列差异较小。经过相关软件分析,獭兔同其他物种间CDS编码区所编码的氨基酸相似程度超过88%。由此可见,FGF5基因在不同物种间的变异程度不大。
3小结与讨论
由图2基因序列及图3测序峰图可见,在FGF5-4基因测序所得的有效序列中,仅有一个单倍体型,且未见变异位点;FGF5-4基因片段的序列均无碱基插入和缺失。分析序列及峰图可以看出,在FGF5-4基因片段上,所测獭兔群的分化程度很低,说明FGF5-4基因在所测獭兔群中相对保守。
结合研究分析獭兔毛皮性状的相关数据,可以看出在选择的獭兔群中,按照体重不同分成的4组中,毛长组间差异不显著(P>0.05);皮板长仅第1组同第4组差异显著(P<0.05),皮板宽则第1组和第2组显著高于第3组和第4组(P<0.05)。综上所述,在所选獭兔群体中,其毛皮性状的差异性不显著,毛皮性状的分化程度不大,从而佐证了该群体FGF5-4基因片段的保守性。
根据獭兔FGF5基因CDS序列与其他物种CDS序列的比较,可以看出FGF5基因在物种间的差异性较小,表明在物种进化过程中FGF5基因相对保守。
据相关学者对FGF5基因的研究发现,有关獭兔FGF5基因保守性的报道较少。据李春笑等(2007)[13]研究表明,加利福尼亚兔的FGF5基因外显子1和外显子3存在SNP多态性,且发现突变位点与加利福尼亚兔的毛皮性状有极显著的相关性;冯凯等(2012)[14]和夏圣荣等(2010)[15]研究了5个家兔FGF5基因的遗传多态性,在FGF5-1A中发现了2个等位基因,3种基因型,在FGF5-3B中发现了2个等位基因,2种基因型。高爱琴等(2006)[16]对不同绵羊和山羊品种的FGF5基因外显子1和3的多态性进行了研究,发现绵羊和山羊 FGF5 基因外显子1均存在2处单碱基变异,而外显子3并没有发现多态。在本研究中,笔者所选的是FGF5的第4个外显子,且在所测獭兔群的序列中尚未发现突变位点,说明FGF5-4基因片段未见多态性。
参考文献
[1]姜允奎. 我国獭兔业现状及走势分析[J]. 农村养殖技术,2007,22:4-7.
[2]沈培军. 我国獭兔业的现状及开发对策[J]. 科学种养,2006,10:6-7.
[3]王丙萍. 靶除FGF5基因体细胞克隆绒山羊的研究[D].内蒙古农业大学,2014.
[4]高爱琴,李金泉,李宁,等. 成纤维细胞生长因子-5在安哥拉兔皮肤毛囊的作用研究进展 [J]. 畜牧与饲料科学,2005(3):30-31.
[5]Rosenquist T A,Martin G R. Fibroblast growth factor signalling in the hair growth cycle: expression of the fibroblast growth factor receptor and ligand genes in the murine hair follicle[J]. DevDyn,1996,205(4):379-386.
[6]Konyukhov B V,Martynova M Yu, Nesterova A P. Gene angora as a modifier of the hairless gene in mouse [J]. Russ J Genet,2007, 43(2):190-195.
[7]高爱琴,李宁,李金泉,等. 山羊FGF5基因cDNA分子克隆及序列分析[J].内蒙古大学学报,2006,37(2 ):180-184.
[8]高爱琴,李金泉,李宁,等. 绵羊FGF5基因 SNP 的生物信息学分析[J].中国畜牧杂志, 2008,44(5):5-7.
[9]Paus R, Cotsarelis G. The biology of hair follicles[J]. N Engl J Med,1999,341(7):491-497.
[10]高爱琴,李 宁,李金泉,等.不同发育阶段绒山羊皮肤中FGF5基因mRNA表达的 RT-PCR 检测[J].华北农学报,2008, 23(1): 36-37.
[11]宦霞娟. 獭兔KAP和FGF5基因多态性与其经济性状的关系研究[D].西北农林科技大学,2009.
[12]Petho-Schramm A,Muller H J,Paus R.FGF5 and the murine haircycle [J].Arch Dermatol Res,1996,288(5-6): 264-266.
[13]李春笑. 家兔FGF5基因外显子Ⅰ和Ⅲ多态性研究及其与生产性能相关分析[D].四川农业大学,2007.
[14]冯凯,吴添文,张蕾,何孟颉,高波,吴信生. 5个家兔群体FGF5基因的遗传多样性分析[J]. 中国草食动物科学,2012,03:5-8.
[15]夏圣荣,冯凯,吴添文,朱程程,吴信生. 5个家兔群体FGF5基因部分外显子1的遗传多样性分析[J]. 草食家畜,2010,04:22-25.
[16]高爱琴,李 宁,赵兴波,等. 山羊FGF5基因单核苷酸多态性群体遗传学分析[J]. 华北农学报,2006,21(3): 71-76.
中图分类号:S829.12
文献标识码:A
文章编号:1005-7307(2016)02-0004-004
作者简介:刘健(1990-),男,山东省潍坊市人,硕士研究生,主要研究方向为动物遗传育种与繁殖。E-mail:liujian1990@zju.edu.cn.*通讯作者:张金枝(1966-),E-mail: zhangjzs@zju.edu.cn
基金项目:宁波市科技局农村科技创新创业资助项目(201201C8000037).
收稿日期:2016-01-26

