左旋多巴对帕金森病大鼠海马区酪氨酸羟化酶及α-突触核蛋白表达的影响
许文年
(济南军区第四五六医院药械科,山东 济南 250031)
左旋多巴对帕金森病大鼠海马区酪氨酸羟化酶及α-突触核蛋白表达的影响
许文年
(济南军区第四五六医院药械科,山东济南250031)
〔摘要〕目的探讨左旋多巴(L-dopa)对帕金森病(PD)大鼠海马区酪氨酸羟化酶(TH)及α-突触核蛋白(α-Syn)表达的影响。方法选取96只健康雄性Wistar大鼠,按随机数字表法分为对照组、PD模型组和L-dopa干预组各32只;各组再随机分为4 d和8 d两个亚组,各16只。对PD模型组和L-dopa干预组大鼠皮下注射鱼藤酮乳液(2 mg/kg)建立大鼠PD模型,对照组皮下注射等剂量的葵花油。造模成功后对L-dopa干预组大鼠灌胃给予L-dopa干预治疗,对照组及PD模型组大鼠灌胃给予生理盐水,各组中两个亚组均分别持续4 d和8 d。采用Y型电迷宫试验检测各组大鼠的学习与记忆能力,海马区TH和α-Syn的阳性细胞计数及表达水平的检测分别采用免疫组化法及Western蛋白印迹法。结果PD模型组大鼠的学习与记忆能力显著低于对照组,而L-dopa干预组较PD模型组明显提升(P<0.05);PD模型组及L-dopa干预组大鼠的TH阳性细胞数及表达水平均显著低于对照组,L-dopa干预组高于PD模型组,且L-dopa干预组的8 d亚组高于4 d亚组(P<0.05);PD模型组及L-dopa干预组的α-Syn表达水平均显著高于对照组,L-dopa干预组低于PD模型组,且L-dopa干预组的8 d亚组低于4 d亚组(P<0.05)。结论鱼藤酮可诱导大鼠发生PD,使其学习与记忆能力显著下降,L-dopa可通过增强海马区的TH表达水平,抑制α-Syn的表达,从而治疗PD。
〔关键词〕帕金森病;左旋多巴;酪氨酸羟化酶;α-突触核蛋白;海马
帕金森病(PD)的发病机制与黑质纹状体多巴胺(DA)缺乏有关,其典型病理改变为黑质多巴胺能神经元胞质内路易小体(LB)的形成。酪氨酸羟化酶(TH)是由酪氨酸合成DA过程中的关键限速酶,与PD密切相关〔1〕。α-突触核蛋白(α-Syn)是LB的主要结构成分,可抑制DA的释放,研究显示α-Syn与PD相关,可作为诊断PD的一种生物学标志物〔2〕。PD的临床治疗以药物治疗为主,左旋多巴(L-dopa)是目前治疗PD的最重要的药物之一,其本身无活性,须经氨基酸脱羧酶的作用转化为DA而发挥药理学作用。研究显示〔3〕,L-dopa可影响大鼠结肠TH及α-Syn的表达,研究旨在探讨L-dopa对海马区TH及α-Syn表达的影响。
1材料与方法
1.1实验动物选取96只健康雄性Wistar大鼠(由山东大学实验动物中心提供),月龄3~4个月,体重250~350 g,未出现特定病原菌级(SPF级)。于山东大学屏障环境动物实验室自由进食喂养,室温(23.0±2.0)℃,湿度50%~75%,自然光照,适应性喂养2 w。
1.2实验仪器、试剂
1.2.1仪器台式高速离心机(上海安亭科学仪器厂),Y型电迷宫(自制),奥林巴斯BX63全自动显微镜扫描系统(日本奥林巴斯公司),电泳仪(北京华阳分析仪器厂),凝胶成像分析系统(广州易测仪器有限公司)
1.2.2试剂L-dopa(美国Sigma公司),鱼藤酮(陕西昂盛生物医药科技有限公司),葵花油,兔抗TH单克隆抗体及兔抗α-Syn多克隆抗体(美国CST公司),二氨基联苯胺(DAB)显色液(中国中杉金桥生物技术有限公司),十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)低分子量标准蛋白(华美生物公司),即用型免疫组化SP试剂盒(南京森贝伽生物科技有限公司),快速Western blotting试剂盒(上海易利生物科技有限公司)
1.3方法
1.3.1动物分组将96只大鼠按照随机分组方法分为对照组、PD模型组、L-dopa干预组各32只;每组再随机分为模型制备成功后4 d、8 d两个亚组各16只。其中8只用于免疫组化法检测,8只用于Western印迹法检测。
1.3.2PD动物模型制备采用颈背部皮下注射鱼藤酮方法对PD模型组和L-dopa干预组大鼠制备PD模型:(1)鱼藤酮乳液配制:以葵花油溶解鱼藤酮配制浓度为2 mg/ml的乳液,充分震荡混匀后避光保存。(2)皮下注射:以2 mg/kg剂量计算各只大鼠的鱼藤酮乳液用量,碘伏消毒后,捏起大鼠颈背部皮肤,用1 ml注射器皮下注入。(3)造模成功大鼠筛选:观察大鼠的行为学变化,参照相关文献〔3〕,以行为学评分2~6分为大鼠造模成功标准。同时对照组大鼠颈背部皮下注射同剂量的葵花油。
1.3.3处理方法对L-dopa干预组大鼠给予15 mg/kg L-dopa灌胃,2次/d;对照组及PD模型组大鼠均给予2 ml的生理盐水灌胃,2次/d,各组的两个亚组大鼠均分别持续4 d和8 d。
1.4观察指标
1.4.1大鼠学习、记忆能力检测将各组大鼠进行Y型电迷宫测试〔4〕,电压为40 V,采用不固定次数随机法(即安全区以无规则的次序变换)。学习能力:将大鼠静置于起步区3 min后电击,大鼠逃至安全区,灯光持续15 s后熄灭休息,45 s后重新开始下一次操作,以连续10次试验中9次正确为达到学会标准。记忆能力:24 h后以相同方法测试大鼠记忆保存情况。
1.4.2TH和α-Syn阳性细胞计数采用免疫组化法对TH和α-Syn阳性细胞进行计数:(1)海马组织提取:腹腔缓慢推注10%水合氯醛溶液3 ml/kg麻醉大鼠,断头处死。迅速打开大鼠颅腔,取出完整全脑,取海马组织,清洗干净后迅速放入液氮中,然后放入EP管中-80℃保存。(2)脑干标本制作:取2~3 g脑干组织经4%多聚甲醛固定24 h,常规包埋、切片、脱蜡、水化、抗原修复;0.3%过氧化氢封闭内源性氧化酶20 min;1%山羊血清封闭20 min,分别加入Ⅰ抗(兔抗α-Syn多克隆抗体,兔抗TH单克隆抗体),4℃孵育过夜;再分别加入生物素Ⅱ抗及辣根酶标记链霉卵白素,均于37℃孵育30 min;以上操作均用磷酸盐缓冲液(PBS)浸洗3次,5 min/次,后DAB显色。(3)阳性细胞计数。从各亚组大鼠脑干标本中随机选取不重叠的6视野进行TH及α-Syn阳性细胞计数,光镜下阳性细胞胞浆呈棕黄色,胞核呈浅蓝色或紫蓝色,高倍镜下观察阳性细胞形态变化,进行细胞计数。
1.4.3TH和α-Syn水平测定采用Western蛋白印迹法:(1)蛋白样品处理。取海马组织按40 mg/kg加入蛋白裂解液,电动匀浆器匀浆,冰浴中静置30 min,12 000 r/min,4℃离心10 min,取上清液-20℃保存。经蛋白定量后分装,用4℃预冷的PBS液调蛋白浓度及SDS-PAGE蛋白上样缓冲液至上样量一致,沸水浴加热3~5 min,使蛋白质充分变性;(2)上样、电泳。将样品冷却至室温后直接上样至SDS-PAGE胶加样孔内,放置电泳装置内,电压设置100 V,电泳时间100 min。聚偏氟丙烯(PVDF)转模、封闭,后参照说明书进行Ⅰ抗、Ⅱ抗孵育;(3)表达量分析。洗模,以增强化学发光法(ECL)显色,在Image J图像分析软件下观察目的蛋白条件及内参的光密度值,两者的比值反映目的蛋白的相对水平。
1.5统计学方法采用SPSS14.0软件进行方差分析、SNK-q检验和χ2检验。
2结果
2.1各组大鼠学习、记忆能力检测三组大鼠的学习、记忆能力差异有统计学意义(P<0.05),PD模型组大鼠学习与记忆能力显著低于对照组,而L-dopa干预组较PD模型组明显提升(P<0.05)。见表1。
2.2各组大鼠TH和α-Syn阳性细胞数比较PD模型组及L-dopa干预组大鼠的TH阳性细胞数均显著低于对照组,而L-dopa干预组分别高于PD模型组,且L-dopa干预组中的8 d亚组TH细胞数高于4 d亚组(P<0.05);此外,PD模型组及L-dopa干预组的α-Syn阳性细胞数均高于对照组,而L-dopa干预组分别低于PD模型组,且L-dopa干预组的8 d亚组低于4 d亚组(P<0.05)。见表2。
2.3各组大鼠脑干TH和α-Syn表达水平比较PD模型组及L-dopa干预组大鼠的TH表达水平均显著低于对照组,而L-dopa干预组分别高于PD模型组,且L-dopa干预组中的8 d亚组TH表达水平高于4 d亚组(P<0.05);此外,PD模型组及L-dopa干预组的α-Syn表达水平均高于对照组,而L-dopa干预组分别低于PD模型组,且L-dopa干预组的8 d亚组低于4 d亚组(P<0.05)。见表3。
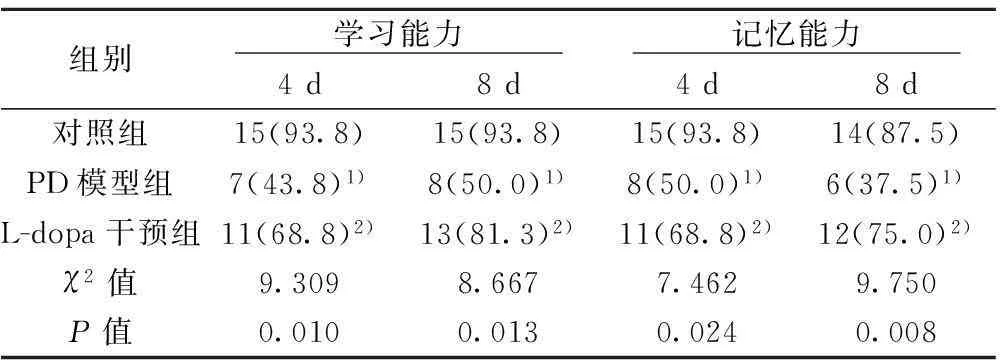
表1 各组大鼠学习、记忆能力测试结果〔n=32,n(%)〕
与对照组比较:1)P<0.05;与PD模型组比较:2)P<0.05

表2 各组大鼠TH和α-Syn阳性细胞数
与对照组比较:1)P<0.05;与PD模型组比较:2)P<0.05;与8 d亚组比较:3)P<0.05,下表同
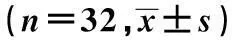
表3 各组大鼠脑干TH和α-Syn表达水平比较
3讨论
PD是一种常见的锥体外系疾病,主要表现为运动功能异常,同时可伴随学习、记忆能力降低等症状。研究发现,约有4%~93%的PD患者在发病中晚期会呈现PD性痴呆,临床表现为记忆力、视觉空间、认知能力等受损〔5〕,其机制可能与大脑皮质、海马区神经元变性有关。本研究结果与以往研究结果一致〔4〕,说明PD模型组大鼠经鱼藤酮染毒后海马区可能发生神经元退变,而导致海马区功能受损。
目前PD的发病原因尚不明确,大部分学者认为与氧化应激、线粒体功能障碍和免疫异常等有关。其主要病理改变为中脑黑质多巴胺能神经元的退行性病变,导致DA的缺乏。目前临床上PD主要以L-dopa替代治疗为主,也有越来越多的研究提出不同的治疗方法〔6〕,如营养因子治疗、干细胞移植治疗等,但应用于临床仍面临高费用、长期疗效不确定等问题〔7〕。L-dopa本身没有活性,其由血脑屏障进入脑内经过酶的催化作用合成DA而发挥效应,TH是DA合成过程中的重要催化酶,α-Syn也是PD发生发展过程中的重要构成成分。
本研究结果提示鱼藤酮诱发大鼠产生PD疾病症状,且其可能通过抑制TH酶水平及激发α-Syn成分的产生而促进PD疾病的发生发展。鱼藤酮是一种细胞毒性化合物,其主要生化效应是抑制细胞呼吸链对氧的利用,造成内呼吸抑制性缺氧。体外研究发现,鱼藤酮对DA细胞的毒性作用多样,既可增强DA细胞对其他有害因素的敏感性,又可直接诱发DA细胞凋亡,还可通过促进DA神经元的释放经自身氧化作用而损伤DA神经元〔8〕。此外,L-dopa可以通过激发TH酶水平,抑制α-Syn的产生而发挥治疗PD的作用,显著改善PD大鼠的学习、记忆能力,且治疗时间与疗效呈正比。这与以往的研究结果相似〔3〕。可能是L-dopa可通过增强TH酶水平表达,及抑制α-Syn释放的作用,从而促进酪氨酸合成为DA及抑制体内LB的生成,达到延缓PD发展的目的。但对于L-dopa的临床副作用还有待进一步研究。
4参考文献
1何珊.帕金森病模型大鼠脑内TH表达变化的实验研究〔D〕.扬州:扬州大学硕士论文,2014.
2李鑫,冯涛,郜丽妍,等.α-突触核蛋白聚集作为帕金森病生物学标记物的研究进展〔J〕.中华老年心脑血管病杂志,2014;16(9):1004-6.
3毕树立,刘斌,高海英.左旋多巴对帕金森病模型大鼠结肠酪氨酸羟化酶和α-突触核蛋白表达的影响〔J〕.疑难病杂志,2014;29(10):1047-50.
4邢红霞,袁燕,刘胜,等.帕金森病大鼠模型学习记忆能力与左旋多巴的关系〔J〕.中国组织工程研究,2014;18(7):1069-75.
5王乐,毕胜,范晓雪,等.维生素D及其受体在帕金森病中的作用〔J〕.现代生物医学进展,2015;15(3):594-7,518.
6李雨濛,于会艳,秦斌.帕金森病的治疗现状及未来〔J〕.中国神经免疫学和神经病学杂志,2015;23(3):215-9.
7林剑霞,潘瑶,李妍.帕金森病的研究进展〔J〕.吉林医药学院学报,2015;36(2):144-7.
8毕树立,高海英.司来吉兰联合补中益气汤对帕金森病模型大鼠结肠TH,α-Syn表达的影响〔J〕.河南中医,2015;35(3):512-4.
〔2015-10-25修回〕
(编辑袁左鸣/滕欣航)
〔中图分类号〕R749
〔文献标识码〕A
〔文章编号〕1005-9202(2016)07-1556-03;
doi:10.3969/j.issn.1005-9202.2016.07.009
第一作者:许文年(1971-),男,副主任药师,主要从事临床药学方面的研究。

