睾酮通过减少氧化应激干预血管内皮细胞衰老
彭慧茹 吴赛珠 曹 枫
(深圳市龙岗中心医院综合ICU,广东 深圳 518116)
睾酮通过减少氧化应激干预血管内皮细胞衰老
彭慧茹吴赛珠1曹枫
(深圳市龙岗中心医院综合ICU,广东深圳518116)
〔摘要〕目的观察睾酮对过氧化氢(H2O2)诱导衰老的人脐静脉内皮细胞(HUVECs)的影响。方法用SA-βgal细胞化学检测法观察不同浓度睾酮及雄激素受体拮抗剂、雌激素受体拮抗剂对H2O2诱导的HUVECs衰老的干预作用,用2,7二氯氢化荧光素二酯(H2DCF-DA)染色检测细胞内活性氧簇(ROS)水平,用免疫印迹分析(Western印迹)法检测细胞中去磷酸化Rb蛋白水平。 结果睾酮在3.0×10(-9)、3.0×10(-8)、3.0×10(-7) mol/L等3种浓度下均具有延缓H2O2诱导的HUVECs的SA-βgal阳性率明显增加的趋势;与3.0×10(-8) mol/L睾酮干预组相比,予10(-6) mol/L ICI182,780预处理,HUVECs的SA-βgal阳性率明显增加,ROS水平增加,去磷酸化Rb蛋白水平明显增加。结论睾酮对H2O2诱导的HUVECs衰老的影响与其剂量有关;生理浓度睾酮具有延缓H2O2诱导的HUVECs衰老的趋势,其作用可能是通过转化为雌激素,作用于雌激素受体,减少氧化应激和调节去磷酸化Rb蛋白产生。
〔关键词〕睾酮;内皮细胞;氧化应激;受体;衰老
随着年龄的增长,男性体内睾酮水平会发生明显改变,以动脉粥样硬化(AS)为表现的心脑血管疾病的发病率也明显增加〔1〕。而且,AS产生的一个最有年龄性特点的原因是血管发生了明显的结构和功能的改变,血管细胞(包括血管内皮细胞)出现衰老。这与血管的病理生理及衰老相关疾病如AS等有着密切的联系,同时也可能是该类疾病随着年龄的增长而发病率增加的原因之一〔2〕。但睾酮对血管内皮细胞衰老的影响、其可能的作用机制如何,目前还没有文献报道。由于氧化应激是各种危险因素导致AS形成与发展的最关键环节之一,故本实验主要从氧化应激角度出发,探讨睾酮对H2O2诱导的血管内皮衰老的干预作用及其可能的作用机制。
1材料和方法
1.1药物配制称取睾酮(Sigma公司)配制成3×10-2mol/L 浓度,用培养基将睾酮依次稀释为3×10-6mol/L、3×10-7mol/L 和3×10-8mol/L、3×10-9mol/L。Flutamide、ICI182,780(Sigma公司)配制成10-2mol/L,均稀释为10-6mol/L。
1.2细胞培养二代人脐静脉内皮细胞(HUVECs,男性胎儿) 及其低血清培养基(美国Cascade Biologics 公司)。细胞复苏后予10%胎牛血清的培养基,于37℃、5 %CO2培养箱中静置培养,所用细胞为4~6代。
1.3SA-β-半乳糖苷酶(SA-β-gal)染色先用MTT法观察H2O2对内皮细胞增殖率的影响,并选择H2O2刺激浓度(预实验得到的最佳刺激浓度和时间,H2O260 μmol/L,72 h)。当培养的细胞融合达80%时,换用无血清培养基静止24 h,再按以下分组进行实验:①正常对照组:给予低血清(2%)培养基;②H2O2刺激组:给予低血清培养基+ H2O2;③睾酮作用组:分别给予睾酮3.0×10-9mol/L、3.0×10-8mol/L、3.0×10-7mol/L和3.0×10-6mol/L培养30 min后,再加予H2O2;④机制研究组:分别给予ICI182,780、Flutamide 10-6mol/L 培养30 min后,给予睾酮(终浓度达3.0×10-8mol/L),30 min后再给予H2O2。72 h后,漂洗、固定,予X-半乳糖苷酶(X-gal)染液孵育(按照试剂盒说明书操作,碧云天公司)。在显微镜下观察并计数蓝染的细胞(阳性细胞),每次随机挑选200个细胞,计数得到阳性细胞百分率。以上实验步骤重复4次。
1.4ROS检测按以下分组进行实验:①正常对照组;②H2O2刺激组;③生理浓度睾酮作用组:给予睾酮3.0×10-8mol/L,培养30 min后,再加予H2O2;④机制研究组:分别给予ICI182,780、Flutamide、NAC 10-6mol/L 培养30 min后,ICI182,780、Flutamide组给予睾酮(终浓度达3.0×10-8mol/L),30 min后再给予H2O2。72 h后漂洗,加入10 μmol/L的H2DCF-DA培养液1 ml,37℃避光孵育30 min,PBS漂洗后,在荧光显微镜下观察测定绿色荧光强度平均光密度(激发波长为488 nm,吸收波长为525 nm,曝光时间为1 s,亮度、对比度固定),每样品取5个视野,绿色荧光强度平均光密度使用Image-Pro Plus6.0软件进行定量分析。以上实验重复2次。
1.5去磷酸化Rb蛋白检测培养细胞达80 %融合时按上述方法静止给予不同刺激。孵育72 h 后,行细胞裂解处理。然后各取25 μg 蛋白进行变性的8% SDS-polyacrylamide 凝胶电泳(Bio-Rad Mini protein Ⅲ System),随后电转移至PVDF膜(美国Bio Rad公司产品),含5%脱脂奶粉的TBST溶液封闭2 h,继而与一抗(1∶200)室温下孵育2 h(兔抗人去磷酸化Rb蛋白多克隆抗体为武汉博士德公司产品),再与耦联辣根过氧化物酶的羊抗兔IgG二抗(1∶2 000,武汉博士德公司产品) 室温下孵育2 h ,最后用增强化学发光法(检测试剂为美国Santa Cruz 公司产品) 显色。图像分析仪(美国UVIsoft软件)定量测定杂交信号的吸光度,用面积×密度代表表达量,以Rb与β-actin吸光度百分比代表细胞中Rb的表达量,实验数据以空白对照为1进行标化分析,其他各组值与空白对照组表达量比较,得出相对吸光度(A),以上实验重复2次。
1.6统计分析采用SPSS15.0软件,组间比较采用单向方差分析,用小显著差异法(LSD)进行多重比较。
2结果
2.1SA-βgal细胞化学检测与空白组〔(2.90±0.43)%,95%CI:1.71%~4.09%〕相比,H2O2刺激组阳性细胞率〔(57.10±1.03)%,95%CI:54.24%~60.00%〕增加(P<0.01)。3、30、300 nmol/L、3 μmol/L干预组SA-βgal细胞阳性率分别为(54.40±1.20)%,95%CI:51.07%~57.73%;(50.80±3.36)%,95%CI:41.47%~60.17%;(51.20±2.60)%,95%CI:60.81%~79.59%。生理浓度睾酮与稍高于或低于生理浓度睾酮都具有延缓H2O2诱导的HUVECs阳性细胞率增加的趋势,其中生理浓度睾酮组效果最明显,但与H2O2刺激组相比,统计学差异均不显著,P分别为0.094、0.115、0.464。与生理浓度睾酮组相比,先给予雌激素受体拮抗剂ICI182,780预处理,细胞阳性细胞率明显增加〔(67.00±2.82)%,95%CI:59.18%~74.81%〕;而予Flutaide预处理,细胞阳性率降低〔(42.90±3.62)%,95%CI:32.85%~52.95%〕(P<0.01)。
2.2睾酮、性激素受体拮抗剂及抗氧化剂对H2O2诱导的HUVECs内ROS的影响HUVECs在不同处理组培养72 h后,经过H2DCF-DA染色:与空白对照组(1.03±0.07,95%CI:0.72~1.33)相比,H2O2刺激组平均积分光密度(2.55±0.06,95%CI:2.29~2.82)明显增加(P<0.001);与H2O2刺激组相比,NAC能明显抑制H2O2诱导的细胞内ROS的增加,平均积分光密度明显减少(1.83±0.08,95%CI:1.51~2.16)(P<0.01);与3.0×10-8mol/L睾酮干预组(2.45±0.10,95%CI:2.01~2.88)相比,予雌激素受体拮抗剂ICI182,780预处理,会促进H2O2诱导的细胞内ROS的增加,平均积分光密度明显增加(2.89±0.10,95%CI:2.48~3.31)(P<0.01);而先予Flutamide预处理,能减少H2O2诱导的细胞内ROS的增加,平均积分光密度减小(2.04±0.06,95%CI:1.78~2.31)(P<0.01)。
2.3各种浓度睾酮对H2O2诱导的HUVECs的去磷酸化Rb蛋白表达的影响与空白对照组(1.15±0.08,95%CI:0.82~1.48)相比,H2O2诱导组的HUVECs中去磷酸化Rb蛋白的表达量(2.60±0.06,95%CI:2.35~2.86)明显增加(P<0.01);与H2O2刺激组相比,NAC组细胞的去磷酸化Rb蛋白表达量(1.27±0.05,95%CI1.04~1.51)显著减少(P<0.01);30 nmol/L睾酮干预组Rb蛋白的表达量(2.46±0.05,95%CI:2.23~2.68)稍减少,但差异无统计学差异(P=0.132)。与30 nmol/L睾酮干预组相比,予ICI182,780预处理,细胞的去磷酸化Rb蛋白表达量(10.01±0.09,95%CI:9.62~10.40)明显增多(P<0.01);而予Flutamide预处理,细胞的去磷酸化Rb蛋白表达量(1.58±0.04,95%CI:1.40~1.75)表达量减少(P<0.01)。见图1。
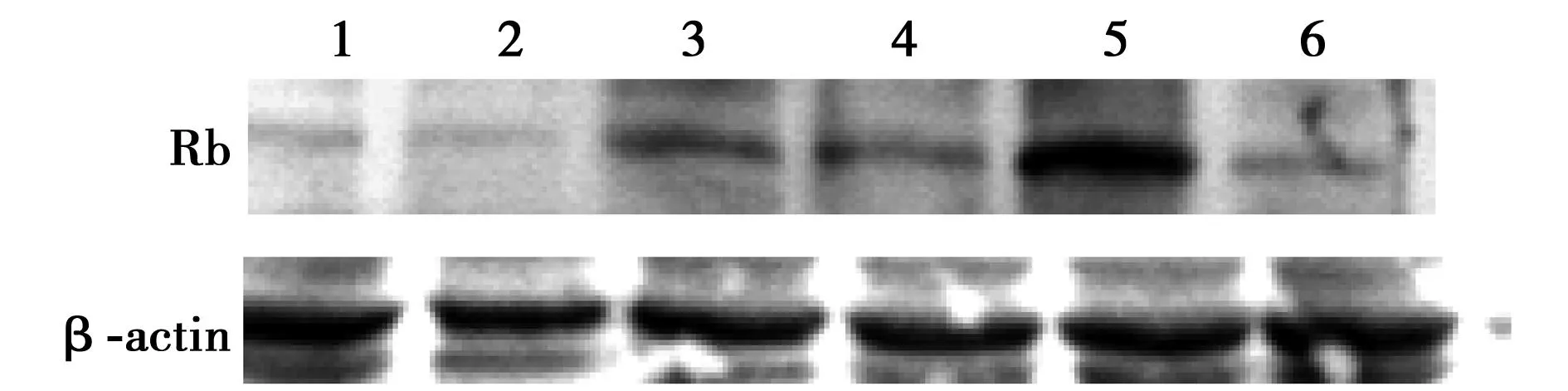
1:NAC干预组;2:空白对照组;3:H2O2刺激组;4:睾酮30 nmol/L干预组;5:睾酮30 nmol/L+ICI组;6:睾酮30 nmol/L+Flu组图1 Western印迹检测各组细胞中Rb和β-actin表达
3讨论
生物在正常的生长发育过程中,ROS的产生和清除会保持平衡,ROS的产生通过抗氧化系统的作用保持平衡。在病理状态下,氧化剂超过抗氧化系统的清除能力,平衡被破坏,导致ROS过度产生称为氧化应激,造成脂质、蛋白质、膜和DNA的损伤。除了氧化应激造成损伤外,ROS更重要的性能是作为信息分子,通过蛋白质氧化修饰角度对细胞功能,如细胞生长、转化、凋亡、转录和衰老进行调节〔3〕。同时,目前关于细胞衰老的信号传导通路研究中,研究较多且较确定的是p53-p21-Rb通路和p16-Rb通路〔4〕。去磷酸化Rb蛋白在这两条重要通路中都处于中枢地位。在衰老细胞中,Rb蛋白以其未磷酸化的活性状态存在,抑制细胞生长〔5〕。
本研究通过小剂量H2O2长时间刺激,成功诱导出衰老的HUVECs模型。本实验结果显示,与空白对照组相比,H2O2刺激组HUVECs 内ROS水平、去磷酸化Rb蛋白的表达量明显增加。与H2O2刺激组相比,给予抗氧化剂NAC能明显减少细胞内ROS水平与去磷酸化Rb蛋白的表达。这证明了ROS在人血管内皮细胞衰老过程中起着重要作用,这与我们前期研究已证明的ROS可以通过影响鼠的血管NO信号途径影响血管增龄改变的结果是一致的〔6〕。与H2O2刺激组相比,生理浓度和稍高于或低于生理浓度的睾酮都具有延缓H2O2引起的HUVECs的SA-βgal染色阳性率增加的趋势,其中生理浓度睾酮效果最明显,而且生理浓度睾酮还具有减少细胞内ROS和去磷酸化Rb蛋白的表达的趋势。但较高浓度的睾酮却可以促进H2O2诱导的HUVECs的SA-βgal染色阳性率的增加。此外,与3.0×10-8mol/L睾酮干预组相比,先予雌激素受体拮抗剂ICI182,780预处理,会增加SA-βgal染色阳性细胞比例、细胞内ROS量和去磷酸化Rb蛋白的表达;而先予雄激素受体拮抗剂Flutamide预处理,则具有相反的作用。以往实验已证明,睾酮不仅可以通过血管壁的雄激素受体产生作用,还可以在脉管系统的芳香酶作用下转化为雌激素,通过血管壁的雌激素受体发挥生物学效能。由此推断,生理浓度的睾酮或许能通过芳香化转化为雌二醇后,作用于雌激素受体,减少细胞内的氧化应激,减少细胞内去磷酸化Rb蛋白表达,从而影响细胞周期,干预细胞衰老。
4参考文献
1Liu PY,Death AK,Handelsman DJ.Androgens and cardiovascular disease〔J〕.Endocr Rev,2003;24(1):313-40.
2Minamino T,Komuro I.Vascular cell senescence contribution to atherosclerosis〔J〕.Circ Res,2007;100(1):15-26.
3Kregel KC,Zhang HJ.An integrated view of oxidative stress in aging:basic mechanisms,functional effects,and pathological considerations〔J〕.Am J Physiol Regulatory Integrative Comp Physiol,2007;292:R18-R36.
4Bringold F,Serrano M.Tumor suppressors and oncogenes in cellular senescence〔J〕.Exp Gerontol,2000;35(3):317-29.
5James DG.The Rb network〔J〕.J Cell Sci,2004;117(4):3411-3.
6Wu S,Ruan Y,Yin M,etal.Research on the age-related changes in the nitric oxide pathway in the arteries of rats and the intervention effect of dehydroepiandrosterone〔J〕.Gerontology,2007;53(2):234-7.
〔2015-11-10修回〕
(编辑郭菁)
Effects of testosterone on vascular endothelial cells senescence by reducing oxidative stress
PENG Hui-Ru,WU Sai-Zhu,CAO Feng.
ICU of Shenzhen Longgang Central Hospital,Shenzhen 518116,Guangdong,China
【Abstract】ObjectiveTo investigate the effects of testosterone on the senescence of human umbilical vein endothelial cells(HUVECs) induced by hydrogen peroxide(H2O2) and initially investigate the mechanism of act of testosterone at physiological concentration on it.MethodsEffects of testosterone at different concentrations with or without its antagonist Flutamide or estrogen receptors antagonist ICI182,780 on the senescence of HUVECs induced by H2O2 were studied by means of SA-β galactosidase staining,the level of reactive oxygen species(ROS) were also detected by 2,7-dichlorodihydrofluorescein diacetate staining and the expression of hypophosphorylation of pRb by Western blot.ResultsH2O2(60 μmol/L,72 h)increased positive rate of SA-β galactosidase staining of HUVECs,as well as increased ROS level and hypophosphorylation of pRb expression.Testosterone at low concentrations(3×10(-9) mol/L,3×10(-8)mol/L and 3×10(-7)mol/L) delaying increased positive rate of SA-β galactosidase staining of HUVECs induced by H2O2,most obviously at concentration of 3×10(-8)mol/L(but P>0.05 versus H2O2 stimulated group),whereas higher concentration(3×10(-6)mol/L) had opposite effect(70.20±3.40 for SA-βgalactosidase staining method,P<0.001 versus H2O2 stimulated group).The estrogen receptors antagonist ICI182,170 rather than androgen antagonist Flutamide at concentration of 10(-6)mol/L inhibited the delaying trend induced by testosterone at concentration of 3×10(-8)mol/L,as well as increased ROS level and hypophosphorylation of Rb expression in HUVECs(67.00±2.82 for SA-βgalactosidase staining method,2.89±0.10 for H2DCF-DA staining method,10.24±0.20 for Western blot,P<0.01 versus testosterone at concentration of 3×10(-8)mol/L group) .ConclusionsTestosterone modulates the senescence of HUVECs induced by H2O2 in a dose-related manner.And at physiological concentrations,testosterone has the trend of delaying it,mainly by transforming to estrogen acting on estrogen receptors decreasing oxidative stress and modulating hypophosphorylation of Rb expression consequently.
【Key words】Testosterone;Endothelial cell;Oxidative stress;Receptor;Senescence
〔中图分类号〕R329.2
〔文献标识码〕A
〔文章编号〕1005-9202(2016)07-1552-03;
doi:10.3969/j.issn.1005-9202.2016.07.007
通讯作者:吴赛珠(1962-),女,博士,教授,博士生导师,主要从事性激素平衡与多种老年疾病关系的基础与临床系列研究。
基金项目:国家“973”项目子课题(No:2007CB507404)
1南方医科大学附属南方医院
第一作者:彭慧茹(1982-),女,主治医师,主要从事动脉粥样硬化与衰老的关系及其机制研究。

