急性呼吸窘迫综合征患者血清可溶性尿激酶型纤溶酶原激活物受体升高的意义
申丽华 张忠伟 朱 彪
(复旦大学上海医学院肿瘤学系-复旦大学附属肿瘤医院麻醉科重症监护室 上海 200032)
急性呼吸窘迫综合征患者血清可溶性尿激酶型纤溶酶原激活物受体升高的意义
申丽华▲张忠伟▲朱彪△
(复旦大学上海医学院肿瘤学系-复旦大学附属肿瘤医院麻醉科重症监护室上海200032)
【摘要】目的通过测定急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS)患者及对照组的血清可溶性尿激酶型纤溶酶原激活物受体 (soluble urokinase-plasminogen activator receptor,su-PAR)水平,评估其诊断及判断预后的价值。方法收集79例ARDS患者和30例心源性肺水肿 (cardiagenic pulmonary edema,CPE)患者,用酶联免疫吸附测定法 (enzyme-linked immunosorbent assay,ELISA)测定su-PAR血清浓度。结果 ARDS患者血清su-PAR浓度显著高于CPE组[10.42 (9.11~13.84) ng/mL vs.4.87 (3.35~9.61) ng/mL,P<0.001],在ARDS患者中存活组患者血清su-PAR浓度显著低于非存活组[10.06 (8.48~11.96) ng/mL vs. 13.35 (10.08~16.65) ng/mL,P<0.001]。Logistic多元回归分析显示su-PAR(OR=1.52,P=0.034)是ARDS病例组30天死亡率的独立预测因子。在ARDS组中取su-PAR最佳临界点11.71 ng/mL,低于该值的患者30天死亡率明显低于大于该值者 (P=0.005)。结论ARDS患者血清的su-PAR水平显著高于CPE患者,su-PAR作为一个生物标志物对ARDS和CPE患者的鉴别有一定的诊断价值。Su-PAR是ARDS患者短期死亡率的较强预测因子。
【关键词】可溶性尿激酶型纤溶酶原激活物受体;急性呼吸窘迫综合征;心源性肺水肿
急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS)是全世界范围内病死率极高的呼吸系统危重症。其包括多种肺内肺外病因:各种类型休克、感染、创伤、大量输血、药物中毒、胰腺炎和高危手术等。ARDS是由于弥漫性肺泡损伤导致肺泡毛细血管膜损伤、肺水肿及中性粒细胞的炎性反应。轻度ARDS阶段很多临床表现与心源性肺水肿 (cardiagenic pulmonary edema,CPE)难于区分,而且诊断ARDS必须排除CPE,临床常用的脑钠素(berger nephropathy,BNP)及pro-BNP等心肌损伤标志物也可为CPE的诊断提供依据,但其对ARDS与CPE的鉴别仍有一定的局限性。临床诊断最终要利用心动超声及侵入性的血流动力学检查来鉴别。目前国内外对ARDS的生物信息研究较多[1],一些生物标志物研究已经取得了一定的进展,如:基质金属蛋白酶 (matrix metallo proteinases,MMP)-1、-9,血管内皮生长因子受体 (vascular endothelial growth factor receptor,VEGFR)-1、-2,血浆纤溶酶原激活物抑制剂-1 (plasminogen activator inhibitor-1,PAI-1),肿瘤坏死因子 (tumor necrosis factor,TNF)-α,白介素 (interleukin,IL)-8、-12等。这些研究着重于炎性介质参与的发病机制及信号转导等方面,对ARDS和CPE的鉴别未能进行系统的研究及指导。
近年来,su-PAR作为一种新型的炎性反应标志物受到关注,su-PAR是尿激酶型纤溶酶原激活物受体 (urokinase plasminogen activator receptor,uPAR) 的可溶形式,其由多种细胞分泌,包括中性粒细胞、淋巴细胞、单核细胞、巨噬细胞和内皮细胞等[2]。su-PAR在血液和其他组织液中均可测量。su-PAR的血清水平较稳定、无昼夜变化,且不受饮食的影响。它参与了多种免疫机制,包括细胞黏附、迁移、驱化、蛋白水解、免疫活化、组织重塑,侵袭和信号转导。近年多项研究显示,在低度炎症、感染性疾病 (病毒、细菌和寄生虫感染)、肿瘤、慢性肝病、慢性肾病中su-PAR水平升高,而且su-PAR水平越高,疾病的预后就越差。su-PAR与PAI-1共同参与了ARDS时肺内的纤维蛋白相关炎症[3-4]。鉴于su-PAR由炎症刺激活化后的中性粒细胞所释放的特性及趋化特性,及其在ARDS的纤维蛋白相关炎症中的特殊作用,研究和分析su-PAR在ARDS患者血清中的水平有其重要的临床意义。
本次研究目的在于寻找一个相对敏感的生物标志物,不仅能够对ARDS和CPE患者进行早期识别,而且对ARDS的病情程度及预后的判断也具有重要的指导意义。
资 料 和 方 法
研究对象选取2013年1月至2014年5月复旦大学附属中山医院ICU收治的所有109例ARDS和CPE患者。本次研究排除年龄<18岁,且未进行抗凝及抗纤治疗、未使用免疫抑制剂、无免疫缺陷病及未进行血液透析治疗者。所有患者均签署知情同意书。
入组患者入ICU采血时未明确分组,采血后,根据现有的临床信息、疾病进展和治疗反应而最终诊断为ARDS或CPE。如果对诊断有异议,则进一步超声心动图或肺动脉导管检查,重新评估及讨论后达成一致意见。ARDS的纳入标准依据最新的柏林定义[5],CPE的诊断依据临床征象 (奔马律、颈静脉扩张、收缩期高血压)及其他多种检查:X线胸片 (心胸比>0.53,血管宽度>65 mm),心电图 (新的ST段及T波改变)、实验室检查 (肌钙蛋白升高>0.1 ng/mL)、血流动力学监测 [肺动脉阻塞压(pulmonary artery obstruction pressure,PAOP)≥18 mmHg,EF<45%,现存严重的心脏瓣膜病(主动脉瓣或二尖瓣狭窄或返流),1 mmHg=0.133 kPa,下同],并对适当的治疗 (减轻前后负荷,局部缺血的治疗或改善心肌收缩力的治疗)有反应[6]。
资料采集患者入ICU后进行初次临床评估,根据医师的诊断及治疗情况酌情进行检查,包括有创的血流动力学监测,超声心动图,肺功能,CT血管造影等。未能确诊的患者置入Swan-Ganz进行监测。机械通气的患者容量控制通气时,平台压<35 cmH2O,根据PaCO2水平调节呼吸频率和潮气量;压力控制通气时,潮气量不超过10 mL/kg。保持PaO2>60 mmHg,调整PEEP≥5 cmH2O。所有患者在入ICU后10 h内做出ARDS或CPE的诊断。在病例入组后记录并发症、机械通气资料、血流动力学指标和实验室检查结果,并计算出APACHEⅡ、LPS和SOFA评分。根据病因把ARDS组分为感染组 (病因是感染因素)和非感染组 (所有其他病因:误吸、创伤、多次输血、失血性休克、心跳骤停后复苏)。记录从入组到以30天为事件终点随访病例的生存状态。
标本采集检测所有的入组病例采集5 mL血液,在1 h内4 ℃下离心 (2 500×g,10 min),取上清液冻存-80 ℃冰箱集中检测。用ELISA测定血清su-PAR的浓度,按照试剂盒 (美国R&D公司)说明书进行。
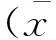
结果
一般资料共有109例病例入组,包括79例ARDS患者和30例CPE患者。ARDS病因包括肺炎38例(48.1%),非肺炎性脓毒症21例 (26.6%),失血性休克8例 (10.1%),误吸6例 (7.6%),心跳骤停后复苏4例 (5.1%)和多次输血导致者2例 (2.5%)。CPE的病因包括充血性心衰13例 (43.3%),心梗/心肌缺血9例 (30.0%),急性容量超负荷8例 (26.7%)。
根据最终的诊断分组病例特征及分层情况如表1。与ARDS组相比,CPE组患者有房颤病史者更多,氧合指数PO2/FiO2相对更高。超声心动图和血流动力学数据显示CPE组患者左室射血分数(leftventricularejectionfraction,LVEF)更低,而肺动脉闭塞压PAOP更高。

表1 ARDS和 CPE两组患者的一般资料
(续表1)
ARDS:Acute respiratory distress syndrome;CPE:Cardiogenic pulmonary edema;BMI:Body mass index;APACHE Ⅱ:Acute physiology and chronic health evaluation Ⅱ;SOFA:Sequential organ failure assessment;PO2/FiO2:A ratio of arterial oxygen partial pressure and inspiratory oxygen fraction;LVEF:Left ventricular ejection fraction;PAOP:Pulmonary artery obstruction pressure;SvO2:Oxygen saturation of venous blood;APTT:Activated partial thromboplastin time;su-PAR:Soluble urokinase-type plasminogen activator receptor.Data were presented as median (interquartile range) for continuous variables and number (%) for categorical variables.1 mmHg=0.133 kPa.
su-PAR测定水平ARDS组患者的su-PAR水平显著高于CPE组[10.42 (9.11~13.84) ng/mLvs. 4.87 (3.35~9.61) ng/mL,P<0.001]。以su-PAR水平诊断ARDS和CPE,计算ROC曲线下面积为0.821±0.049 (图1)。最佳阈值>6.43 ng/mL时,su-PAR诊断ARDS的敏感性为88.6%,特异性为66.7%。ARDS组患者分为感染组55例 (69.6%),非感染组24例 (30.4%)。Su-PAR水平分别为10.23 (8.74~14.38) ng/mL和10.49 (9.29~11.88) ng/mL,两组间su-PAR水平差异无统计学意义 (P=0.444)。
ARDS组生存分析结果ARDS组患者死亡率为27.8%。非存活组与存活组相比,APACHEⅡ评分及SOFA评分及LIS评分显著升高。而PO2/FiO2、动脉血pH值、动脉乳酸水平则降低,全组一 般情况结果见表2。死亡组的su-PAR水平与存活组相比显著增高[13.35 (10.08~16.65) ng/mLvs. 10.06 (8.48~11.96) ng/mL,P=0.001]。而用su-PAR评价ARDS组的生存者和死亡者的30天存活率的ROC曲线下面积为0.703±0.071 (图2)。预测死亡的最佳阈值为su-PAR>11.71 ng/mL,此最佳阈值诊断特异度可达71.9%,敏感度68.2%。随访患者30天存活情况,以su-PAR水平11.71 ng/mL为最佳阈值绘制Kaplan-Meier生存曲线 (图3),低于此值者存活率与高于此值者差异有统计学意义 (P=0.005)。单变量Logistic回归分析显示动脉血pH值、动脉乳酸值、APACHEⅡ评分、SOFA评分、PO2/FiO2和血清su-PAR为ARDS组患者30天死亡率的共同预测因子,多变量Logistic回归分析显示在校正风险因子 (动脉血pH值、动脉乳酸值)后APACHEⅡ评分 (OR=1.196,P=0.016),SOFA评分 (OR=1.462,P=0.016),su-PAR (OR=1.258,P=0.003)和PO2/FiO2(OR=0.009,P=0.001 8)仍可作为死亡率的独立预测因子。ARDS患者死亡率预测Logistic回归分析结果见表3。
(续表2)
ARDS:Acute respiratory distress syndrome;BMI:Body mass index;APACHE Ⅱ:Acute physiology and chronic health evaluation Ⅱ;SOFA:Sequential organ failure assessment;LIS:Lung injury score;PO2/FiO2:A ratio of arterial oxygen partial pressure and inspiratory oxygen fraction;LVEF:Left ventricular ejection fraction;PAOP:Pulmonary artery obstruction pressure;SvO2:Oxygen saturation of venous blood;APTT:Activated partial thromboplastin time;su-PAR:Soluble urokinase-type plasminogen activator receptor.Data were presented as median (interquartile range) for continuous variables and number (%) for categorical variables.1 mmHg=0.133 kPa.
讨论
早期识别轻度的ARDS与CPE有利于选择更合理的治疗方案。有很多方法可用于轻度ARDS和CPE的早期诊断,如:心动超声、血流动力学监测、BAL等。近年来一些生物标志物的检测对轻度ARDS的诊断也提供了帮助,如:IL-6,IL-8,TNFR,SP-D,VEGF,MMP-9,PAI-1[7-11]等。本次研究检测了一种新的炎症标志物su-PAR,它在ARDS中的价值和作用还有待于更深入的探究。我们在ARDS组及CPE组中测定su-PAR浓度发现,su- PAR在ARDS组中显著高于CPE组。目前大量的关于su-PAR的研究结果显示,炎症和感染时外周血su-PAR浓度增高。包括脓毒血症、呼吸机相关肺炎、HIV感染、肺结核、肺炎双球菌菌血症[12-16]。Su-PAR在脓毒血症的诊断价值不如其他传统炎症标志物PCT及CRP,三者ROC曲线下面积分别为0.62,0.86和0.78[17]。本研究中su-PAR对ARDS诊断的ROC曲线下面积是0.821,说明su-PAR的血清浓度对CPE与ARDS的鉴别具有一定的价值。
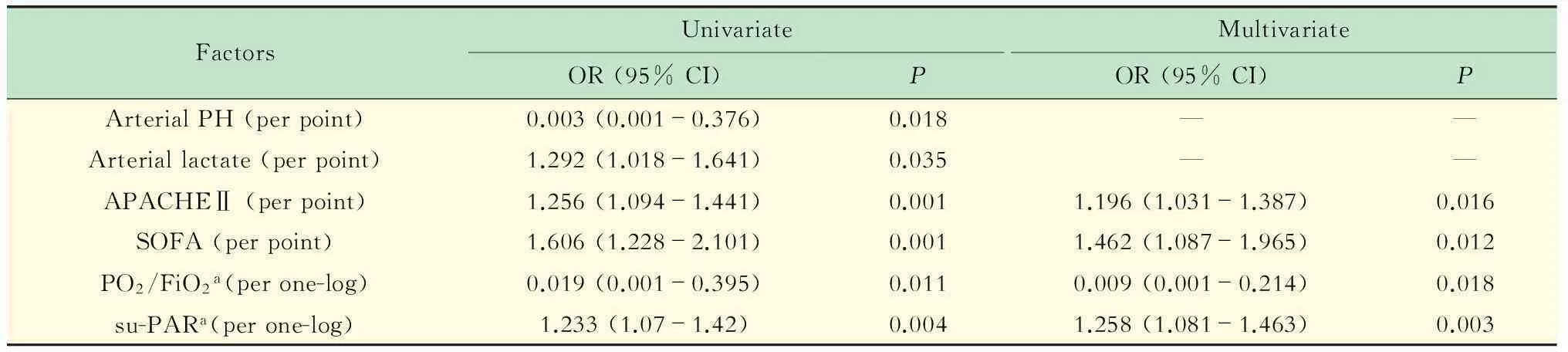
表3 ARDS患者死亡率预测Logistic回归分析
ARDS:Acute respiratory distress syndrome;OR:Odds ratio;APACHE Ⅱ:Acute physiology and chronic health evaluation Ⅱ;SOFA:Sequential organ failure assessment;PO2/FiO2:A ratio of arterial oxygen partial pressure and inspiratory oxygen fraction;su-PAR:Soluble urokinase-type plasminogen activator receptor.a:log-transformed.
Su-PAR和PAI-1是凝血-纤溶过程的产物,t-PA和u-PA可激活纤溶酶原成为纤溶酶。PAI-1是纤溶酶原激活物的内源性抑制剂[18-20]。在ARDS时肺的血管内凝血导致血管内的血栓形成,而肺泡间隔内纤溶被抑制、促凝活性被加强,迁移到此的纤维蛋白沉积增加而导致肺纤维化加重,而有研究显示uPAR和PAI-1在肺泡上皮细胞有表达,它们在转录后水平影响纤溶和凝血,促进了肺纤维化,因此在ARDS时进行抗凝和纤溶是很成功的策略[4]。Ville等[21]评估ARDS、脓毒血症和肾脏替代治疗患者的su-PAR和PAI-1水平对死亡率的预测价值,认为高浓度的su-PAR可预测纤维蛋白相关炎症性疾病的死亡率。 Su-PAR同PAI-1一样共同参与了ARDS的纤维蛋白相关的炎性反应。PAI-1作为ARDS的生物标志物已被认可,su-PAR也可能成为一个新的ARDS的生物标志物。
此外,su-PAR在ARDS发病机制中的中性粒细胞引发的炎性反应中也起到了一定的作用[22]。在ARDS的发病中,中性粒细胞被激活,各种抗炎及促炎因子大量释放,多种因子激发了su-PAR的释放,即可由炎症刺激活化的中性粒细胞释放,也可由IL-1β、bFGF或VEGF等因子从内皮细胞刺激释放,还有PDGF-BB、bFGF或IL-1β可刺激血管平滑肌细胞释放su-PAR[23]。生理条件下uPAR在单核细胞、巨噬细胞、中性粒细胞、血管内皮细胞和活化T细胞上表达。在炎症发生时,细胞表面的uPAR表达增高,在磷脂酶或蛋白酶的水解作用下,uPAR从细胞表面脱落,释放入外周循环,成为可溶性uPAR,即su-PAR,检测uPAR和su-PAR水平可以从一个侧面反映细胞分子水平的病理变化,uPAR因存在于细胞表面,取材受到一定限制,而su-PAR取材和检测更为简便,su-PAR的血清水平较稳定、无昼夜变化,且不受饮食的影响。用su-PAR的检测来研究疾病过程已成为一个重要方向。
进一步对ARDS组患者随访30天的存活情况及对相关因素进行分析后发现,非存活组患者的PO2/FiO2更低,su-PAR浓度更高,病情更重。非存活组患者的ARDS的以中性粒细胞为核心的炎症暴发反应更加剧烈,导致肺泡上皮细胞及血管内皮细胞损伤严重,致使氧合情况恶化,同时在相关因子刺激下su-PAR释放增加,此外,低氧情况也可以进一步导致su-PAR的表达增多,一些研究证实了这一点。Wojta等[24]研究发现低氧处理过的内皮细胞uPA的活性下降。有研究发现[25-26],低氧条件下人微血管内皮细胞 (human microvascular endothelial cells,hMVECs)的uPAR的表达增多,并且与其他类型的细胞如滋养层细胞、人脐静脉血管内皮细胞 (hUVECs)、乳腺癌细胞极其一致。在低氧条件下,uPAR的高表达和纤溶酶形成增多有助于hMVECs血管形成反应的增强。研究还发现,在uPAR的5’端区域有3个潜在的HIF-1的捆绑序列,表明低氧能够直接影响uPAR的转录,或者低氧对基因转录的影响可能提高了uPAR表达的稳定性。因此在ICU的ARDS患者中推广su-PAR的检测,将有利于对患者病情的危重程度进行判断分层,从而对治疗进行有益的指导。
本研究用su-PAR预测ARDS组的30天死亡率的ROC曲线下面积是0.703。多元回归分析显示,su-PAR是一个对预后有着较强预示作用的因子。当su-PAR>11.71 ng/mL时,患者的死亡率显著增加。而APACHEⅡ评分、SOFA评分、su-PAR和PO2/FiO2可作为死亡率的独立预测因子。对比既往的研究,一项纳入1914例脓毒血症的前瞻性研究[27]结果显示,su-PAR≥12 μg/L、APACHEⅡ≥17可作为脓毒血症不良预后的独立因素。Huttunen等[28]研究了132例菌血症 (金黄色葡萄球菌、链球菌或大肠埃希菌引起)患者,su-PAR预测死亡的最佳阈值是11 ng/mL。随访30天时死亡18例,其中15例su-PAR>11 ng/mL,su-PAR在预测死亡上与SOFA评分相当甚至更好。而在本研究中,su-PAR预测死亡较SOFA评分稍差,但其对死亡的预测作用与相关研究相符。
su-PAR作为一种新型的生物标志物,对ARDS和CPE患者具有较好的鉴别诊断及对ARDS患者病情预测的价值,临床上已有科研人员研制uPA/su-PAR结合抑制剂用于肿瘤的靶向治疗,但其在疾病发生发展中的机制有待进一步研究。su-PAR在ICU中对ARDS病情的诊断及判断有极大的临床应用前景。
本研究存在一些局限,首先研究样本量小,病种组成还不够全面,取材有一定的局限;其次没有同期测定肺泡液中su-PAR的浓度;最后没有同期进行其他生物标志物测定。CPE的入组病例相对较少,可能会导致su-PAR对ARDS诊断的敏感性较高,特异度下降。
结语本研究对su-PAR是否可作为鉴别ARDS/ARDS和CPE患者的生物标志物提供了依据,su-PAR可作为ARDS/ARDS患者短期死亡的预测因子,其对ICU的ARDS患者的病情判断有一定的指导意义和临床应用价值。
致谢复旦大学中山医院ICU郑逸隽医师及相关医护人员在病例样本采集中提供了帮助。
参考文献
[1]FANG X,BAI C,WANG X.Bioinformatics insights into acute lung injury/acute respiratory distress syndrome[J].ClinTranslMed,2012,1 (1):9.
[2]THUNΦ M,MACHO B,EUGEN-OLSEN.suPAR:the molecular crytal ball[J].Dismarkers,2009,27(3):157-172.
[3]GYETKO MR,CHEN GH,MCDONALD RA,etal.Urokinade is required for the pulmonary inflammatory response to Cryptococcus neofornans,A murine transgenic model[J].JClinInvest,1996,97(8):1818-1826.
[4]IDELL S.Coagulation,fibrinolysis,and fibrin deposition in acute lung injury[J].CritCareMed,2003,31(4 Suppl):S213-S220.
[5]FERGUSON ND,FAN E,CAMPOROTA L,etal.The Berlin definition of ARDS:an expanded rationale,justification,and supplementary material[J].IntensiveCareMed,2012,38(10):1573-1582.
[6]GROPPER MA,WIENER-KRONISH JP,HASHIMOTO S.Acute cardiogenic pulmonary edema[J].ClinChestMed,1994,15(3):501-515.
[7]DOROSZKO A,HURST TS,POLEWICZ D,etal.Effects of MMP-9 inhibition by doxycycline on proteome of lungs in high tidal volume mechanical ventilation-induced acute lung injury[J].ProteoSci,2010,8:3.
[8]MEDFORD ARL,IBRAHIM NBN,MILLAR AB.Vascular endothelial growth fator receptor and coreceptor expression in human acute respiratory distress syndrome[J].JCritCare,2009,24(2):236-242.
[9]SAPRU A,CURLEY MA,BRADY S,etal.Elavated PAI-1 is associated with poor clinical outcomes in pediatric patients with acute lung injury[J].IntensiveCareMed,2010,36(1):157-163.
[10]FREMONT RD,KOYAMA T,CALFEE CS,etal.Acute lung injury in Patients with Traumatic injuries:Utility of a panel of biomarkers for diagnosis and pathogenesis[J].JTrauma,2010,68(5):1121-1127.
[11]WARE LB,MATTHAY MA,PARSONS PE,etal.Pathogenetic and prognostec significance of altered cogulation and fibrinolysis in acute lung injury/acute respiratory distress syndromen[J].CritCareMed,2007,35 (8):1821-1828.
[12]SAVVA A,RAFTOGIANNIS M,BAZIAKA F,etal.Soluble urokinase plasminogen activator receptor (su-PAR)for assessment of disease severity in ventilator-associated pneumonia and sepsis[J].JInfict,2011,63 (5):344-350.
[13]YILMAZ G,MENTESE A,KAYA S,etal.The diagnosic and prognostic significance of soluble urokinase plasminogen activator receptor in crimean-congo hemorrhagic fever[J].JClinVirol,2011,50 (3):209-211.
[14]ANDERSEN O,EUGEN-OLSEN J,KOFOED K,etal.su-PAR associates to glucose metabolic abrration during glucose stimulation in HIV-infected patients on HAART[J].JInfect,2008,57 (1):55-63.
[15]RABNA P,ANDERSEN A,WEJSE C,etal.Urine suPAR levels compared with plasma suPAR levels as predictors of post consultation mortality risk among individuals assumed to be TB-negative:a prospective cohort study[J].Inflammation,2010,33 (6):374-380.
[16]WITTENHAGEN P,KRONBORG G,WEIS N,etal.The plasma level of soluble urokinase receptor is elevated in patients with streptococcus pneumonia bacteraemia and pridicts mortality[J].ClinMicrobiolInfect,2004,10 (5):409-415.
[17]DONADELLO K,SCOLLETTA S,COVAJES C,etal.su-PAR as a prognostic biomarker in sepis[J].BMCMed,2012,10:2.
[18]HOESKSTRA T,GELEIJNSE JM,SCHOUTEN EG,Kluft C.Plasminogen activator inhibitor-type 1:its plasma determinants and relation with cardiovascular risk[J].ThrombHaemost,2004,91(5):861-872.
[19]HORREVOETS AJ.Plasminogen activator inhibitor 1 (PAI-1):in vitro activities and clinical relevance[J].BrJHaematol,2004,125(1):12-23.
[20]GYETKO MR,CHEN GH,MCDONALD RA,etal.Urokinade is required for the pulmonary inflammatory response to Cryptococcus neofornans,A murine transgenic model[J].JClinInvest,1996,97(8):1818-1826.
[21]VILLE J,RUNKUAN Y,RITA L,etal.SuPAR and PAI-1 in critically ill,mechanically ventilated patients[J].IntensiveCareMed,2013,39(3):489-496.
[22]DAVYDOW DS,DESAI SV,NEEDHAM DM,etal.Psychiatric morbidity in survivors of the acute respiratory distress syndrome:a sytematic review[J].PsychosomMed,2008,70(4):512-519.
[23]CHAVAKIS T,WILLUWEIT AK,LUPU F,etal.Release of soluble urokinase receptor from vascular cells[J].ThrombHaemost,2001,86(2):686-693.
[24]WOJTA J,JONES RL,BINDER BR,Hoover RL.Reduction in pO2 decreases the fibrinolytic potential of cultured bovine endothelial cells derived from pulmonary arteries and lung microvasculature[J].Blood,1988,71(6):1703-1706.
[25]GRAHAM CH,FITZPATRICK TE,MCCRAE KR.Hypoxia stimulates urokinase eceptor expression through a heme protein-dependent pathway[J].Blood,1998,91(9):3300-3307.
[26]STEIN I,NEEMAN M,SHWEIKI D,etal.Stabilization of vascular endothelial growth factor mRNA by hypoxia and hypoglycemia and coregulation with other ischemia-induced genes[J].MolCellBiol,1995,15(10):5363-5368.
[27]GIAMARELLOS-BOURBOULIS EJ,NORRBY-TEGLUND A,MYLONA V,etal.Risk assessment in sepis:a new prognostication rule by APACHEⅡscore and serum soluble urokinase plasminogen activator receptor[J].CritCare,2012,16 (4):R149.
[28]HUTTUNEN R,SYRJANEN J,VUENTO R,etal.Plasma level of soluble urokinase-type plasminogen activator receptor as a predictor of disease severity and case fatality in patients with bacteraemia:a prospective cohort study[J].InternMed,2011,270(1):32-40.
Increased plasma levels of soluble urokinase-type plasminogen activator receptor in patients with acute respiratory distress syndrome
SHEN Li-hua▲, ZHANG Zhong-wei▲, ZHU Biao△
(DepartmentofAnaesthesiaIntensiveCareUnit,ShanghaiCancerCenter-DepartmentofOncology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China)
【Abstract】ObjectiveTo assess the diagnostic and prognostic value of measuring soluble urokinase-plasminogen activator receptor (su-PAR) in acute respiratory distress syndrome (ARDS) patients.MethodsPlasma su-PAR was collected from 79 patients with ARDS and 30 patients with cardiogenic pulmonary edema (CPE) at enrollment.Levels of su-PAR were measured by ELISA.ResultsPatients with ARDS had significantly higher median levels of su-PAR compared with patients with CPE [10.42 (9.11-13.84) ng/mL vs. 4.87 (3.35-9.61) ng/mL,P<0.001] at enrollment.The su-PAR levels of survivors was significantly lower than that of non survivors [10.06 (8.48-11.96) ng/mL vs. 13.35 (10.08-16.65) ng/mL,P<0.001] in ARDS patients.Multivariate logistic regression showed that su-PAR (OR=1.52,P=0.034) was the independent predictor for 30-day mortality in patients with ARDS.The cut-off value of Su-PAR is 11.17 ng/mL in ARDS group.The mortality of 30 days in patients whoses value below 11.17 ng/mL is significantly lower than patients whose value exceed 11.17 ng/mL.ConclusionsPlasma su-PAR levels of ARDS patients were significantly higher than that of CPE patients.su-PAR as a biomarker is important in the differential diagnosis of patients with ARDS and CPE.su-PAR was a strong prognostic marker for short-term mortality in ARDS.
【Key words】soluble urokinase-type plasminogen activator receptor;acute respiratory distress syndrome;cardiagenic pulmonary edema
(收稿日期:2015-07-12;编辑:王蔚)
【中图分类号】R181.3+2,R563.8
【文献标识码】A
doi:10.3969/j.issn.1672-8467.2016.02.008
▲Co-first authors
△Corresponding authorE-mail:zhubiaozs@sohu.com

