基于纯种分离技术对古井贡酒桃花曲微生物进行分离鉴定的研究
周庆伍,汤 斌,李安军,汤有宏(.安徽古井贡酒股份有限公司,安徽亳州3680;.安徽工程大学微生物发酵安徽省工程技术研究中心,安徽芜湖4000)
基于纯种分离技术对古井贡酒桃花曲微生物进行分离鉴定的研究
周庆伍1,汤斌2,李安军1,汤有宏1
(1.安徽古井贡酒股份有限公司,安徽亳州236820;2.安徽工程大学微生物发酵安徽省工程技术研究中心,安徽芜湖241000)
摘要:根据大曲微生物的特性和生长特点,模拟大曲的微生态环境以不同的培养基和培养条件对微生物进行分离、纯化,用细菌16S rRNA、真菌ITS-5.8S rRNA目的基因扩增、序列同源性分析鉴定、构建大曲中霉菌和酵母菌基于ITS-5.8S rRNA的系统发育树,确定并应用纯种分离技术分离大曲微生物各种菌株。结果表明,古井贡酒大曲微生物表现出高度的多样性,窖泥中微生物很大一部分来源于大曲。
关键词:纯种分离技术;大曲;微生物;分离;鉴定
浓香型白酒风味的形成除了与原料、酿造工艺有关,还与大曲的质量有着重要联系。大曲是浓香型白酒生产的前提,大曲中微生物的构成与大曲的质量有着直接的关系。微生物的表观特征和系统发育相关性是分类学中对生物分类的两种原则。16S rRNA是研究细菌系统发育最早的方法,由于其片段的足够长以及进行过程中的保守性,在细菌鉴定领域已得到广泛认可。而5.8S rRNA由于序列过短,且过度保守,其在真菌鉴定方面最初并未得到认可,但由于其两端的内转录间隔区(ITS)序列具有相对较快的进行速度,故结合ITS-5.8S rRNA使其非常适合真菌的系统发育分析。
1 材料与方法
1.1分析样品
样品来自于古井贡酒储藏成熟的桃花曲,将曲块粉碎待用。
1.2分离培养基
土豆培养基;YPD培养基;察氏培养基;醋酸钠培养基;孟加拉红培养基;牛肉膏蛋白胨培养基;高氏一号培养基;MRS培养基;巴氏培养基。
窖泥提取液培养基[1]:取窖泥50 g,加入200 mL水,充分摇匀,纱布过滤,灭菌。
1.3微生物发酵培养基
种子培养基:土豆培养基。
发酵培养基:CMC培养基:羧甲基纤维素钠2 %,硫酸铵0.3 %,磷酸二氢钾0.1 %,MgSO40.1 %,CaCl20.2 %,吐温80(0.025 %),微量元素1 mL(微量元素:5.0 mg硫酸亚铁;1.56 mg硫酸锰;1.4 mg硫酸锌;2.0 mg氯化钴,定容至1000 mL)。
淀粉培养基:可溶性淀粉2 %,牛肉膏0.5 %,Pep-tone 0.5 %,NaCl 0.5 %,加水至100 mL。
糖化酶培养基:葡萄糖0.1 %,可溶性淀粉1.9 %,其他同淀粉培养基。
1.4实验方法
1.4.1大曲中微生物的分离筛选
采用梯度稀释的方法,每个梯度涂布4个平板,30℃培养,每天观察分离平板,记录菌落大小、颜色、边缘特点、表面光滑程度并镜检来筛选菌株,挑取单菌落划线培养保存。
1.4.2筛选菌株的分子鉴定
1.4.2.1细菌16S rDNA的PCR扩增反应体系[1]
反应体系:PCR Buffer( Mg2+) 5 μL;Forward primer 1 μL;Reverse primer 1 μL;10 mmol/L dNTP 1 μL;TaqDNA聚合酶3 μL;DNA模板2 μL;ddH2O 37 μL。
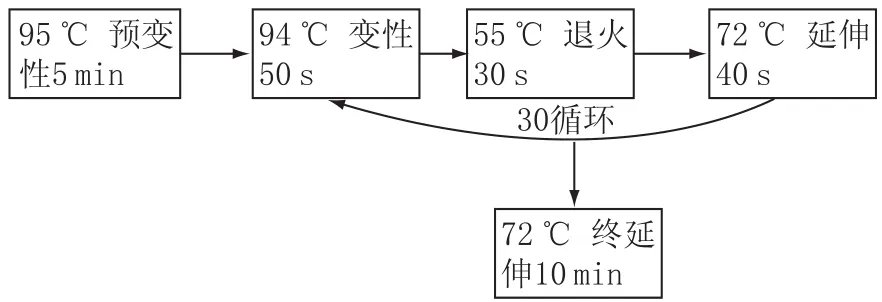
图1 细菌16S rDNA的PCR扩增条件
1.4.2.2真菌ITS-5.8S rRNA的PCR扩增反应体系
反应体系:PCR Buffer 5 μL;10 mmol/L dNTP 1 μL;25 mM MgCl24 μL;Forward primer 1 μL;Reverse primer 1 μL;5 UTaqDNA聚合酶3 μL;DNA模板1 μL;ddH2O 34 μL。

图2 真菌ITS-5.8S rRNA的PCR扩增条件
1.4.2.3琼脂糖凝胶电泳
将所扩增的目的片段用1 %琼脂糖电泳检测,电压150 V,电泳20 min。电泳结束后用UV凝胶成像仪采集照片。
1.4.2.4PCR扩增产物纯化
采用上海生工的PCR产物纯化试剂盒进行纯化。纯化的原理是微孔膜吸附大于100 bp的DNA片断,而引物、酶、dNTP、单核甘酸等小片段可以用溶液洗涤除去。最后吸附到微孔膜上的DNA片断用Elution Buffer或水洗脱下来。
1.4.2.5目的基因测序
将纯化好的目的片段低温保存,送上海生工测序。16S rRNA测序为双向测通两个反应,ITS-5.8S rRNA测序为单方向一个反应。
1.4.2.6真菌ITS-5.8S rRNA同源性分析和系统发育树的构建
所测得序列用NCBI数据库在线比对,从NCBI上下载相似序列,用Clustal X以最大同源性原则进行多序列比对,利用MEGA4.0软件选用P-distance距离模式(Neighbor-Joining)来构建系统发育树,利用Bootstrap法重复1000次来检测发育树。
2 结果与分析
2.1大曲中微生物的分离筛选
从古井贡酒大曲中分离筛选出10株霉菌、酵母菌5株、12株细菌,霉菌有Aspergillus、Mucor、Lichtheimia、Paecilomyces 4个属;酵母菌有Saccharomyces cerevisiae、Candida tropicalis、Pichia burtonii 3个属;细菌共有4个属,分别为Bacillus、Lactobacillus、Brevibacillus、Sporosarcina。
对筛选得到的微生物进行表观特征分析和显微镜镜检来去除冗余。表1中生理生化等信息是通过比对中国工业微生物菌种保藏管理中心或查阅相关资料获得的。
2.2筛选菌株的分子鉴定
2.2.1基因组的提取结果
将基因组DNA用1 %琼脂糖凝胶电泳检测其结果,电压150 V,电泳20 min。一般基因组的提取往往是为了后续进一步实验(如目的基因的扩增),故含有的一些弥散条带并不影响后续实验。
2.2.2真菌的ITS-5.8S rRNA基因的PCR扩增结果
在图3中,图3A是大曲细菌16S rRNA目的基因的扩增结果,泳道1~5为目的条带,从图中可看出,条带单一,大小约为1500 bp。图3B是大曲真菌的ITS-5.8S rRNA目的基因扩增结果,从图中可见,条带单一,清晰,大小约600 bp,可进行下一步纯化实验。
2.2.3目的基因测序
将纯化过后的目的条带送上海生工测序,16S rRNA测序为双向测通两个反应,ITS-5.8S rRNA测序为单方向一个反应。
2.2.416S rRNA和ITS-5.8S rDNA序列同源性分析
本次从古井贡酒大曲中共分离出10株霉菌,5株酵母菌。霉菌有Aspergillus、Mucor、Lichtheimia、Paecilomyces 4个属;酵母菌有Saccharomyces cerevisiae、Candida tropicalis、Pichia burtonii 3个属。霉菌中主要以曲霉属为主,黑曲霉2株、米曲霉2株、溜曲霉1株、棘孢曲霉1株、伞枝犁头霉1株、卷枝毛霉2株、拟青霉属1株、酵母菌包括酿酒酵母2株[2]、假丝酵母2株、伯顿毕氏酵母1株。微生物分类学认为,全序列具有97 %~99 %相似性的判定为1个属,将全序列具有99 %~100 %的定位1个种。而全序列相似性在93 %~95 %则可认为属于不同的属。将本次研究获得的15株菌株与NCBI中同源性比对过后,除了#Y2相似性为96 %以外,其他相似性均大于99 %(见表2)。

表1 大曲中真菌的菌落形态及相似性比对
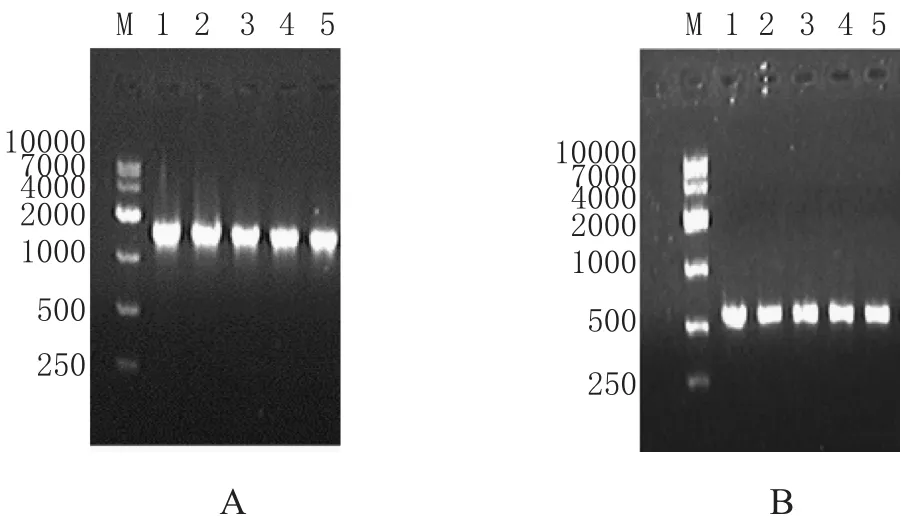
图3 16S rRNA和ITS-5.8S rRNA的PCR扩增结果

表2 浓香型白酒大曲中ITS-5.8S rRNA的同源性比较结果
16S rRNA序列同源性分析:
从大曲中分离筛选出12株细菌,这12株细菌有4个属,分别为Bacillus、Lactobacillus、Brevibacillus, Sporosarcina,其中乳酸菌属Lactobacillus有4株,芽孢杆菌属Bacillus有5株,短芽孢杆菌属有1株,芽孢八叠球菌属Sporosarcina有2株,通过与NCBI数据库比对后发现此次所有序列相似性均高于97 %。这些菌株在窖泥中都能分离筛选到[3],而浓香型白酒发酵过程中窖泥周期性地与酒醅中菌群、营养成分相互交换等作用,说明窖泥中的细菌很大一部分来源于大曲(表3)。

表3 大曲中细菌的同源性比较结果
2.2.5大曲中真菌基于ITS-5.8S rRNA和系统发育树的构建

图4 霉菌基于ITS-5.8S rRNA基因构建的系统发育树(N-J)
由图4的系统发育树可看出,霉菌主要分为四大类菌群,#M3、#18、#19、#22为一类,其中#M3、#19处于一小分支上,与Aspergillus oryzae(JN561266.1)和Aspergillus tamarii(FR851849.1)亲缘关系比较近。#18、#22各自在一小分支上,分别与Aspergillus niger(HQ401273.1)、Paecilomyces sp(HM626196.1)亲缘关系较近。虽然与Aspergillus aculeatus(JX501394.1)距离很近,但与其他曲霉属距离较远。#M5与#1相对于#2、#M3、#18、#19、#22来说处于相对较外群的位置,#M5与Mucor circinelloides (GQ376118.1)、Rhizomucor variabilis(FJ227895.1)亲缘关系均比较近,但相似性上与Mucor更为接近,故判断为Mucor菌属。
由图5的酵母菌的系统发育树可看出,酵母主要分为三大分支,#Y2、#Y7处于一支,而#Y5、#9各自处在一分支上。#Y2、#Y7与Saccharomyces cerevisiae亲缘关系较近,而#Y5、#9分别与Candida tropicalis、Pichia burtonii距离较近,这与NCBI同源性比较的结果也是一致的。
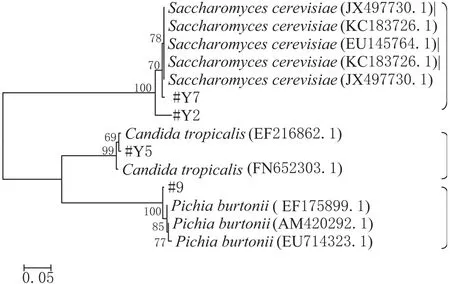
图5 酵母菌基于ITS-5.8S rRNA基因构建的系统发育树(N-J树)
3结论
从古井贡酒的大曲中微生物分离筛选的结果来看,古井贡酒大曲中微生物菌群呈现明显的多样性。本次从古井贡酒大曲中共分离出12株细菌,10株霉菌,5株酵母菌。
从大曲中分离筛选出这12株细菌有4个属,分别为Bacillus、Lactobacillus、Brevibacillus、Sporosarcina,其中乳酸菌属Lactobacillus有4株,芽孢杆菌属Bacillus有5株,短芽孢杆菌属有1株,芽孢八叠球菌属Sporosarcina 有2株,通过与NCBI数据库比对后发现此次所有序列相似性均高于97 %。这些菌株在窖泥中都能分离筛选到,而浓香型白酒发酵过程中窖泥周期性地与酒醅中菌群、营养成分相互交换等作用,说明窖泥中细菌很大一部分来源于大曲。大曲中细菌的筛选鉴定结果也证明了与浓香型白酒发酵工艺是保持一致的。
从大曲中分离筛选出10株霉菌,其中曲霉属是大曲中的优势菌属,共有6株;曲霉属是良好的糖化菌,其中黑曲霉的糖化酶较高,具有一定的发酵能力及产酸能力;而米曲霉的液化力较高,且可以产蛋白酶。
从大曲中分离筛选出的5株酵母菌有3个属,酿酒酵母[4]是酿酒的主体发酵菌,是酒精的主要来源;而假丝酵母是生香酵母,可以产生酯化酶,促进酯类物质的生成;而伯顿毕氏酵母(拟内孢霉)也是产酯酵母,此外还能够代谢产生一定的多元醇,可以增加白酒的绵甜感。
这些微生物对白酒、酱油等酿造的过程都起着重要的作用,也都是不可缺少的微生物。与国内相关研究比较,此次从大曲中分离筛选的微生物与国内的研究者也有着相似和不同的地方。刘效毅等[5]利用传统的分离方
法从高温大曲中分离出50株霉菌,主要包括曲霉属、毛霉属、青霉属等菌属,并筛选鉴定了20株典型菌株。张磊等[6]从浓香型白酒大曲中分离出典型的5株纯培养菌株,并鉴定这5株菌株分别属于Saccharomyces sp、Candida、Debaryomyces、Issatchenkia orientali、Saccharomyces cerevisiae。不同的地方主要是在文献中报道的根霉此次并没有分离出来。此外,从大曲中分离得到伯顿毕氏酵母也较少见报道。对于研究结果的差异性,一方面可能和酿酒酒厂的地理环境、酿酒工艺有关,另一方面也可能和大曲储藏时间及分离方法的局限性有关。
参考文献:
[1]汤斌,刘金英,周庆伍,等.浓香型白酒窖泥中细菌多样性的免培养技术分析[J].食品与发酵工业,2012(7):43-47.
[2]汤有宏.酒醅中酵母的分离及其生理生长特性的研究[J].酿酒, 2011(5):45-48.
[3]汤斌,刘金英,周庆伍,等.免培养技术对浓香型白酒大曲中细菌多样性的影响[J].食品与发酵工业,2011(9):36-40.
[4]汤有宏.高温曲中酵母菌的分离及耐热性研究[J].酿酒,2012 (5):35-37.
[5]刘效毅,郭坤亮,辛玉华.高温大曲中微生物的分离与鉴定[J].酿酒科技,2012(6):52-55.
[6]张磊,施思,张文学,等.浓香型白酒大曲中酵母菌的分离和鉴定[J].酿酒科技,2010(5):39-41.
[7] Janda J M,Abbott S L. Bacterial identification for publication: when is enough enough? [J].J Clin Microbiol,2002,40:1887-1891.
[8] Drancourt M,Bollet C,Carlioz R,et al.16S ribosomal DNA sequence analysis of a large collection of environmentaland clinical unidentifiable bacterial isolates[J].J Clin Microbiol,2000,38:3623-3630.
[9]胡佳,邓斌,张文学,等.浓香型白酒曲药中细菌组成及系统学分析[J].酿酒科技,2007(5):17-19.
[10]汤有宏,李红歌,李晓欢.基于Biolog ECO技术对贮存过程中大曲微生物多样性变化规律的研究[J].酿酒,2015(1):75-78.
[11]汤有宏,吴文睿.基于Biolog ECO技术分离窖泥细菌的研究[J].中国酿造,2014(12):121-125.
[12]周庆伍,穆文斌,汤有宏,等.淡雅型古井贡酒生产工艺探讨[J].酿酒,2009, 36(2):48-50.
[13]张会敏,束莹,周庆伍,等.利用非培养技术研究古井贡酒大曲中的细菌群落结构[J].现代食品科技,2014(4):44-49.
[14]刘从艾,穆文斌,徐怀玉,等.大曲酵母菌及窖泥生香菌耐酸能力的研究[J].酿酒,1999(1):35-39.
[15]杨春霞,廖永红,刘峻雄,等.牛栏山二锅头酒醅中芽孢杆菌分离鉴定及发酵风味分析[J].食品工业科技,2012(9):69-74.
Isolation and Identification of Microbes in Gujing Daqu Based on Purebred Separation Technology
ZHOU Qingwu1, TANG Bin2, LIAnjun1and TANG Youhong1
(1.Anhui Gujing Gongjiu Distillery Co. Ltd., Bozhou,Anhui 236820; 2.Anhui Engineering Technology Research Center of Microbial Fermentation,Anhui Polytechnic University,Wuhu,Anhui 241000,China)
Abstract:According to the properties and growth characteristics of Daqu microbes, the microenvironment of Daqu was simulated and microbes were separated and purified by different culture mediums in different culture conditions. Through gene amplification and sequence homologous identification of bacteria 16S rRNA and fungus ITS-5.8S rRNA, the phylogenetic tree of mildew and yeast in Daqu was constructed. The results showed that, microbes in Gujing Daqu exhibited a high degree of diversity and a large number of microbes in pits came from Daqu.
Key words:purebred separation technology; Daqu; microbes; separation; identification
通讯作者:汤有宏,高级工程师,安徽古井贡酒股份有限公司技术中心,E-mail:tyouh@163.com。
作者简介:周庆伍,男,高级工程师,国家白酒评委,硕士,安徽古井贡酒股份有限公司总经理,从事酿酒发酵技术管理与研究,发表论文十多篇。
收稿日期:2015-06-04
DOI:10.13746/j.njkj.2015251
中图分类号:TS261.1;TQ925.7;TS262.3
文献标识码:A
文章编号:1001-9286(2016)03-0037-05
优先数字出版时间:2016-01-18;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160118.1430.004.html。

