芝麻香型白酒高温大曲制曲过程中微生物群落结构特征的磷脂脂肪酸(PLFA)分析
曹 宇,翟 磊,信春晖,许 玲,姚 粟,程 池(.中国食品发酵工业研究院中国工业微生物菌种保藏管理中心,北京0007;.山东扳倒井股份有限公司,山东淄博56300)
芝麻香型白酒高温大曲制曲过程中微生物群落结构特征的磷脂脂肪酸(PLFA)分析
曹宇1,翟磊1,信春晖2,许玲2,姚粟1,程池1
(1.中国食品发酵工业研究院中国工业微生物菌种保藏管理中心,北京100027;2.山东扳倒井股份有限公司,山东淄博256300)
摘要:高温大曲是芝麻香型白酒酿造特有的糖化发酵剂,为白酒酿造提供丰富的微生物种类、各种生物酶类以及多种香味前驱物质,在传统白酒酿造过程中发挥重要的作用。本研究采用磷脂脂肪酸分析方法(phospholipid fatty acid,PLFA)对芝麻香型白酒高温大曲生产过程中微生物生物量和群落结构的动态变化进行了研究。结果表明,真菌在整个制曲过程中占主导地位,细菌的含量和种类在第1次和第2次翻曲的过程中出现规律性变化,推测这两次翻曲在制曲过程中起着关键作用。
关键词:芝麻香型白酒;高温大曲;磷脂脂肪酸(PLFA);微生物群落
芝麻香型白酒是我国传统白酒的创新香型,也是鲁酒的代表香型,以其浓、酱、清相结合的工艺特点和独特的优雅芝麻香味,符合白酒淡雅、爽净的消费趋势[1-2]。芝麻香型白酒的工艺特点包括高温制曲、高氮配料、高温堆积、高温发酵、多微共酵、分层蒸馏、长期贮存和科学勾兑。大曲是我国固态白酒酿造特有的糖化发酵剂,含有大量微生物和酶类,在传统白酒酿造过程中发挥重要的作用,故酿酒离不开曲,曲的品质决定酒质。高温大曲是以小麦等为主要原料,经多种微生物混合自然固态发酵而成,发酵最高温度可达到65℃。高温大曲为白酒酿造提供丰富的微生物种类、各种生物酶类以及多种香味前驱物质,在传统白酒酿造过程中发挥重要的作用[3-5]。高温大曲中的微生物种类和数量直接决定着芝麻香型白酒的产量和质量。因此,研究高温大曲中微生物数量、群落结构及在发酵过程中微生物群落的变化情况等,对芝麻香型白酒的酿造机理和呈香机理都有重要作用,并对芝麻香型白酒酿造工艺的优化具有重要意义[6-7]。
近年来对高温大曲微生物群落多样性研究的报道较多,主要集中在采用可培养方法和非培养方法研究其微生物群落多样性。张明春等[8]采用传统分离培养和理化指标分析方法,对白云边高温大曲和中温大曲进行了比较研究,研究发现耐高温的芽孢杆菌含量和种类较多;施安辉等[1]采用传统分离培养方法对徐坊芝麻香型白酒大曲的微生物分布进行了分析,鉴定的微生物菌种包括细菌、酵母、霉菌和放线菌;Zheng等[9]采用传统的分析方法对我国8种不同香型白酒的高温、中温和低温大曲微生物多样性进行分析,认为大曲中的微生物具有多样性和功能性,是白酒酿造过程中的重要菌剂;葛媛媛等[10]利用高温筛选和传统培养方法,借助于核糖体DNA扩增片段限制性内切酶(ARDRA)分型、分子鉴定以及系统发育分析技术,研究了芝麻香型白酒高温大曲嗜热细菌群落结构,筛选获得的85株嗜热细菌分别属于Thermoactinomyces sp.,Bacillus sp.,Schlegelella sp.以及Streptomyces sp.,4个菌属,其中第1优势菌为Thermoactinomyces vulgaris,丰度为69. 41 %;姚粟等[11]利用克隆文库的方法研究了芝麻香型白酒高温大曲的细菌群落多样性,发现Thermoactinomyces、Kroppenstedtia、Saccharopolyspora、Lactobacillus和Weissella。
磷脂脂肪酸(PLFA)是存在于活细胞中的重要膜成分,是表征样品中活体生物量和生物群落多样性的重要标记。不同种属之间微生物差异明显,且对于环境因素较为敏感,通过监测特征磷脂脂肪酸组成和数量的变化,揭示微生态环境中微生物群落结构组成及变化规律,目前广泛的应用于微生物生态学的研究中[12-18]。本研究通过磷脂脂肪酸方法分析芝麻香型白酒高温大曲生产过程中微生物生物量和群落结构的动态变化,以期对芝麻香型白酒的酿造提供理论指导。
1 材料与方法
1.1材料、试剂及仪器
1.1.1样品采集
2014年8月到2014年10月共采集11批制备不同阶段的山东扳倒井股份有限公司高温大曲样品,表1列出了高温大曲样品的基本特征。每批次采样都取曲房四边部分及中间部分的5个曲块进行粉碎混合,混合后的样品作为一个样品,密封,冷藏备用。
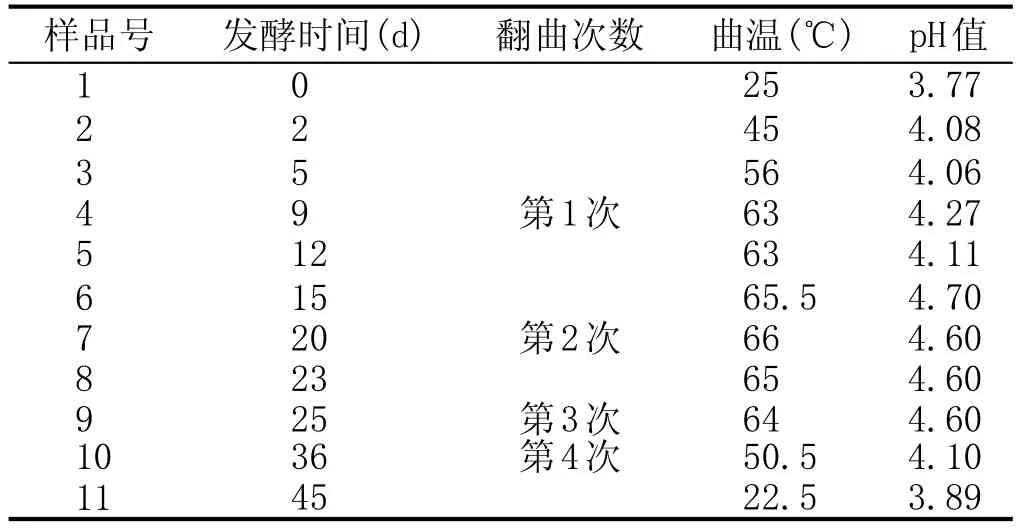
表1 高温大曲样品特征
1.1.2主要仪器及试剂
气相色谱(Agilent GC 6850 Series),Agilent;冷冻真空离心浓缩仪,Labconco;硅胶萃取小柱(SampliQ Silica),Agilent。
定量标准品:1,2-dinonadecanoyl-sn-glycero-3-phosphocholine,Avanti公司。除正己烷为色谱纯外,其他有机试剂均为分析纯。
1.2PLFA测定方法
1.2.1PLFA的提取
称取1 g大曲样品于离心管中,加入5 mL 50 mM磷酸缓冲液(pH7.4)、6 mL氯仿和12 mL甲醇,并加入5 μL 2.5 mM 1,2-dinonadecanoyl-sn-glycero-3-phosphocholine作为内标,振荡2 h,室温下3500 r/min离心10 min。取上清液于分液漏斗,将沉淀加入5 mL磷酸缓冲液,6 mL三氯甲烷,12 mL甲醇,振荡30 min,室温下3500 r/min离心10 min,将上清液与之前的上清液合并,加入分液漏斗后,加入12 mL氯仿,12 mL磷酸缓冲液,振荡2 min,过夜静置分层,取下层溶液于玻璃试管中,真空离心浓缩仪中旋干,加入5份200 μL氯仿溶解总脂肪酸后转移到硅胶萃取小柱中,分别加入5 mL氯仿、5 mL丙酮(2次)和少量甲醇清洗小柱后,加入5 mL甲醇洗脱,收集洗脱液于玻璃试管中,旋干即得到磷脂脂肪酸。
1.2.2PLFA甲基化
磷脂脂肪酸溶于1 mL甲苯与甲醇的混合液(v/v,1∶1),加入1 mL 0.2 M氢氧化钾,摇匀,37℃水浴15 min,加入0.3 mL 1 M醋酸溶液,再加入2 mL正己烷,2 mL超纯水萃取得到上层清液于玻璃试管中,再用2 mL正己烷重复萃取1次,取上清液合并到刚才试管中,旋干得到甲基化的磷脂脂肪酸,于4℃下保存待测。
1.2.3PLFA的气相色谱分析
磷脂脂肪酸样品用1 mL的正己烷溶解,进行气相色谱分析。气相色谱仪配备分流/不分流进样口,氢火焰离子化检测器(FID)及Agilent气相色谱化学工作站。色谱柱为Ultra-2柱,长25 min,内径0.2 mm,液膜厚度0.33 μm;炉温为二阶程序升温:起始温度170℃,5℃/min升至260℃,随后40℃/min升至310℃,维持1.5 min;进样口温度250℃,载气为氢气,流速0.5 mL/min,分流进样模式,分流比100∶1,进样2 μL;检测器温度300℃,氢气流速30 mL/min,空气流速216 mL/min,补充气(氮气)流速30 mL/min。
1.3数据处理
磷脂脂肪酸(PLFA)的鉴定和分析采用美国MIDI公司(MIDI, Newark, Delaware, USA)开发的基于细菌细胞脂肪酸成分鉴定的Sherlock MIS 4.5系统(Sherlock Microbial Identification System)。
2 结果与分析
2.1高温大曲发酵过程中PLFA变化

图1 高温大曲制作过程中样品PLFAs总量变化图
通过检测高温大曲制备过程中不同阶段曲样PLFA含量(图1),发现高温大曲样品的PLFA含量在0.35~3.23 mol/g,其中第20天和第25天曲样PLFA含量达到最大值,为3.2 mol/g,而此时恰好是第2次翻曲和第3次翻曲,第23天曲样PLFA含量最低为0.3 mol/g,位于2次翻曲之间,可见翻曲对曲样PLFA含量的影响很大。
磷脂脂肪酸分析主要检测碳链长度C9~C24的PLFA,我们将这些PLFA分为直链脂肪酸(Straight)、支链饱和脂肪酸(Branched)、单不饱和脂肪酸(PUFA)、多不饱和脂肪酸(MUFA)、环化脂肪酸(Cyclo)、羟基脂肪酸(Hydroxy)、10-甲基脂肪酸(10-methyl)以及二甲缩醛化脂肪酸(DMA)多种类型。测定结果表明,在高温大曲制作过程中脂肪酸18∶2 w6,9c,支链饱和脂肪酸和直链脂肪酸的含量占主导地位(70 %~90 %),并且表现出一定的规律性。脂肪酸18∶2 w6,9c和直链脂肪酸都呈现先减少后增加的趋势,而支链饱和脂肪酸呈先增加后减少的趋势,其中制曲的第9天(第1次翻曲)和第20天(第2次翻曲)是变化的转折点,也是高温大曲制备过程中的潜在关键点。
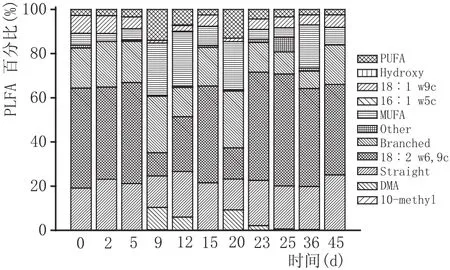
图2 高温大曲制作过程中样品PLFAs组成变化图
2.2高温大曲发酵过程中微生物群落结构特征的变化情况
微生物群落结构,即微生物不同类群的相对丰度,可通过各微生物类群的脂肪酸相对含量表征[19-20],多不饱和脂肪酸可以作为真核微生物的标志,而18∶2 w6,9和18:1ω9作为真菌的标志,单不饱和脂肪酸则可以表征好氧革兰氏阴性菌,支链脂肪酸用于表征革兰氏阳性菌,10-甲基脂肪酸表征放线菌,二甲缩醛化脂肪酸表征厌氧细菌。

表2 用于生物分类的PLFAs标记
高温大曲制作过程中生物多样性分析结果表明,真菌在整个过程中占主导地位(14.19 %~67.03 %),其含量呈现波浪形变化,先降低后升高,最低点出现在第9天和第20天曲样,革兰氏阳性菌(10.37 %~34.34 %),革兰氏阴性菌(7.87 %~35.9 %)以及真核生物(3.27 %~18.82 %)的含量也呈现波浪形变化,先升高后降低,最高点出现在第9天和第20天的曲样。此外,整个制曲过程中厌氧菌、放线菌以及丝状真菌的含量都很低,这可能与这些菌无法在高温下生长有关。生物多样性组成分析发现,第1次翻曲和第2次翻曲对生物尤其是微生物群落结果有很大的影响,推测是高温大曲制备过程中的潜在关键点。
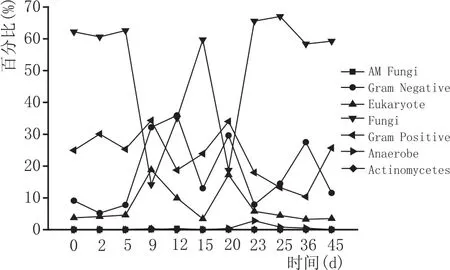
图3 高温大曲制作过程中样品生物组成变化图
对大曲的PLFA分析结果进行聚类分析,结果发现不同发酵时期的大曲可分为4类(见图4)。图4表明,发酵9 d、20 d的大曲聚为一组,发酵12 d大曲单独聚为一组,0 d、2 d、5 d、15 d、23 d、25 d、45 d的大曲聚为一组,而发酵36 d的大曲单独聚为一组。PLFA分析结果的系统发育分析与聚类分析结果一致(见图5)。不同发酵时间的大曲据其PLFA种类的相似性或差异性的大小在树冠处形成不同水平上的连接或分枝。聚合水平>10时,不同发酵时间的大曲可分为4组,发现这4组的分类与主成分分析结果一致的。从聚类分析和系统发育分析结果来看,发酵9 d和20 d的聚在一起,而其大曲PLFA的成分与其他的发酵曲样的PLFA成分相距较远,也可以从侧面反映出9 d和20 d的翻曲是高温大曲制备过程中的关键点。
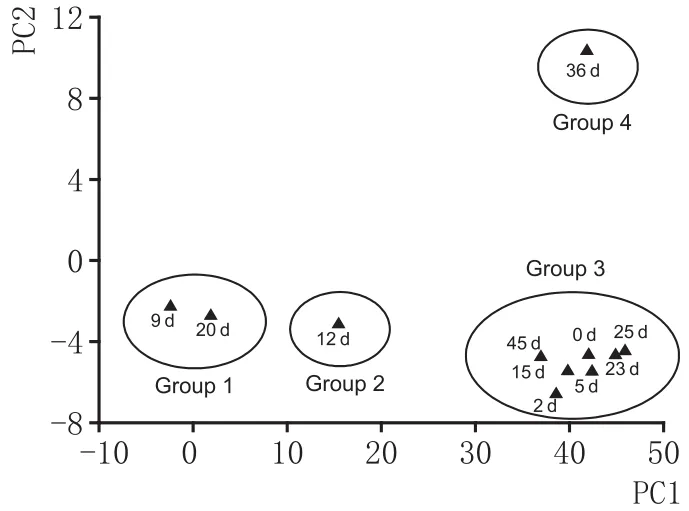
图4 不同发酵时间的高温大曲的PLFA聚类分析图

图5 不同发酵时间的高温大曲的PLFA系统发育分析图
芝麻香型高温大曲整个制备过程中,PLFA含量呈波浪形变化,发酵第20天和第25天PLFA含量达到峰值,表明这两个时间点的大曲中生物量最为丰富,而PLFA含量最低点恰好出现在发酵第23天,即2次翻曲中间,可见翻曲对高温大曲生物量的重要影响,因此翻曲是高温大曲制备过程中最为关键的工序。此外,高温大曲制备过程中18∶2 w6,9c、单不饱和脂肪酸、直链和支链饱和脂肪酸是发酵过程中的优势磷脂脂肪酸(70 %~90 %),并且表现出一定的规律性。脂肪酸18:2 w6,9c和直链脂肪酸都呈现先减少后增加的趋势,而支链饱和脂肪酸呈先增加后减少的趋势,其中制曲的第9天(第1次翻曲)和第20天(第2次翻曲)是变化的转折点,再次表明翻曲是高温大曲制备过程中的关键点。
3 讨论
通过前面PLFA的方法分析了整个大曲制曲过程中微生物群落的变化,发现发酵第9天、第20天、第25天和第36天是4次翻曲过程中微生物群落数量或者是种类都会有明显的不同,这是由于在翻曲时,会使大曲的内部生长环境发生变化,最容易使大曲中的微生物群落发生改变,从而使检测出来的磷脂脂肪酸的数量和种类也发生变化,从检测结果看也正说明了这一点,而其他时间点的微生物菌落相对比较稳定。由于翻曲的变化会造成微生物供氧量增加,这样会使真核生物、真菌和好氧菌大量生长,发酵20 d及25 d时,从检测数据来看虽然真菌的相对丰度是下降的,但是绝对数量却是上升的,而真核生物及好氧菌相对丰度是上升的,绝对数量更是上升的。
此次研究主要采用了PLFA方法,显而易见PLFA方法在分析环境微生物中有许多优势,但也存在着不足之处,这就导致本次用PLFA方法来分析高温大曲中的微生物也存在一些不足[21]:(1)由于并不知道大曲中所有微生物的特征脂肪酸,因此在许多情况下,大曲中存在的某种特殊脂肪酸无法与大曲中特定种类的微生物相对应,因而,磷脂脂肪酸分析方法不能对微生物在种或菌株水平上加以区分;(2)该分析方法在很大程度上依赖于标记脂肪酸来确定大曲微生物群落结构,因而标记上的变动将导致群落估算上的偏差;(3)细菌和真菌能够产生大量不同类型的磷脂脂肪酸,因而生长条件的改变或环境胁迫都能导致脂肪酸类型的改变。
参考文献:
[1]施安辉,李丽莉,卞建平.徐坊芝麻香型酒专用大曲中主要微生物的分布、优势菌种的鉴定及代谢产物的初步分析[J].山东食品发酵,2010,156(1):9-10.
[2]赵章报,曹广勇,赵雷光.试论芝麻香型白酒的发展趋势[J].酿酒, 2010,37(2):27-29.
[3]姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业,2012,38(6):1-6.
[4]刘洋.对中高温大曲的认识[J].酿酒,2010,37(2):87-88.
[5]杨代永,范光先,汪地强.高温大曲中的微生物研究[J].酿酒科技,2007(5):39-41.
[6]信春晖.扳倒井复粮芝麻香型白酒生产工艺的特点[J].酿酒科技,2010(3):65-66.
[7]胡凤艳.国井复粮芝麻香典型风格及其成因研究[J].酿酒,2009,36(5):31-34.
[8]张明春,曹敬华,向苇.白云边酿酒大曲微生物分析研究[J].酿酒科技,2010(2):65-67.
[9] Zheng X W, Tabrizi M R, Robert Nout M J, et al. Daqu-a traditional Chinese liquor fermentation starter[J]. Journal of the Institute of Brewing, 2011,117(71):82-90.
[10]葛媛媛,姚粟,刘洋,等.芝麻香型白酒高温大曲嗜热细菌群落研究[J].食品与发酵工业,2012,38(11):16-19.
[11]姚粟,葛媛媛,李辉,等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业,2012,38(6):1-6.
[12]陈振翔,于鑫,夏明芬,等.磷脂脂肪酸分析方法在微生物生态学中的应用[J].生态学杂志, 2005, 24(7):115-119.
[13] Zhang H X, Wang X Y, Qi H Y. Development in research methods of microbial ecology[J].Acta Ecologica Sinica, 2003, 23(5):988-995.
[14] Wang S G, Hou Y L.Application of phospholipids fatty acid method in soil microbial analysis[J]. Microbiology,2004,31 (1):114-117.
[15] Bai Z H, He H B, Zhang W, et al. PLFAs technique and it’s application in the study of soil microbiology[J].Acta Ecologica Sinica, 2006, 26 (7):2387-2394.
[16]赵金松,郑佳,吴重德,等.基于磷脂脂肪酸技术研究酱香大曲微生物群落结构[J].应用与环境生物学报,2014,20(4):558-563.
[17]徐泽江,孟镇,钟其顶,等.芝麻香型白酒堆积过程微生物群落结构特征的PLFA分析[J].食品与发酵工业,2012, 38(4):20-24.
[18]张秋芳,刘波,林营志,等.土壤微生物群落磷脂脂肪酸(PLFA)生物标记多样性分析[J].生态学报,2009,29(8):4127-4137.
[19] Green C T, Scow K M.Analysis of phospholipid fatty acids (PLFA) to characterize microbial communities in aquifers [J]. Hydrogeology Journal, 2000, 8(1):126-141.
[20] Findlay R H, Dobbs F C. Quantitative description of microbial communities using lipid analysis[M]//Handbook of Methods in Aquatic Microbial Ecology.CRC Press, 1993:271-284.
[21] Hill G T, Mitkowski NA,Aldrich-Wo1fe L, et al. Methods for assessing the composition and diversity of soil microbial communities[J].Applied Soil Ecology, 2000, 15:25-36.
白云边在荆州连获两项殊荣
本刊讯:2016年2月15日,湖北省荆州市工业经济、招商引资暨安全生产工作会议召开。湖北白云边酒业股份有限公司摘得“2015年度全市工业经济税收贡献十强”“2015年度全市安全生产工作先进单位”两项殊荣,受到荆州市政府通报表彰。
2015年,面对宏观经济持续下行、白酒市场深度调整的压力,白云边始终坚持稳中求进、做真做实不动摇,按照年初确定的“强基础、补短板、提质效、增后劲”工作方针,以市场为导向,加强综合协调,抢抓旺季增量,克难攻坚,逆势而进,胜利完成全年经营目标。全年上交税金8.06亿元,比上年增长13.68 %,增长额近1个亿,连续八年雄居荆州市工业企业纳税第一。2015年,白云边以贯彻执行新《安全生产法》为主线,以安全隐患排查与治理为重点,以防范和遏制重特大事故发生为目标,坚持“安全第一,预防为主,综合治理”的方针,层层落实安全生产责任制,健全安全生产标准化管理体系,有效保障了公司生产安全平稳运行。通过塑造安全生产文化,提高员工安全意识,职工安全理念开始从“要我安全”到“我要安全”转变,推进企业安全生产达到了一个新水平。(王小波)
Phospholipid Fatty Acid Analysis (PLFA) of the Dynamic Change of Microbial Communities in the Production Process of High-temperature Daqu for Zhimaxiang Baijiu
CAO Yu1, ZHAI Lei1,XIN Chunhui2,XU Ling2,YAO Su1and CHENG Chi1
(1.China Center of Industrial Culture Collection,National Research Institute of Food and Fermentation Industries, Beijing 100027; 2.Shandong Bandaojing Co.Ltd., Zibo, Shandong 256300, China)
Abstract:High-temperature Daqu is the typical saccharifying agent of Zhimaxiang Baijiu. It plays an important role in traditional Baijiu production by providing rich microbial species, varieties of biological enzymes, and multiple flavoring precursor substances. In this study, PLFA was applied to investigate the dynamic change of microbial biomass and community structure in the production process of Zhimaxiang hightemperature Daqu. The results sowed that, fungi were dominant in the whole Daqu-making process, and the biomass and species of bacteria presented regular change rules in the 1st and the 2nd Daqu-turning process. It can be inferred that the 1st and the 2nd Daqu-turning played key roles in Daqu-making.
Key words:Zhimaxiang Baijiu; high-temperature Daqu; PLFA; microbial community
通讯作者:程池(1962-),教授级高级工程师,博士生导师。
作者简介:曹宇(1982-),男,湖北黄冈人,助理工程师,硕士。
收稿日期:2015-10-12
DOI:10.13746/j.njkj.2015398
中图分类号:TS262.3;TS261.1;TQ925.7
文献标识码:A
文章编号:1001-9286(2016)03-0033-04
优先数字出版时间:2016-02-15;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160215.1438.001.html。

