DCE-MRI在肺癌不同病理类型的诊断价值
库雷志KU Leizhi马明平MA Mingping俞 顺YU Shun郑雪萍ZHENG Xueping马小静MA Xiaojing
作者单位1.武汉亚洲心脏病医院放射科 湖北武汉4300222.福建省立医院放射科 福建福州 350000
DCE-MRI在肺癌不同病理类型的诊断价值
库雷志1KU Leizhi
马明平2MA Mingping
俞顺2YU Shun
郑雪萍2ZHENG Xueping
马小静1MA Xiaojing
作者单位
1.武汉亚洲心脏病医院放射科 湖北武汉430022
2.福建省立医院放射科 福建福州 350000
【摘要】目的 研究肺癌动态对比增强MRI特点,初步探讨动态增强磁共振成像(DCEMRI)定量参数及半定量时间-信号强度(TIC)曲线鉴别肺癌不同病理类型的价值。资料与方法 前瞻性选取经手术病理证实为肺癌的33例患者,均行常规MRI T1WI、T2WI平扫及DCE-MRI检查,计算Ktrans、Ve、Kep值,分析DCE-MRI TIC曲线类型。采用受试者操作特征曲线计算曲线下面积(AUC),分析不同定量参数对肺小细胞癌与非小细胞癌的诊断效能,确定最佳诊断阈值。结果 ①33例患者中,腺癌18例,鳞癌8例,小细胞癌7例;中央型12例,周围型21例;肿瘤大小为1.3~6.6 cm,平均(3.6±1.3)cm;病灶呈不规则形、分叶状或斑片状12例,结节状6例,肿块型15例;边界不清26例,边界相对较清7例。②腺癌14例TIC曲线呈流出型,平台型3例,流入型1例;8例鳞癌TIC曲线均呈流出型;小细胞癌5例TIC曲线呈流出型,2例呈平台型。③不同病理类型肺癌Ktrans、Kep、Ve值比较差异有统计学意义(P<0.05);腺癌Ktrans、Kep、Ve值均高于鳞癌与小细胞癌(P<0.05);非小细胞癌Ktrans、Kep、Ve值均高于小细胞癌(P<0.05、P<0.01)。④Ktrans、Kep、Ve值对诊断小细胞与非小细胞肺癌具有中等诊断效能,其AUC分别为0.821、0.772、0.830,当Ktrans、Kep、Ve值分别设为0.082/min、0.388/min、0.253时,其诊断敏感度与特异度分别为73.1%、69.2%、69.2%和85.7%、84.3%、100.0%。结论DCE-MRI定量参数能较准确、无创地诊断不同病理类型肺癌,为临床治疗方案选择提供一定的帮助。
【关键词】肺肿瘤;磁共振成像;图像增强;病理学,外科
Department of Radiology, Fujian Provincal Hospital, Fuzhou350000, China
Address Correspondence to: MA Mingping E-mail: 15859043670@qq.com
福建省卫生系统中青年骨干人才培养项目(2013-ZQN-JC-5)。
修回日期:2015-12-24
中国医学影像学杂志
2016年 第24卷 第2期:100-105
全球每年有140万例患者死于肺癌,其5年生存率低于14%[1]。新生微血管数量和功能与肿瘤的发生、生长、浸润、复发等关系密切,而衡量肿瘤新生血管的标准是微血管密度(microvessel density,MVD),目前主要通过病理活检来监测MVD,但是作为一种有创监测方法其测量准确性受病理取材标本的制约。动态增强磁共振成像(DCE-MRI)技术可无创获得受检组织血液动力学、渗透性等生理功能变化信息,不同良恶性肿瘤血流动力学参数存在一定差异[2]。马晓玲等[3]应用DCE-MRI血流动力学参数和形态学特征鉴别肺部恶性、良性、炎性结节,具有很高的准确率,而不同组织病理学分型和分期的肺癌治疗方案不同,疗效差异很大,患者的预后及生存期也不同。本研究分析不同病理类型肺癌的DCE-MRI参数特点,旨在利用不同参数对肺癌病理类型进行准确、无创诊断,为临床治疗方案选择提供一定帮助。
1 资料与方法
1.1研究对象前瞻性收集福建省立医院2014年5月—2015年2月经CT发现并经手术病理证实为肺癌的33例患者,年龄30~86岁,平均(62.0±11.9)岁。其中男20例,年龄30~86岁,平均(63.0±12.4)岁;女13例,年龄37~71岁,平均(59.0±11.5)岁。纳入标准:①胸部CT扫描后发现有肺部结节、肿块状影;病变内毛玻璃混浊区范小于病变的50%;②胸部CT扫描示肺内病变最长横截面直径≥1 cm;③患者一般情况良好,无严重心血管疾病,无肝、肾功能障碍。排除标准:①装有心脏起搏器、心脏瓣膜、动脉瘤夹,以及体内有金属或其他不能接近强磁场的植入物等MRI检查禁忌证者;②1次屏气时间<16 s,致图像伪影无法进行数据测量;③有对比剂过敏史、支气管哮喘史者。患者临床表现及实验室检查结果见表1。本研究经本院医学伦理委员会批准,所有患者均知情同意。
1.2仪器与方法采用Siemens 1.5T超导型MRI扫描仪(Magnetom Aera,Siemens,Erlangen,Germany),18通道体部高分辨相控阵线圈。患者取仰卧位,头先进。扫描参数:T2WI冠状位扫描:TR 1400 ms,TE 92 ms,层厚6.0 mm,层间距1.2 mm,视野380 mm×380 mm,激励次数1,矩阵256×256;T1WI横断位扫描:TR 172 ms,TE 4.86 ms,层厚6 mm,层间距1.2 mm,视野380 mm×296 mm,激励次数1,矩阵320×224;T2WI横断位扫描:TR 2000 ms,TE 100 ms,层厚6.0 mm,层间距1.2 mm,视野380 mm×296 mm,激励次数1,矩阵448×314,扫描时间2 min 55 s;DCE-MRI扫描采用三维容积内插快速扰相位梯度回波(volume interpolated breath-hold examination,VIBE)T1WI序列检查:TR 3.50 ms,TE 1.33 ms,视野380 mm×380 mm,激励次数1,层厚3.5 mm,间隔0.7 mm,矩阵320×192,在第1次采集结束后,经手背静脉以3.5 ml/s、0.1 mmol/kg注入对比剂钆喷替酸葡甲胺,每次釆集时间为16 s,间隔时间3~5 s,采集15次共45期动态增强数据,扫描时间约5 min,DCE-MRI检查前后序列扫描定位层面相一致。
1.3图像后处理在Siemens syngo MRD13图像后处理工作站上,将DCE-MRI原始数据导入图像灌注处理软件(Tissue 4D,Siemens Medical Systems),在进行运动矫正及图像匹配后,利用多反转角技术,在增强前通过小反转角(2°)的Tlmap图与大反转角(15°)的蒙片图拟合,计算机自动计算出增强前定量的T1基线值,参考T1WI、T2WI及DWI图像,在病灶横截面最大层面病灶实性部分手动设置3个感兴趣区(ROI),大小为0.3~0.5 cm2,尽量避开囊变、坏死、出血区域。最适拟合(arterial input function,AFI)曲线通过软件自动计算生成,通过软件图像浏览功能,除掉由于呼吸运动伪影导致明显偏离AFI曲线点,利用该软件设计的Tofts两室血流动力学模型计算2~3个ROI的微血管转运常数(Ktrans)、反流速率常数(Kep)、血管外细胞外容积分数(Ve),取其平均值。
1.4图像分析由1名5年以上副主任医师和1名研究生独立分析图像,结果不一致时协商统一。参考Schaefer等[4]分类标准将病灶DCE-MRI半定量时间-信号强度(time intensity curve,TIC)曲线类型分为A~D型:①A型:快升-慢降型,在30 s内信号强度(signal intensity,SI)值迅速上升[早期峰值强化增强比(SIep%)>30%],开始达高峰后缓慢下降(下降斜率>0.01);②B型:快升-平台型,30 s内SI值迅速上升(1 min时SIep%>30%),以后保持稳定,轻度上升或下降(下降斜率<0.01);③C型:缓慢-上升型,SI值上升缓慢[1 min时SIep%<30%,最大峰值强化增强比(MER)>10%];④D型:无强化型,SI值升高(MER <10%)。
1.5手术与病理检查33例患者中,24例行活检穿刺术,5例行手术病理,4例行纤维支气管镜检查。将所得标本在肿瘤实质的无坏死区取材,4 μm层厚连续切片,分别行HE染色及免疫组织化学染色。由2名以上副教授采用盲法阅读全部病例的染色病理切片,进行病理组织学分型和分化程度评估。
1.6病理诊断标准肺癌组织病理分型参照2004年WHO肺、胸膜肿瘤组织病理学标准[5]。
1.7统计学方法采用SPSS 18.0软件,按照肺癌组织病理类型分组,采用Komogorov-Smirnov法进行正态分布检验,用Levene法进行方差齐性检验,如果符合正态分布且方差齐性,采用t检验比较小细胞癌与非小细胞肺癌Ktrans、Ve、Kep值,如果不符合正态分布,采用非参数秩和检验法;采用单因素方差分析比较不同肺癌病理类型Ktrans、Ve、Kep值,方差齐性采用最小显著差异法检验,方差不齐采用DunettT3法;采用ROC曲线分析Ktrans、Ve、Kep值对非小细胞癌与小细胞肺癌的诊断效能,P<0.05表示差异有统计学意义。
2 结果
2.1手术及病理结果33例患者中,腺癌18例,鳞癌8例,小细胞癌7例;中央型肺癌12例,周围型肺癌21例。
2.2MRI表现33例患者病灶大小为1.3~6.6 cm,平均(3.6±1.3)cm,其他MRI表现见表1。患者均表现为早期明显或缓慢强化,其中14例腺癌TIC曲线呈A型流出型(图1、2),3例呈B型平台型,1例呈C型流入型;8例鳞癌TIC曲线均呈A型流出型(图3);5例小细胞癌TIC曲线呈A型流出型(图4),2例呈B型平台型。

表1 33例肺癌患者MRI与临床表现(例)

图1 男,64岁,右肺中叶腺癌。T2WI示右肺中叶内侧段类圆形肿块,呈等信号(箭,A);动态增强TIC曲线呈流出型(箭,B);Ktrans伪彩图上测得ROI内动态增强定量参数Ktrans、Kep、Ve值分别为0.133/min、0.406/min、0.326(箭,C)
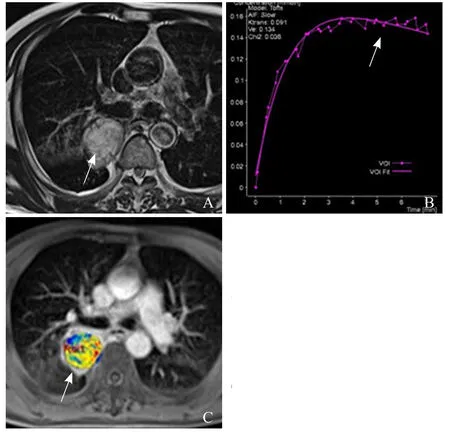
图2 男,66岁,右肺上叶腺癌。T2WI示右肺上叶类圆形肿块(箭,A);动态增强TIC曲线呈流出型(箭,B);Ktrans伪彩图上测的动态增强定量参数Ktrans、Kep、Ve值分别为0.126/min、0.592/min、0.222(箭,C)

图3 女,55岁,左肺下叶鳞癌。T2WI示左肺下叶类圆形肿块,呈等或稍高信号(箭,A);动态增强TIC曲线呈流出型(箭,B);Ktrans伪彩图示ROI内动态增强定量参数Ktrans、Kep、Ve值分别为0.297/min、1.633/min、0.185(箭,C)

图4 男,55岁,左肺上叶小细胞癌。T2WI示左肺上叶尖段类圆形肿块,呈不均匀稍高信号(箭,A);动态增强TIC曲线呈流出型(箭,B);Ktrans伪彩图上测的动态增强定量参数Ktrans、Kep、Ve值分别为0.077/min、0.592/min、0.130(箭,C)
2.3DCE-MRI定量参数
2.3.1肺癌不同病理类型Ktrans、Kep、Ve值比较肺癌不同病理类型患者Ktrans、Kep、Ve值比较,差异均有统计学意义(F=195.839、72.650、146.033,P<0.05)。腺癌的Ktrans、Kep、Ve值高于鳞癌(t=2.114、1.380、2.524,P<0.05)及小细胞肺癌(t=2.106、1.273、2.047,P<0.05),但鳞癌Ktrans、Kep、Ve值与小细胞癌比较,差异无统计学意义(t=2.364、1.532、2.086,P>0.05)。见表2。

表2 不同病理类型肺癌Ktrans、Kep、Ve值比较
2.3.2非小细胞肺癌与小细胞肺癌Ktrans、Kep、Ve值比较非小细胞癌Ktrans、Kep、Ve值均高于小细胞癌,差异均有统计学意义(P<0.05、P<0.01)。见表3。

表3 非小细胞肺癌与小细胞肺癌DCE-MRI定量参数比较
2.4Ktrans、Ve、Kep值对非小细胞肺癌与小细胞肺癌的诊断效能以病理结果为诊断对照标准,绘制DCEMRI定量参数的ROC曲线,并计算相关参数曲线下面积AUC,通过计算最大约登指数为最佳诊断阈值,得到不同定量参数判断非小细胞与小细胞肺癌敏感度与特异度,各动态增强参数ROC曲线结果见表4。不同定量参数值均具有一定的诊断效能,Ktrans、Kep、Ve值的AUC分别为0.821、0.772、0.830,当Ktrans值为0.084/min时,诊断敏感度为73.1%,特异度为85.7%;当Kep值为0.388/min时,诊断敏感度为69.2%,特异度为84.3%;当Ve值为0.253时,诊断敏感度为69.2%,特异度为100.0%,见图5。

表4 Ktrans、Kep、Ve值诊断小细胞肺癌与非小细胞肺癌比较
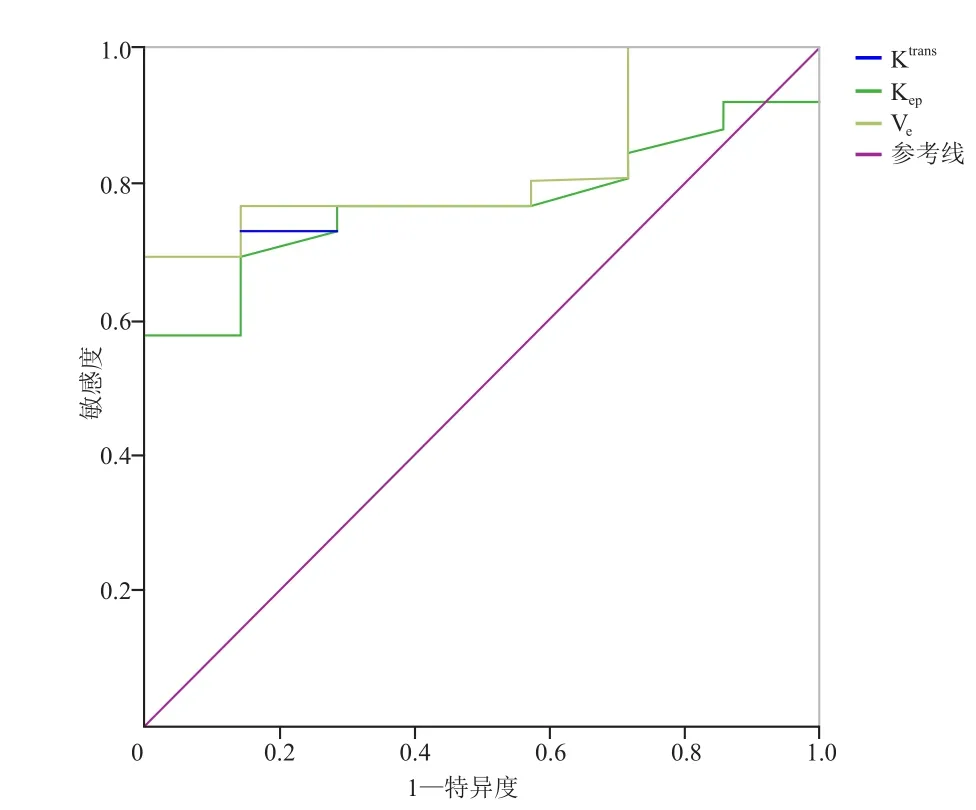
图5 Ktrans、Kep、Ve值诊断小细胞癌与非小细胞癌ROC曲线
3 讨论
3.1DCE-MRI成像原理及参数分析DCE-MRI是通过采用小分子顺磁性对比剂注入静脉后导致组织T1时间缩短,通过快速、动态监测被检查部位组织不同时间的图像数据,检测对比剂到达组织前后组织T1弛豫时间变化规律,间接获得受检组织血液动力学、渗透性等功能变化信息[6-8],DCE-MRI通过基于TIC曲线获得一组血液动力学半定量参数,分析组织的灌注、强化特征,常用半定量参数[9]包括正性增强积分、最大上升斜率、最大下降斜率、信号增强比率、达峰时间等。DCE-MRI也可通过Tofts双室模型计算出定量血流动力学参数,包括Ktrans、Kep、Ve(0 3.2DCE-MRI定量及半定量成像对肺癌的鉴别诊断价值DCE-MRI在临床应用越来越广泛,但由于受到呼吸、运动等方面伪影干扰,其在肺部的研究相对较少。王珍等[18]利用DCE-MRI的血流动力学双室模型渗透性参数联合ADC对肺部良恶性肿瘤进行鉴别诊断,发现DCE-MRI定量分析微血管渗透性参数Ktrans、Kep联合ADC值对肺部良恶性病变诊断效能高于CT,而且实现了定量分析鉴别诊断肺部结节良恶性。Zhang等[19]通过PET/CT与DCE-MRI对肿瘤血管密度与糖代谢相关性研究发现,鳞癌与腺癌肿瘤血管密度及糖代谢均不同,鳞癌的SUV值低于腺癌且差异有统计学意义,鳞癌肿瘤血管密度与糖代谢呈负相关,而腺癌肿瘤血管密度与糖代谢无相关性;同时通过DCE-MRI测得腺癌与鳞癌血流动力学参数,发现Ktrans值在腺癌比鳞癌高且差异有统计学意义(P<0.05)。本研究腺癌Ktrans、Kep值高于鳞癌,差异有统计学意义(P<0.05),非小细胞癌Ktrans、Kep、Ve值均高于小细胞癌,差异有统计学意义(P<0.05),与上述研究结果基本一致,提示定量增强参数Ktrans、Kep、Ve对鳞癌与腺癌的诊断有重要价值,推测其定量增强参数差异是由不同病理类型肺癌微血管密度与细胞密度之间的差异所致。Shibusa等[20]对44例腺癌与鳞癌的MVD与血管内皮生长因子比较发现,腺癌的MVD和血管内皮生长因子的阳性率明显高于鳞癌,且血管内皮生长因子阳性肿瘤的MVD也明显高于MVD阴性肿瘤。邹煜等[21]研究肺癌DCE-MRI增强模式与肿瘤血管生成的关系发现,48例肺癌微血管密度均数为(56.07±22.61)条/0.74 mm2,其中鳞癌为(44.41±16.28)条/0.74 mm2,腺癌为(69.86±21.47)条/0.74 mm2,腺癌MVD计数与鳞癌比较有显著差异(P<0.01)。由于腺癌与鳞癌组织病理学参数MVD差异,进而导致腺癌与鳞癌Ktrans及Kep值的差异。本研究结果显示,腺癌Ve值高于鳞癌,差异有统计学意义(P<0.05)。Ve值主要反映肿瘤细胞排列构成及肿瘤恶性生长速度[22],在组织病理学上,腺癌在生长方式主要表现为肿瘤细胞沿肺泡壁生长替代柱状上皮细胞,鳞癌主要表现为肿瘤细胞压缩式增殖和非替代性侵犯[22],而小细胞癌通常由小圆形或卵圆形的癌细胞组成,类似淋巴细胞,分布广泛,细胞密集程度高,细胞外空间相对较小[23]。生长方式的差异导致3种病理类型肺癌细胞构成的差异,进而表现在Ve值的差异,提示通过DCE-MRI定量参数测量不同肺癌病理类型有一定的诊断价值。但本研究鳞癌与小细胞肺癌定量参数差异无统计学意义(P>0.05),可能与选择病例数偏少、肺部磁敏感伪影、心脏搏动、膈肌运动及数据测量时选择AFI血流动力学模型测量时误差有关。 此外,本研究不同病理类型DCE-MRI半定量TIC曲线以流出型为主,部分肿瘤TIC曲线呈平台型或流入型,不同病理类型肺癌间有一定的交叉重叠,提示DCE-MRI半定量TIC曲线在不同肺癌病理类型的鉴别诊断中有一定限制。任进军等[24]研究DCE-MRI半定量曲线类型对孤立性肺结节的诊断价值,发现良、恶性孤立性肺结节曲线无显著差异,初步说明动态增强半定量曲线在肺癌鉴别诊断中有一定限度,可能与半定量分析存在计算简单、测量重复性差、参数解释不同等相关。同时样本量较小也有一定影响,但进一步证实仍需多中心大样本的研究。 本研究通过采用ROC曲线对比分析显示,Ktrans、Kep及Ve值对鉴别非小细胞肺癌与小细胞肺癌均具有较高的诊断效能,通过最大约登指数计算最佳诊断阈值,当Ktrans、Kep、Ve阈值分别设为0.082/min、0.388/min、0.253时,Ktrans诊断敏感度略高于Kep、Ve,而Ve特异度略高于Ktrans、Kep。 3.3本研究的局限性本研究样本总数相对偏少,可能对结果造成一定程度的影响;患者呼吸运动、膈肌运动、心脏搏动在一定程度上影响ROI内血流灌注及AFI曲线拟合,从而影响测量值的准确性;选择动脉输入函数较困难,药代动力学模型的引入与参数的拟合均使研究结果存在不可避免的误差。 总之,DCE-MRI能无创地反映不同病理类型肺癌组织血流动力学差异,并对不同病理类型肺癌进行鉴别诊断,对临床治疗方案选择及疗效评价具有重要指导意义。 参考文献 [1]Jayia PK, Mishra PK, Shah RR, et al. Preoperative assessment of lung cancer patients: evaluating guideline compliance (reaudit). Asian Cardiovasc Thorac Ann, 2015, 23(3): 299-301. [2]陈月洁, 夏爽, 邹艳君, 等. 定量动态增强MRI对泪腺恶性上皮性肿瘤及多形性腺瘤的诊断价值. 磁共振成像, 2015, 6(2): 115-119. [3]马晓玲, 周舒畅, 夏黎明. 动态增强MRI在孤立性肺结节鉴别诊断中的应用. 磁共振成像, 2015, 6(2): 125-130. [4]Schaefer JV, Vollmar J. Solitary pulmonary nodules: association between signal characteristics in dynamic contrast enhanced MRI and tumor angiogenesis. Lung Cancer, 2006, 53(1): 39-49. [5]Travis WD, Brambilla E, Muller-Hermelink HK, et al. Pathologyand genetics tumour of the lung, pleura, thymus and heart. 3rd ed. Lyon: Iarc Press, 2004. [6]Ellis LM, Hicklin DJ. VEGF-targeted therapy: mechanisms of anti-tumour activity. Nat Rev Cancer, 2008, 8(8): 579-591. [7]Dvorak HF. Vascular permeability factor/vascular endothelialgrowth factor: a critical cytokine intumor angiogenesis and a potential target for diagnosis and therapy. J Clin Oncol, 2002, 20(21): 4368-4380. [8]Khalifa F, Soliman A, El-Baz A, et al. Models and methods for analyzing DCE-MRI: a review. Med Phys, 2014, 41(12): e124301. [9]余小多, 林蒙, 安菊生, 等. DCE-MRI对宫颈鳞癌同步放化疗疗效的预测研究. 放射学实践, 2014, 29(2): 131-135. [10]Jain RK. Normalization of tumor vasculature: an emerging concept in antiangiogenic therapy. Science, 2005, 307(576): 58-62. [11]Jain RK. Molecular regulation of vessel maturation. Nat Med, 2003, 9(6): 685-693. [12]Cao Y, Nagesh V, Hamstra D, et al. The extent and severity of vascular leakage as evidence of tumor aggressiveness in highgrade gliomas. Cancer Res, 2006, 66(17): 8912-8917. [13]Buckley DL. Uncertainty in the analysis of tracer kinetics using dynamic contrast-enhanced T1-weighted MRI. Magn Reson Med, 2002, 47(3): 601-606. [14]Orth RC, Bankson J, Price R, et al. Comparison of single-and dual-tracer pharmacokinetic modling of dynamic contrastenhanced MRI data using low, medium, and high molecular weight contrast agents. Magn Reson Med, 2007, 58(4): 705-716. [15]宋媛, 丁爽, 贾文霄. DCE-MRI评价肿瘤血管生成的实验研究. 放射学实践, 2014, 29(6): 640-643. [16]Sourbron SP, Buckley DL. Classic models for dynamic contrast-enhanced MRI. NMR Biomed, 2013, 26(8, SI): 1004-1027. [17]Choi HS, Kim AH, Ahn SS, et al. Glioma grading capability: comparisons among parameters from dynamic contrastenhanced MRI and ADC value on DWI. Korean J Radiol, 2013, 14(3): 487-492. [18]王珍, 邱晓明, 徐潇, 等. DCE-MRI定量渗透性参数联合ADC值在肺部良恶性病变中鉴别诊断价值. 磁共振成像, 2015, 6(8): 585-591. [19]Zhang J, Chen L, Chen Y, et al. Tumor vascularity and glucose metabolism correlated in adenocarcinoma, but not in squamous cell carcinoma of the lung. PLoS One, 2014, 9(3): e91649. [20]Shibusa T, Shijubo N, Abe S. Tumor angiogenesis and vascular endothelial growth factor expression in stage I lung adenocarcinoma. Clin Cancer Res, 1998, 4(6): 1483-1487. [21]邹煜, 张敏鸣, 王丽君, 等. 肺癌MRI动态增强模式与肿瘤血管生成的相关性研究. 中华放射学杂志, 2003, 37(12): 1150-1155. [22]Noworolski SM, Vigneron DB, Chen AP. Dynamic contrastenhanced MRI and MR diffusion imaging to distinguish between glandular and stromal prostatic tissues. Magn Reson Imaging, 2008, 26(8): 1071-1080. [23]Humphries PD, Sebire NJ, Siegel MJ, et al. Tumors in pediatric patients at diffusion-weighted MR imaging: apparent diffusion coefficient and tumor cellularity. Radiology, 2007, 245(3): 848-854. [24]任进军, 赵宝宏, 訾学荣, 等. 磁共振DCE和DWI联合评价孤立性肺结节的临床意义. 中国临床医学影像杂志, 2015, 26(8): 574-576, 580. (本文编辑冯婕) Chinese Journal of Medical Imaging 2016 Volume 24(2): 100-105 Dynamic Contrast-enhanced MRI in Diagnosis of Different Histopathological Types of Lung Carcinoma 【Abstract】Purpose To investigate the imaging features of lung carcinomas using dynamic contrast enhanced MRI (DCE-MRI), and to explore the quantitative parameters and the characteristics of time intensity curve (TIC) types in differentiating histopathological subtypes in lung carcinomas. Materials and Methods Thirty-three patients with different subtypes of lung carcinomas were selected. All patients received MRI and DCE-MRI examinations. The Ktrans, Veand Kepvalues were calculated. The curve types of TIC were analyzed. The area under the curve (AUC) was computed using the receiver operating characteristic (ROC) curve, and the differential diagnostic efficacies of Ktrans, Kep, Vevalues on small cell lung carcinomas and non-small carcinomas were analyzed. The optimal diagnostic threshold was determined. Results ①There were 18 cases of adenocarcinoma, 8 squamous cell carcinomas, and 7 cases of small cell lung carcinomas, of which 12 were centrally located, 21 were peripherally located. The tumor size was 1.3-6.6 cm. The tumor was irregular, lobulated or patchy in 12 cases, nodular in 6 cases, and masslike in 15 cases. In 26 cases the boundary was not circumscribed. ②The types of TIC included washout curve in 14 cases of adenocarcinomas, plateau in 3 cases and wash-in in 1 case. The TIC in squamous cell carcinomas was washout curve in all 8 patients. The TIC curve in the 5 cases of small cell carcinomas was washout type, and plateau type in 2 cases. ③The Ktrans, Kep, and Vevalues of the different pathological types of lung carcinomas were significantly different (P<0.05); the Ktrans, Kep, Vevalues of adenocarcinomas were higher than squamous cell carcinomas and small cell carcinomas (P<0.05); the Ktrans, Kep, Vevalues of non-small cell carcinomas were higher than small cell carcinomas (P<0.05, P<0.01). ④The Ktrans, Kep, Vevalues had better differential diagnosis accuracy to differentiate small cell lung carcinomas and non-small cell carcinomas, with AUC values of 0.821, 0.772 and 0.830, respectively. When the threshold of Ktrans, Kep, Vevalues were 0.082/min, 0.388/min and 0.253, the sensitivity and specificity were 73.1%, 69.2%, 69.2% and 85.7%, 84.3%, 100.0%, respectively. Conclusion The quantitative parameters on DCE-MRI can accurately diagnose different type of lung carcinomas to help selecting treatments. 【Key words】Lung neoplasms; Magnetic resonance imaging; Image enhancement; Pathology, surgical 收稿日期:2015-08-28 中图分类号R445.3;R734 基金项目 通讯作者马明平 Doi:10.3969/j.issn.1005-5185.2016.02.005

