HbA1c水平对2型糖尿病患者红细胞及胞内血红蛋白的影响*
叶少英, 阮 萍, 雍军光, 沈洪涛, 廖志红, 董晓蕾
(1广东药学院劳动卫生与环境卫生学系,广东 广州 510315; 2广东药学院生物医学工程系,广东 广州 510310; 3广东药学院附属门诊部内分泌科,广东 广州 510235; 4广西师范大学物理科学与技术学院,广西 桂林 541001; 5中山大学附属第一医院内分泌科,广东 广州 510080)
HbA1c水平对2型糖尿病患者红细胞及胞内血红蛋白的影响*
叶少英1,阮萍2△,雍军光3,沈洪涛4,廖志红5,董晓蕾1
(1广东药学院劳动卫生与环境卫生学系,广东 广州 510315;2广东药学院生物医学工程系,广东 广州 510310;3广东药学院附属门诊部内分泌科,广东 广州 510235;4广西师范大学物理科学与技术学院,广西 桂林 541001;5中山大学附属第一医院内分泌科,广东 广州 510080)
[摘要]目的: 探讨不同糖化血红蛋白(HbA1c)水平对2型糖尿病(T2DM)患者红细胞及胞内血红蛋白(Hb)的影响。方法:选取健康人30名为对照组(H组),T2DM患者102例,按HbA1c水平分为3组:血糖控制良好组(A组)30例(HbA1c <7.0%);血糖控制较差组(B组)36例(7.0%≤HbA1c<9.0%);持续高血糖组(C组)36例(HbA1c≥9.0%)。利用新型静态显微图像分析技术和紫外-可见光谱技术,对各组红细胞及胞内Hb进行检测。结果:与H组比较,A、B、C组红细胞的圆度因子明显增大(P<0.05)且与HbA1c水平呈正相关;B组红细胞的截面积和C组红细胞的全部形态参数均较H组明显增大(P<0.05);A、B、C组,除A、B组间红细胞长短轴参数无显著差异,其它组间参数比较差异有统计学显著性。与H组比较,A、B、C组Hb的紫外-可见光谱的谱型和谱峰未出现明显差异,但B、C组Hb的吸光度较H组明显下降(P<0.01),且C组Hb的吸光度也明显低于A组(P<0.05),随HbA1c水平的升高呈逐渐下降趋势。结论:随HbA1c水平的升高,T2DM患者红细胞的形态发生改变,变形功能逐渐减弱,胞内Hb的结构可能发生改变。
[关键词]HbA1c; 红细胞; 血红蛋白; 2型糖尿病
2型糖尿病(type 2 diabetes mellitus,T2DM)是一类病因尚未明确的非胰岛素依赖型的终身性疾病,可引发严重并发症,已成为继癌症和冠心病之后的又一严重威胁人类健康的全球性疾病[1]。糖化血红蛋白(glycosylated hemoglobin type A1c,HbA1c)是评价患者血糖控制情况、疗效判定和预测并发症的重要指标。已有研究表明,HbA1c水平升高加重了糖尿病患者体内的氧化应激[2],增加了全血黏度和血小板的聚集[3],与糖尿病多种并发症的发生发展密切相关,是糖尿病发病机制的重要影响因素。
T2DM是多病因所致的内分泌疾病,从血液循环系统入手研究其发病机制具有重要意义。红细胞是人体重要的循环细胞,主要承担人体内O2和CO2的运输,这一功能的正常发挥取决于红细胞的形态以及胞内血红蛋白(hemoglobin,Hb)的结构和功能。已有研究报道,温度、pH值、渗透压等生存环境的改变可引起红细胞形态、变形性以及Hb结构改变,导致红细胞和Hb的功能受损,生理活性降低[4-6]。这些改变都会引起微血管的血液流变学改变,引发微循环障碍。T2DM患者的高血糖改变了正常的血液环境,可能影响红细胞和Hb的结构及功能,但当前仍缺少HbA1c水平对单个红细胞的具体形态、变形性以及胞内Hb影响的分析。
本研究利用新型显微静态图像分析技术对健康人和不同HbA1c水平的T2DM患者的单个活态红细胞的形态进行观察和测量,同时结合紫外-可见光谱技术对红细胞内的Hb进行检测分析,探讨HbA1c水平对T2DM患者红细胞及胞内Hb的影响。
材料和方法
1研究对象
选取2015年1~7月期间于中山大学附属第一医院体检的健康人为对照组,内分泌科住院的T2DM患者为病例组。其中,健康人30名(H组;男15例,女15例),确诊T2DM患者102例,均以黄脲类联合双胍类治疗,如血糖控制不佳者改为胰岛素强化治疗,按其HbA1c水平分为3组:血糖控制良好组(A组)30例(HbA1c<7.0%;男15例,女15例);血糖控制较差组(B组)36例(7.0%≤HbA1c<9.0%;男18例,女18例);持续高血糖组(C组)36例(HbA1c≥9.0%;男20例,女16例)。上述研究对象的性别、年龄无显著差异。入选标准:(1)符合1999年WHO糖尿病诊断标准;(2)无急慢性糖尿病并发症;(3)无恶性肿瘤、严重感染等疾病,无心、脑、肾等重要器官并发症及消化系统疾病;(4)无贫血等血液系统疾病,近1个月内未使用抗生素免疫抑制剂、抗血小板凝集类药物。
2方法
2.1样本采集与临床指标测定所有研究对象均禁食8 h,次晨空腹抽取静脉血3 mL,EDTA-K2抗凝,测定空腹血糖(fasting plasma glucose,FPG)和HbA1c。FPG采用葡萄糖氧化酶法,HbA1c采用高效液相法。记录研究对象的性别、年龄,测量其身高、体重,计算体重指数(body mass index,BMI)。
2.2红细胞形态测定1 mL全血2 000 r/min离心5 min,除上层血浆,血小板及白细胞,余压积红细胞。以等渗PBS[6]混匀红细胞,2 000 r/min离心5 min,重复洗涤3次,至上清液澄清透明。以1∶1 000抽取洗涤后压积红细胞与含5%小牛血清白蛋白的PBS (pH 7.4)配制红细胞悬液,用于检测红细胞静态形态。将制好的红细胞悬液置于Nikon TS100-F倒置显微镜下,利用自主研发的新型显微成像系统[7]观察和拍摄红细胞的静态图像,结合显微图像分析技术和Image-Pro Plus 6.0专业分析软件对每个红细胞的接触面积、长短轴以及圆度因子(roundness effect factor,REF)等几何参数进行测量分析。每个样本测量50~80个细胞。
2.3胞内Hb光谱测定取1.5 mL抗凝全血,2 000 r/min离心10 min,除上层血浆、血小板及白细胞。压积红细胞以10倍体积预冷的0.9% NaCl溶液混匀,3 500 r/min离心5 min,除上清,重复洗涤3次。以10倍体积预冷蒸馏水振动裂解红细胞,置4 ℃冰箱过夜,充分释放胞内Hb。次日4 ℃、12 000 r/min离心45 min,抽取上层Hb粗提液,0.22 μm一次性滤膜过滤后以葡聚糖G-75凝胶柱纯化,收集洗脱液,并以SDS-PAGE进行Hb纯度鉴定,纯度达到95%以上,Hb透析除盐浓缩后置于4 ℃保存。
取100 μL纯化Hb溶液,以2 mL去离子水稀释,待测。采用岛津UV-3010型紫外-可见光谱仪,扫描范围190~800 nm,波长精度±0.1 nm,测定各样本的紫外-可见吸收光谱,每个样本重复测定3次,取其均值图谱分析。
3统计学处理
数据采用SPSS 19.0软件进行统计学分析,所有数据均进行正态性检验,不符合正态分布的参数进行秩和检验,符合正态分布的参数统一以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,组间两两比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
结果
1各组临床资料比较
健康对照组H与病例组A、B、C的年龄、性别差异无统计学显著性,与H组相比,B、C组的BMI明显升高,差异有统计学显著性(P<0.05)。与H组相比,A、B、C组的FPG以及HbA1c水平明显增高(P<0.05);与A组相比,B、C组的FPG以及HbA1c水平明显升高(P<0.05);C组FPG以及HbA1c水平均较A、B组明显升高(P<0.05),见表1。

表1 4组病人的一般临床资料比较
*P<0.05vsgroup H;#P<0.05vsgroup A;△P<0.05vsgroup B.
2各组红细胞形态参数比较
红细胞的接触面积、长轴、短轴和REF是描述红细胞形态的指标,表2为H组与A、B、C组的红细胞形态参数分析结果。由表1可知,T2DM患者的红细胞形态参数均随HbA1c水平升高逐渐增大。A组红细胞的接触面积、长轴和短轴与H组比较差异无统计学显著性;B组红细胞除接触面积明显大于H组外,其长短轴参数与H组比较差异无统计学显著性;C组红细胞的全部形态参数均明显大于H组(P<0.05)。A、B、C组,除A、B组间红细胞长短轴参数的差异无统计学显著性外,其它参数的组间比较差异有统计学显著性(P<0.05)。与H组相比,A、B、C组的REF均明显增大(P<0.05),且A、B、C组间差异有统计学显著性(P<0.05),随HbA1c水平的升高逐渐增大。
3T2DM患者HbA1c水平与红细胞REF相关性分析
REF是衡量红细胞变形性的重要参数,其值在0~1之间,与红细胞的变形能力呈负相关,REF越小表明红细胞的变形能力越好,若REF趋近于1,表明红细胞趋近于圆球形,刚性越大。为进一步分析HbA1c水平对T2DM患者红细胞变形能力的影响,对患者的HbA1c水平与红细胞REF描绘散点图并进行直线相关分析,结果表明患者的REF与HbA1c水平呈正相关(r2=0.657,P<0.01),见图1。
4各组Hb紫外-可见光谱比较
以H组Hb的平均紫外-可见光谱为对照,与A、B、C组Hb的平均光谱进行对比分析。Hb的紫外-可见吸收光谱主要有5个吸收峰,其中414 nm归属于血红素的特征吸收峰,540 nm和576 nm分别为氧合血红蛋白(HbO2)的α和β吸收峰,可反映Hb的携氧能力,因此本文主要针对这3个吸收峰进行分析。4组Hb吸收光谱的谱型、谱峰相似,无显著差异,但各组Hb的吸光度差异显著。因此,对4组Hb的414 nm、540 nm以及576 nm的吸光度值进行比较显示,A组与H组Hb的吸光度差异无统计学显著性,但B、C组Hb的吸光度均较H组明显下降(P<0.01);与A组相比,B组Hb的吸光度降低,但差异无统计学显著性,C组Hb的吸光度较A组明显降低(P<0.05),A、B、C组Hb的吸光度呈现随HbA1c水平的升高而逐渐下降的趋势,见图2。
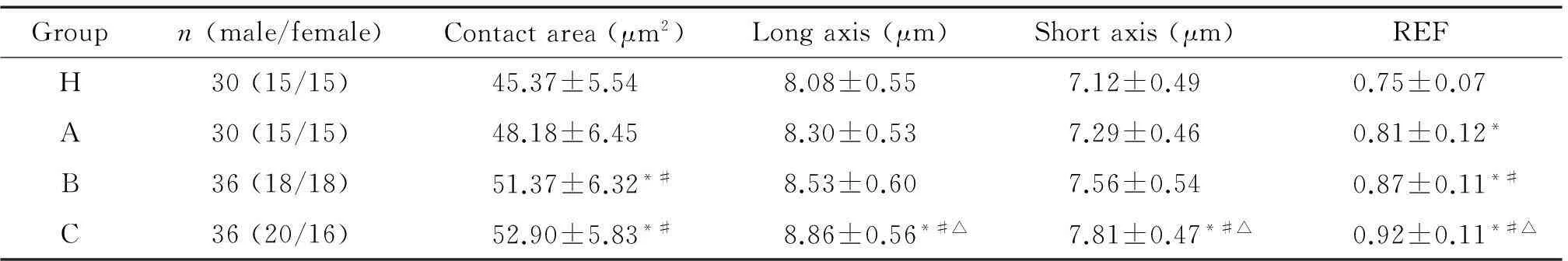
表2 4组红细胞的形态参数比较
REF: roundness effect factor.*P<0.05vsgroup H;#P<0.05vsgroup A;△P<0.05vsgroup B.
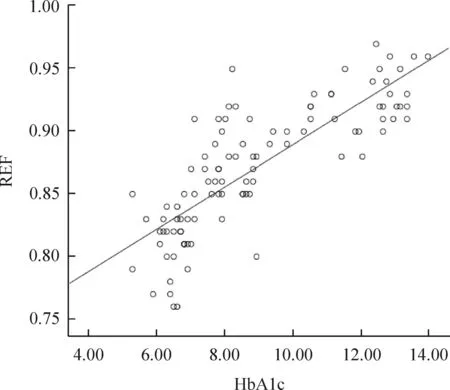
Figure 1.The scatter plot of HbA1c level and the roundness effect factor (REF) of the erythrocytes.
图1HbA1c水平与红细胞圆度因子的散点图
讨论
T2DM是以慢性高血糖为主要特征,伴有糖、脂肪、蛋白质等代谢紊乱的内分泌疾病。随病程的发展,患者的毛细血管基底膜增厚,微血管管腔狭窄导致微循环障碍,引发微血管病变等慢性并发症[8]。HbA1c与患者血糖水平呈正相关,可良好地反映患者近8~12周的平均血糖水平,是糖尿病长期控制情况的指标之一。红细胞变形能力和生理功能的正常发挥是保证微循环有效灌注的重要条件,也是从血液流变学角度探讨T2DM及其并发症发生发展机理和预防的重要手段和客观指标,其中红细胞的形态和胞内Hb结构是影响红细胞变形能力和功能的重要因素[9]。红细胞的形态、大小对其变形能力有反作用,红细胞的直径和表面积越大,红细胞的变形能力越低。实验结果表明,A、B、C病例组红细胞的截面积和长短轴均大于对照组H,提示T2DM患者红细胞的形态和变形能力可能已受损。A、B、C组红细胞的截面积、长短轴逐渐增大且组间差异显著,表明HbA1c水平的升高,可能影响红细胞的形态变化。由于T2DM患者长期血糖控制不良易导致HbA1c水平升高,高血糖环境的作用可能使红细胞的截面积和直径均增大,形态大小改变,从而降低红细胞的变形性。REF为红细胞的长短轴之比,REF高表示红细胞变形能力下降,A、B、C组红细胞的REF均显著大于H组,提示T2DM患者的红细胞已从双凹形结构逐渐转化为近球型[9],红细胞变形能力降低。进一步分析T2DM患者HbA1c水平与REF的关系,结果表明两者呈正相关,提示HbA1c水平的升高,高血糖可能与红细胞膜蛋白产生糖基化作用[10],使红细胞膜的成分和结构改变,导致红细胞膜流动性减弱、刚性增大,促使红细胞趋近圆球型结构,从而降低红细胞的变形能力,与相关研究结论相符[11]。
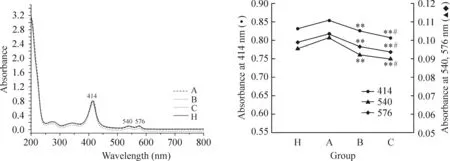
Figure 2.The average ultraviolet-visible spectra of the normal Hb (H) and the Hb of the T2DM patients (A, B and C), and the absorbance change at 414 nm, 540 nm and 576 nm in different groups.**P<0.01vsgroup H;#P<0.05vsgroup A.
图2各组Hb的紫外-可见吸收光谱以及在414 nm、540 nm和576 nm处吸光度值
Hb吸收峰的高度不仅与红细胞内Hb溶液浓度的高低有关,而且还与Hb的理化性质(如溶解性、稳定性和氧化状态等)有关[6]。结果表明,A组Hb的紫外-可见吸收光谱与H组相似,未出现显著差异,但B、C组Hb的吸光度均显著低于H组,提示T2DM患者的Hb可能发生改变。A、B、C组Hb的血红素和HbO2的吸光度随HbA1c水平升高逐渐降低,且A、C组间差异显著。Hb是红细胞的重要内容物,红细胞的内黏度对红细胞的变形能力有反作用。实验结果提示,HbA1c水平的升高,T2DM患者的高血糖状态可使葡萄糖渗入到红细胞内部,使红细胞内的Hb发生非酶糖化,Hb发生聚集,可溶性降低,致使红细胞的内黏度增大,红细胞变形能力下降。高血糖可能也加速了患者体内的糖基化反应,Kristinsson等[12]研究表明蛋白糖基化反应可降低血液环境的pH,引起Hb结构稳定性下降,Hb的血红素环发生位移或降解[13],影响Hb的结构,降低Hb与氧的亲和力,减弱Hb携氧运氧的功能,使周围组织供氧不足,这可能是造成糖尿病慢性并发症的重要原因之一[14]。此外,持续高血糖也可能加剧患者体内的氧化应激,导致自由基等氧化应激产物增加,可能引起Hb结构改变,影响Hb的生理功能[15],致使HbO2含量减少,加速糖尿病并发症的发生发展。
实验结果表明,T2DM患者红细胞的变形能力随HbA1c水平的升高逐渐降低,Hb的结构也可能改变,提示HbA1c水平可能是造成T2DM患者红细胞变形能力降低的重要因素,患者的血脂异常等其它因素也可能起协同作用使红细胞变形能力进一步降低。红细胞变形能力降低和胞内Hb结构改变,可使红细胞僵硬难以通过微血管,引起微循环障碍,使周围血管的血流量减少,红细胞携氧释氧的能力降低,加重周围组织缺血缺氧,促进糖尿病高黏血症、糖尿病肾病、糖尿病视网膜病变等并发症的发生发展。严格控制患者的HbA1c水平,早期注重改善患者红细胞的变形能力及预防胞内Hb结构和功能的改变,将有助于提高2型糖尿病的疗效,预防糖尿病并发症的发生发展。
[参考文献]
[1]DeFronzo RA, Banerji Ma, Bray GA, et al. Determinants of glucose tolerance in impaired glucose at baseline in the Actos Now for Prevention of Diabetes (ACT NOW) study[J]. Diabetologia, 2010, 53(3):435-445.
[2]Monnier L, Colette C, Mas E, et al. Regulation of oxidative stress by glycaemic control: evidence for an independent inhibitory effect of insulin therapy[J]. Diabetologia, 2010, 53(3):562-571.
[3]Xu D, Kaliviotis E, Munjiza A, et al. Large scale simulation of red blood cell aggregation in shear flows[J]. J Biomech, 2013, 46(11):1810-1817.
[4]Jandaruang J, Siritapetawee J, Thumanu K, et al. The effects of temperature and pH on secondary structure and antioxidant activity ofCrocodylussiamensishemoglobin[J]. Protein J, 2012, 31(1):43-50.
[5]Yan YB, Wang Q, He HW, et al. Protein thermal aggregation involves distinct regions: sequential events in the heat-induced unfolding and aggregation of hemoglobin[J]. Biophys J, 2004, 86(3):1682-1690.
[6]姚成灿,黄耀熊,李校坤,等. pH 值对红细胞膜力学特性和胞内蛋白结构与功能的影响[J]. 科学通报,2003, 48(10):1050-1053.
[7]Ruan P, Yong LG, Sheng HT, et al. Monitoring dynamic reactions of red blood cells to UHF electromagnetic waves radiations using a novel micro-imaging technology[J]. Electromagn Biol Med, 2012, 31(4):365-374.
[8]Fowler MJ. Microvascular and macrovascular complications of diabetes[J]. Clin Diabetes, 2008, 26(2):77-82.
[9]郝希平,岳粮跃,雷健明,等. 冠心病危重病人红细胞流变特性和血红蛋白结构的研究[J]. 中国病理生理杂志,2012, 28(5):937-940, 943.
[10]Mahmoud SS. The impact of elevated blood glycemic level of patients with type 2 diabetes mellitus on the erythrocyte membrane: FTIR Study[J]. Cell Biochem Biophys, 2010, 58(1):45-51.
[11]王丽娜,周慧敏,穆立芹,等. 2 型糖尿病患者糖化血红蛋白水平与红细胞变形能力的相关性研究[J]. 中国血液流变学杂志, 2011, 21(3):431-433.
[12]Kristinsson HG. Acid-induced unfolding of flounder hemoglobin: evidence for a molten globular state with enhanced pro-oxidative activity[J]. J Agric Food Chem, 2002, 50(26):7669-7676.
[13]Goodarzi M, Moosavi-Movahedi AA, Habibi-Rezaei M, et al. Hemoglobin fructation promotes heme degradation through the generation of endogenous reactive oxygen species[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2014, 130:561-567.
[14]Chalew SA, McCarter RJ, Hempe JM. Biological variation and hemoglobin A1c: relevance to diabetes management and complications[J]. Pediatr Diabetes, 2013, 14(6):391-398.
[15]Banerjee S, Chakraborti AS. Structural alterations of hemoglobin and myoglobin by glyoxal: a comparative study[J]. Int J Biol Macromol, 2014, 66: 311-318.
(责任编辑: 陈妙玲, 罗森)
Effect of HbA1c level on erythrocytes and hemoglobin in type 2 diabetics
YE Shao-ying1, RUAN Ping2, YONG Jun-guang3, SHEN Hong-tao4, LIAO Zhi-hong5, DONG Xiao-lei1
(1DepartmentofOccupationalandEnvironmentalHealth,GuangdongPharmaceuticalUniversity,Guangzhou510315,China;2DepartmentofBiomedicalEngineering,GuangdongPharmaceuticalUniversity,Guangzhou510310,China;3DepartmentofEndocrinology,TheAffiliatedOutpatientDepartmentofGuangdongPharmaceuticalUniversity,Guangzhou510235,China;4CollegeofPhysicsandTechnology,GuangxiNormalUniversity,Guilin541001,China;5DepartmentofEndocrinologyofTheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail: 326737727@qq.com)
[ABSTRACT]AIM: To explore the effect of HbA1c level in the patients with type 2 diabetes mellitus (T2DM) on the rheological properties of erythrocytes and the structure of hemoglobin (Hb). METHODS: The patients with T2DM were classified into 3 groups: the patients with good glycaemic control (group A, HbA1c<7.0%), the patients with poor glycaemic control (group B, 7.0%≤HbA1c<9.0%) and the patients with persistent hyperglycemia (group C, HbA1c≥9.0%). The rheological properties of a single living erythrocyte were analyzed by the techniques of static imaging and analysis. Ultraviolet-visible spectroscopy was used to study the structure of Hb. RESULTS: Compared with group H, the roundness effect factor (REF) of erythrocytes, which was positively related with HbA1c level, was significantly increased in groups A, B and C (P<0.05). The contact area of erythrocytes in group B and all the morphological parameters of erythrocytes in group C were significantly higher than those in group H (P<0.05). There were significant differences among groups A, B and C in deformation capacity and elastic parameters of the cell membrane (P<0.05), but with no difference in the long axis and short axis between group A and group B. Compared with group H, no obvious change in the spectral pattern and spectrum peak of Hb in groups A, B and C was observed. However, the absorbance of Hb, which showed a trend of gradual decline with the increase in HbA1c level, in group B and group C was significantly decreased as compared with group H (P<0.01), and the Hb absorbance in group C were also lower than that in group A (P<0.05). CONCLUSION: With the increase in HbA1c level, the morphology along with the deformation function of erythrocytes in T2DM changes and declines gradually, and the structure of Hb may also change.
[KEY WORDS]HbA1c; Erythrocytes; Hemoglobin; Type 2 diabetes mellitus
doi:10.3969/j.issn.1000- 4718.2016.03.027
[中图分类号]R589.1; R363
[文献标志码]A
通讯作者△Tel: 020-39352207; E-mail: 326737727@qq.com
*[基金项目]广东省科技计划(No.2012B031800429; No.2014807);国家自然科学基金资助项目(No.11265005)
[收稿日期]2015- 11- 02[修回日期] 2015- 12- 29
[文章编号]1000- 4718(2016)03- 0549- 05
杂志网址: http://www.cjpp.net

