缺血后适应促进树鼩血栓性脑缺血时紧密连接occludin/ZO-1蛋白表达及抑制脑水肿的机制*
李树清, 李 凡, 何 亮, 何 波
(昆明医科大学基础医学院病理生理教研室, 云南 昆明 650050)
缺血后适应促进树鼩血栓性脑缺血时紧密连接occludin/ZO-1蛋白表达及抑制脑水肿的机制*
李树清△,李凡,何亮,何波
(昆明医科大学基础医学院病理生理教研室, 云南 昆明 650050)
[摘要]目的: 研究脑缺血及缺血后适应(postconditioning,PC)条件下,树鼩脑缺血时局部脑血流(regional cerebral blood flow,rCBF)、脑水肿及紧密连接(tight junction,TJ)的occludin和zonula occludins(ZO)-1蛋白表达的改变;探讨TJ表达对脑水肿及脑梗死的影响及其可能机制。方法: 将72只健康成年树鼩随机分为对照组、脑缺血组和脑缺血+PC组,其余3只动物用于磁共振成像(MRI)观察。通过光化学反应诱导树鼩局部血栓形成;缺血PC组于缺血后4 h夹闭患侧颈总动脉3次(每次5 min)实施PC处理。用电镜观察神经超微结构,用TUNEL法检测海马神经元的凋亡数量,用激光多普勒血流监测仪检测缺血区的rCBF,用免疫组化及Western blot法观察缺血海马occludin/ZO-1蛋白的表达,MRI技术监测脑梗死体积,组织干湿法检测脑含水量的改变。结果: 树鼩脑缺血后海马CA1区的正常神经元明显减少以及神经元超微结构明显异常。脑缺血组TUNEL阳性细胞数明显增加(P<0.01),rCBF明显降低,occludin/ZO-1表达减弱(P<0.01),脑含水量和脑梗死体积明显增加(P<0.01)。经PC处理的动物,缺血区rCBF增加,TJ表达增强,脑含水量降低,且TUNEL阳性细胞数和脑梗死体积明显减小(P<0.01)。结论: 缺血PC可增加树鼩缺血区rCBF但不增加局部含水量;提示缺血PC缩小脑梗死体积可能与occludin/ZO-1表达增强而抑制脑水肿有关。
[关键词]光化学反应; 脑缺血; 脑水肿; 后适应; 紧密连接蛋白; 磁共振成像; 树鼩
缺血性脑损伤是危害人类健康的主要疾病,也是国际脑保护研究所关注的重点领域。迄今脑保护研究多集中于采用各种神经保护剂的神经元保护上,而实际效果并不十分明显。近年的研究提示,非药物干预是一种可以快速而简便地使大脑免受缺血损伤的新举措,即缺血后适应(postconditioning,PC)。临床实践证明,缺血PC 技术简便,可通过止血带或膨胀的血压计袖带快速实施,还可使国内外倡导脑缺血治疗的6 h时间窗延至24 h。而“神经元-血管单元”概念的提出则为进一步阐明缺血PC在脑缺血非药物干预的病理生理机制提供了可供探索的广阔空间,这一全新的治疗策略将使长期以来以治标为主的神经元保护向标本兼治的血管保护迈出重要的一步[1-2]。研究表明,脑缺血时由于血管阻塞而导致局部脑血流(regional cerebral blood flow,rCBF)明显降低,血脑屏障(blood brain barrier,BBB)因此而严重受损;实施PC处理增加缺血区rCBF的同时是否促进或加剧脑水肿的发生发展,尚不明确。鉴于微血管紧密连接(tight junction,TJ)的occludin/zonula occludins (ZO)-1蛋白在维持BBB的正常及“神经元-血管单元”中具有重要作用,本文采用生物学特征与猕猴相近的树鼩复制血栓性脑缺血模型,在观察脑缺血改变的3项关键指标(rCBF、脑含水量及脑梗死体积)的基础上,用磁共振成像(magnetic resonance imaging,MRI)技术监测梗死范围,借以探讨缺血PC对occludin/ZO-1表达的影响及其脑保护的可能机制,为揭示脑缺血时“神经元-血管单元”的修复提供实验依据。
材料和方法
1实验动物和分组
健康成年树鼩72只,雌雄不拘,体重(120±20)g;随机分为假手术对照组(只手术而不做光化学反应);脑缺血组及缺血PC组。另取3只动物做MRI观察。
2主要实验仪器和试剂
SQ-Ⅲ型脑血栓形成装置(本室研制)[3]由光源(含滤波电路及触发器)、万能支架、数控光源、散热装置以及光学系统(包括干涉滤镜及聚光透镜)组成。光源中心波长(λ)560 nm, 带宽(Δλ)60 nm,光强度(1.0 W/cm2),用时间继电器控制照射时间。Nikon-MiVnt显微图像分析系统(Nikon); PeriFlux System 5000型双通道激光多普勒(laser Doppler,LD)血流测定仪、PF5010模块和接触式探头(Perimed);额定电压220~240 V,50~60 Hz,70 μA。探头最大输出功率 1 mW,波长780 nm;Leica RM2135石蜡切片机; HPIA-2000高清晰度病理图文分析系统(同济大学);YT-6B组织贴片机和YT-6B组织包埋机(湖北孝感亚光医用电子技术研究所);JEM-1011型电子显微镜(HITACHI)。
孟加拉红(Rose Bengal)为Fluka产品,以0.85%生理盐水溶解,浓度为1.5 g/L,避光4 ℃保存。鼠抗人occludin 抗体(Santa Cruz); ZO-1多克隆抗体(Invitrogen)。即用型免疫组化ElivisionTMPlus 广谱试剂盒、II抗即用型快速免疫组化MaxVisionTM试剂盒、过氧化物酶阻断剂、多聚赖氨酸、DAB显色液及PBS(0.01 mol/L,pH 7.4)均购自福州迈新生物技术开发有限公司;Tris-HCl抗原修复液购自云科生物工程公司,以蒸馏水溶解,浓度10 mmol/L,临用前0.5 mol/L HCl调整pH至10.0。
3方法
3.1树鼩脑缺血及缺血PC模型的建立参考本室方法[3]将树鼩用2.5% 硫喷妥钠麻醉(40 mg/kg),卧位固定动物并消毒皮肤,矢状切开右顶部皮肤约1 cm,暴露右侧颅骨,细心分离软组织以免损伤颅骨表面影响其透光性。于切口处嵌入一外径为1 cm×2.5 cm的消毒铜片,其中心含一直径为0.5 cm的窗孔,以便光束通过该窗孔直接照射于颅骨表面,铜片以外的组织用避光纸遮盖。至此,于实验组舌下静脉一次注入浓度为15 g/L的孟加拉红1.33 mL/kg体重,循环10 min;对照组注射等量NS。将树鼩置于SQ-Ⅲ型脑血栓形成实验装置下,立体定位,在光强度为1.0 W/cm2,颅骨表面温度(36±1)℃条件下照射10 min,照毕,缝合皮肤、保温待动物清醒后放回饲养笼观察。在上述局部脑缺血模型基础上建立脑缺血PC模型[3-4],于既定时点(4 h)前40 min再次麻醉动物、仰卧固定,分离缺血侧颈总动脉(保护迷走神经),以无创动脉夹在甲状软骨上缘平面夹闭颈总动脉5 min/再灌5 min,重复3次以复制缺血PC模型,同时检测rCBF的变化;24 h再次麻醉动物并检测有关指标。
3.2海马神经元的形态学观察光化学反应后4 h及24 h,将实验动物麻醉、断头取脑,肉眼直接观察光化学反应区脑皮层可见一直径约0.5 cm的缺血水肿区,其改变以缺血24 h为著。正常脑组织的TTC染色呈现红色,而梗死区则呈苍白色,界限较清晰;缺血PC组的梗死面积较缺血组的明显缩小,采用CAD制图软件测定梗死面积占半脑面积的百分比。脑缺血后24 h及缺血PC处理后24 h再次麻醉动物,开胸并剪开心包,自心尖部插入一聚乙烯管使其进入升主动脉并结扎固定;剪开右心耳,在120 mmHg压力下灌注10%甲醛200 mL行内固定2 h。将内固定的大脑开颅取出并用新配制的10%甲醛溶液再固定24 h,于视交叉后1.7~4.0 mm(海马齿状回互包平面)行冠状切片,取中间切块逐级脱水、透明、浸蜡,常规石蜡包埋制成蜡块标本进行常规HE染色用于光镜下观察;每组动物于规定时间麻醉,按上述方法用3.5%戊二醛内固定,小心开颅骨并取出缺血侧(右侧)海马置于3.5%戊二醛内保存,磷酸盐缓冲液冲洗后,丙酮酸逐级脱水,1%四氧锇酸固定24 h,LKBS型超薄切片机半薄切片定位,再作柠檬酸铅醋酸铀双染色,在JEM-1011型电子显微镜观察海马超微结构。
3.3TACS®原位凋亡检测(TUNEL法)室温条件下将蜡块标本连续切片(厚度5 μm),用多聚赖氨酸原液预处理的载玻片移至55 ℃恒温箱内4 ~ 6 h;依次置入100%、95%及70%乙醇溶液内洗片(每次5 min);再移入去离子水I、II内各2 min水化,分别在PBS及proteinase-K工作液室温孵育;去离子水洗切片2次;3% H2O2室温孵育、PBS冲洗后将切片移入1×TdT labeling buffer孵育5 min,加入labeling reaction mix工作液温育、PBS洗片2次,加入DAB工作液显色8 min,光镜下观察到细胞核染色满意时,用去离子水I、II终止显色,并用1.0%甲基绿溶液温育4 min进行核复染,常规脱水、透明、中性树胶封片。自然干燥、避光保存,以备观察。TUNEL阳性细胞数为细胞核表达棕黄色,高倍镜下(×400),在每张切片海马CA1区随机各选取3个视野,用0.1尺形目镜计数每mm线性长度TUNEL阳性细胞数,以每3个视野的平均值作为TUNEL阳性细胞的平均值。
3.4rCBF监测采用LD血流监测仪经颅测量rCBF。将麻醉的树鼩固定于立体定位仪上,以法兰克福平面(耳眼水平面)作为立体定位坐标系统的基础,于缺血PC后24 h用Perimed提供的Perisoft配套软件进行曲线输出记录,血流仪将采集信号转换成血流灌注单位(perfusion unit,PU)=CMBC(一定体积内细胞的分布率)×V(平均血细胞的移动速率),选取稳定记录血流曲线300 S,所有数据取平均值为rCBF。经仪器对接收光纤接收到的反射激光进行分析处理后并显示灌注量值即PU,PU是一个表示测量深度内大小的相对单位,PU值的变化直接反映了rCBF的改变。
3.5免疫组化和Western blot检测occludin/ZO-1蛋白表达采用MaxVision快捷法进行免组化染色。取上述脑组织石蜡切片常规烘烤、脱蜡及脱水待用。高压修复抗原,将水洗后的切片浸泡于0.01 mol/L的柠檬酸盐缓冲液(pH 6.0)中,在压力锅内加热至沸腾(10 min);将脱蜡水化后的组织切片置于耐高温染色架上,放入已沸腾的缓冲液内继续加热至工作温度和工作压力(喷汽)2 min后,压力锅离开热源数分钟,冲淋冷却蒸馏水冲洗2次。3% H2O2阻断内源性过氧化物酶,PBS冲洗3 min×3次,非免疫小牛血清封闭抗原(10 min),甩去血清,用PBS(pH 7.4)冲洗除去PBS液,每张切片加50 μL的第 I 抗体(1∶100稀释),4 ℃冰箱下孵育过夜。PBS冲洗5 min 3次除去PBS液,每张切片加50 μL酶标抗鼠/兔聚合物( II 抗),室温下孵育15 min。PBS冲洗,加50 μL新鲜配制的DAB液显色,显微镜下观察5 min。自来水冲洗,苏木素复染,用0.1% HCl分化,自来水冲洗返蓝。切片经梯度脱水干燥,二甲苯透明,中性树胶封固。用正常脑组织作对照,以PBS 代替 I 抗作为阴性对照。
取正常及缺血的海马组织行Western blot检测。用PBS冲洗组织,加入SDS(50 mmol/L Tris·HCl,pH 6.8,100 mmol/L二硫苏糖醇,2% SDS,0.1%溴酚蓝,10%甘油),沸水煮热10 min;室温下离心10 000 r/min 10 min,取上清夜,用醋酸纤维膜作为固相支持物进行蛋白质的电转移;用0.5%去脂奶粉作为封闭液,去除无关蛋白质的潜在结合位点的封闭;加入occludin(1∶10 000)或ZO-1Ⅰ抗进行反应,其后加入辣根过氧化物酶标记的Ⅱ抗;最后显色。用图像分析仪进行occludin及ZO-1蛋白表达的半定量分析,观察缺血后24 h上述指标的变化。
3.6脑含水量的测定脑缺血及缺血PC处理后24 h组再次麻醉动物,快速断头取脑,放在滤纸上,用滤纸吸干大脑表面少量的脑脊液,肉眼可见缺血区呈圆形或类圆形(假手术对照组除外),用本室自制的圆柱形铁制容器(直径为0.7 cm、体积固定),取出直径约0.7 cm,厚度约2~3 mm缺血区及对照组相应部位的脑皮质,立即放入有盖玻璃小器皿,置精密电子天平准确称取湿重,于100 ℃恒温箱烘烤24 h至恒重,并按Elliott干湿重法计算脑组织含水量,以百分率表示。脑含水量(%)=(湿重-干重)/湿重×100%。
3.7MRI检测脑梗死体积采用Philips Achieva 3.0T超导型MRI系统,扫描线圈为Sense-Flex-M小关节柔软线圈。扫描时点根据研究时刻而定,本研究中扫描时间为缺血24 h;后适应24 h。MR扫描完成后,所获图像在Philips MR Systems Achieva Release 2.5 Level 3主机上进行处理,先对梗死体积(数据来自T2WI序列的测量结果)进行鉴定与评估,在计算机辅助下手工绘制各组图像每一层面上异常信号区代表缺血面积(A1、A2、A3、…An),将每一层面上缺血面积相加(A1+A2+A3…An)再乘以层厚(S)得到脑缺血梗死区域的总体积[(A1+A2+A3…An)×S][5-6]。
4统计学处理
实验数据以均数±标准差(mean±SD)表示,用SPSS 11.5统计软件包,方差齐后行单因素方差分析(one-way ANOVA)、样本均数间的两两比较经Bornifar校正,以P<0.05为差异有统计学意义。
结果
1缺血PC对树鼩海马神经元超微结构改变的影响
电镜下对照组海马神经元超微结构正常;脑缺血24 h可见内质网扩张和内质网池形成,线粒体肿胀,部分嵴溶解;缺血PC组内质网扩张明显减轻,见图1。
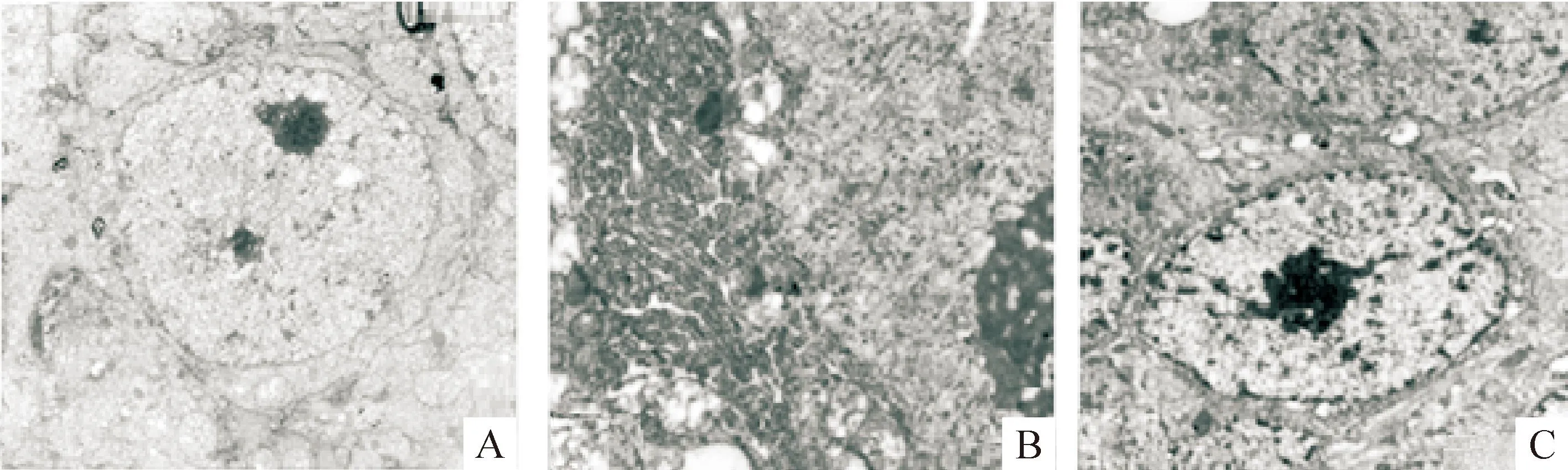
Figure 1.Ultrastructure of hippocampal neurons under electron microscope. A: control group: the normal neuron in hippocampus (×12 000); B: ischemia group: the endoplasmic reticulum cisterna, mitochondria swelling and cristae partly collapse at 24 h after thrombotic cerebral ischemia (×20 000); C: ischemic PC group: endoplasmic reticulum expansion reduced obviously after ischemic PC (×10 000).
图1缺血PC对海马神经元超微结构改变的影响
2缺血PC对树鼩海马神经元坏死及凋亡的影响
光镜下对照组树鼩海马神经元形态正常,免疫组化显示对照组海马神经元TUNEL染色阴性。脑缺血24 h海马CA1区神经元坏死,神经元缺失明显,海马CA1区神经元TUNEL阳性细胞数明显增加,与HE染色的细胞密度呈互补现象。缺血PC处理组海马CA1区正常神经元较多,且TUNEL 染色阳性神经元较缺血组明显减少(P<0.01),见图2。
3缺血PC对树鼩缺血区rCBF的影响
对照组树鼩皮层的rCBF为(434.20±28.54)PU。脑缺血24 h 时rCBF明显降低至(134.27±28.75) PU,与对照组比较差异有统计学显著性(P<0.01);而缺血PC组的rCBF恢复性增加(195.25±21.18) PU (P<0.01),见图3。
4缺血PC对树鼩海马ZO-1/occludin蛋白表达的影响
免疫组化结果显示,树鼩脑缺血24 h 海马ZO-1及occludin表达减弱,微血管密度明显减少;而缺血PC组ZO-1及occludin表达增强, 见图4。
将Western blot结果使用ImageJ软件测量各条带灰度值,各目标条带的灰度值与对应的内参照(β-actin)的灰度值比值视为目标蛋白的表达水平,将假手术对照组的比值标准化为100%,其它值用此值转化为百分比,Western blot检测结果可见脑缺血24 h 时ZO-1及occludin 表达减弱(P<0.01);而缺血PC组的ZO-1表达增强(P<0.01),occludin的改变差异无统计学显著性,见图5。
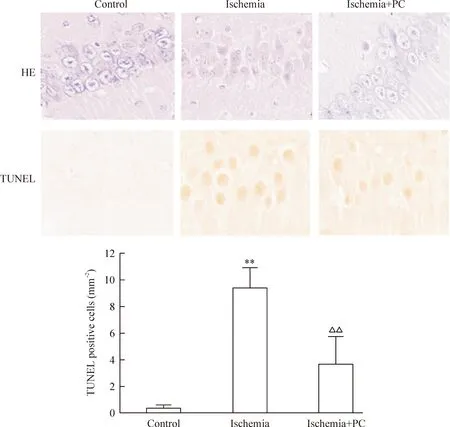
Figure 2.The effects of ischemia PC on the neuronal apoptosis and necrosis in the hippocampal CA1 area (×400). Mean±SD.n=9.**P<0.01vscontrol;△△P<0.01vsischemia.
图2缺血PC对海马CA1区神经元坏死及凋亡的影响
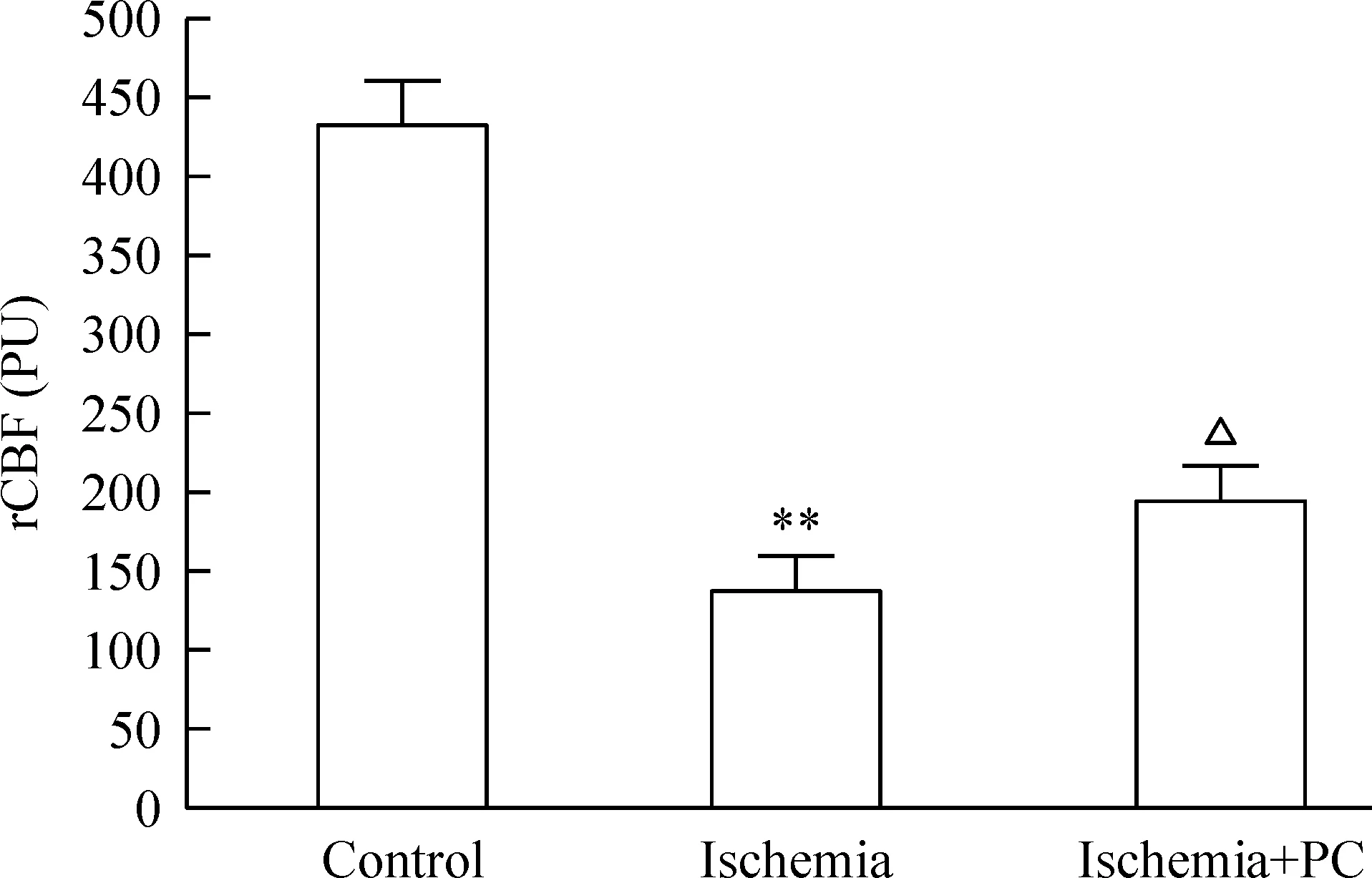
Figure 3.The effects of ischemic PC on rCBF in the ischemic zone. Mean±SD.n=8.**P<0.01vscontrol;△P<0.05vsischemia.
图3缺血PC对脑缺血区rCBF的影响
5缺血 PC对树鼩血栓性脑缺血脑水肿的影响
对照组树鼩的脑含水量为(79.71±0.23)%。脑缺血24 h脑含水量明显升高至(86.81±1.08)%,与对照组比较差异具有统计学显著性(P<0.01);而缺血PC组的脑含水量明显降低至(81.04±1.04)%,与缺血组比较差异具有统计学显著性(P<0.01),见图6。
6缺血PC对树鼩脑梗死体积的影响
MRI的结果显示,对照组树鼩的脑梗死面积为0;脑缺血24 h的脑梗死体积为(33.00±3.03)mm3。经缺血PC处理组上述时点脑梗死体积明显缩小至(16.79±1.29) mm3(P<0.01),见图7。
讨论
资料证实,通过诱导肢体一次致命性缺血而缓解远隔区器官(如大脑)的缺血程度,从而证明缺血PC是一种有前途的治疗干预措施,但其基本的生物学机制尚不清楚[7-8]。本项目采用树鼩(Tupaiaglis)作为实验动物,由于其在解剖、生理特征上是除猕猴以外与人类最接近的动物。该动物的颅骨薄(其厚度仅为大鼠的1/3),有利于特殊光束透过颅骨进行光化学反应而导致血管内皮损伤、血小板黏附/聚集而形成血栓;由于该脑缺血模型不需开颅,无脑脊液外漏,动物感染率低而便于长期观察;因此更符合临床脑血管疾病发病的客观规律。鉴于海马包括易损性和抵抗性2种截然不同的细胞结构,有利于进行缺血性脑损伤及细胞信号转导机制的研究,尤其对于探讨缺血PC脑保护的信号通道重建具有重要的应用价值。我们既往的研究发现,不同种属的动物脑缺血时海马CA1区均可反复重现“海马神经元选择性损伤”的普遍规律,与“神经-血管单元”的概念十分吻合[2]。因此,本研究选择脑缺血时rCBF、脑含水量及梗死体积3项主要观测指标,并以脑缺血后神经元受损最严重的24 h作为非药物干预的“时间窗”,探讨缺血PC促进occludin/ZO-1蛋白表达在rCBF增加与脑水肿减轻之间的相互关系,对阐明缺血PC的非药物干预的脑保护机制具有重要意义。
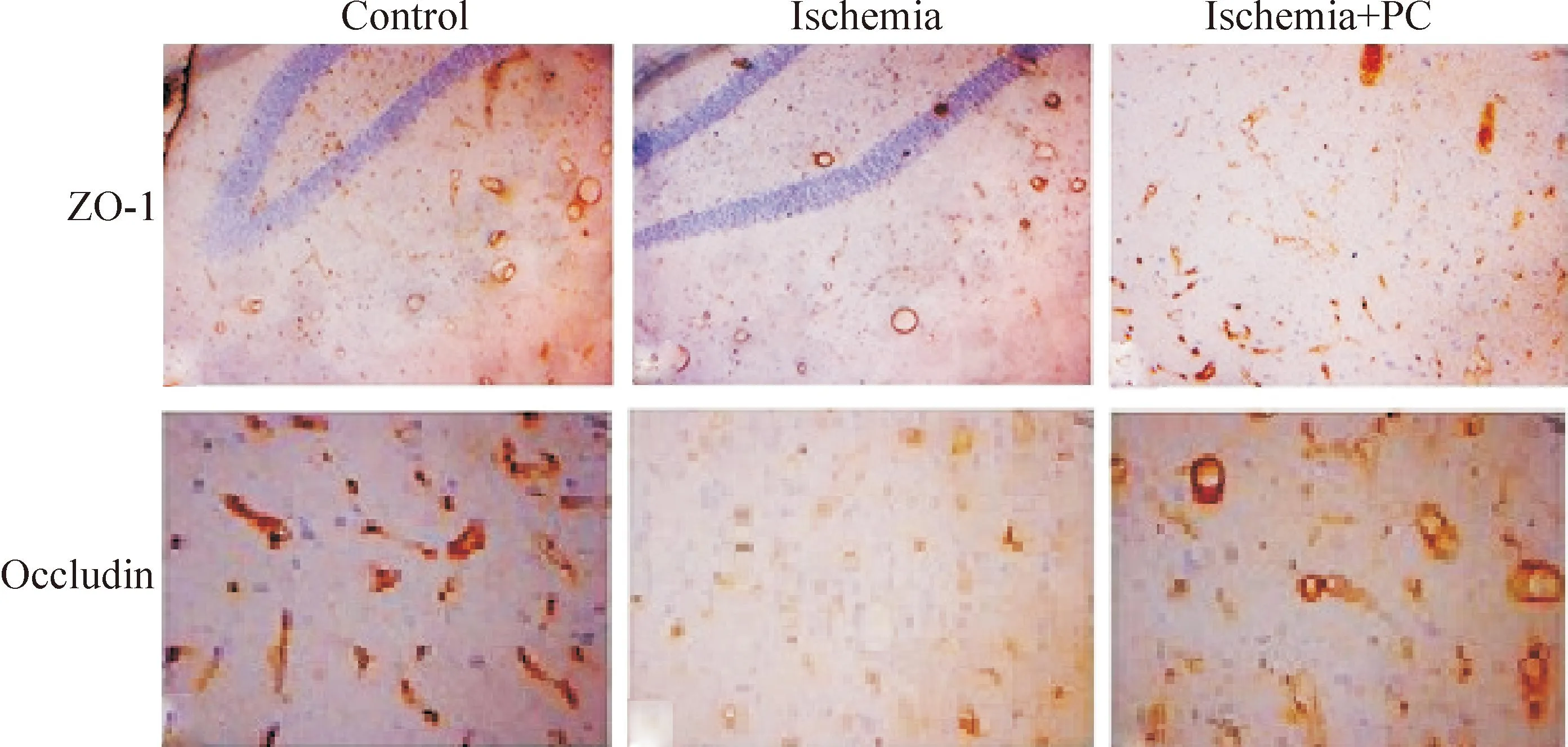
Figure 4.The effects of ischemia PC on the expression of occludin and ZO-1 in the hippocampus.
图4缺血PC对脑缺血海马occludin及ZO-1表达的免疫组化观察

Figure 5.The effects of ischemic PC on the expression of occludin and ZO-1 in the hippocampus. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol;△△P<0.01vsischemia.
图5缺血PC对脑缺血海马occludin/ZO-1蛋白表达的影响
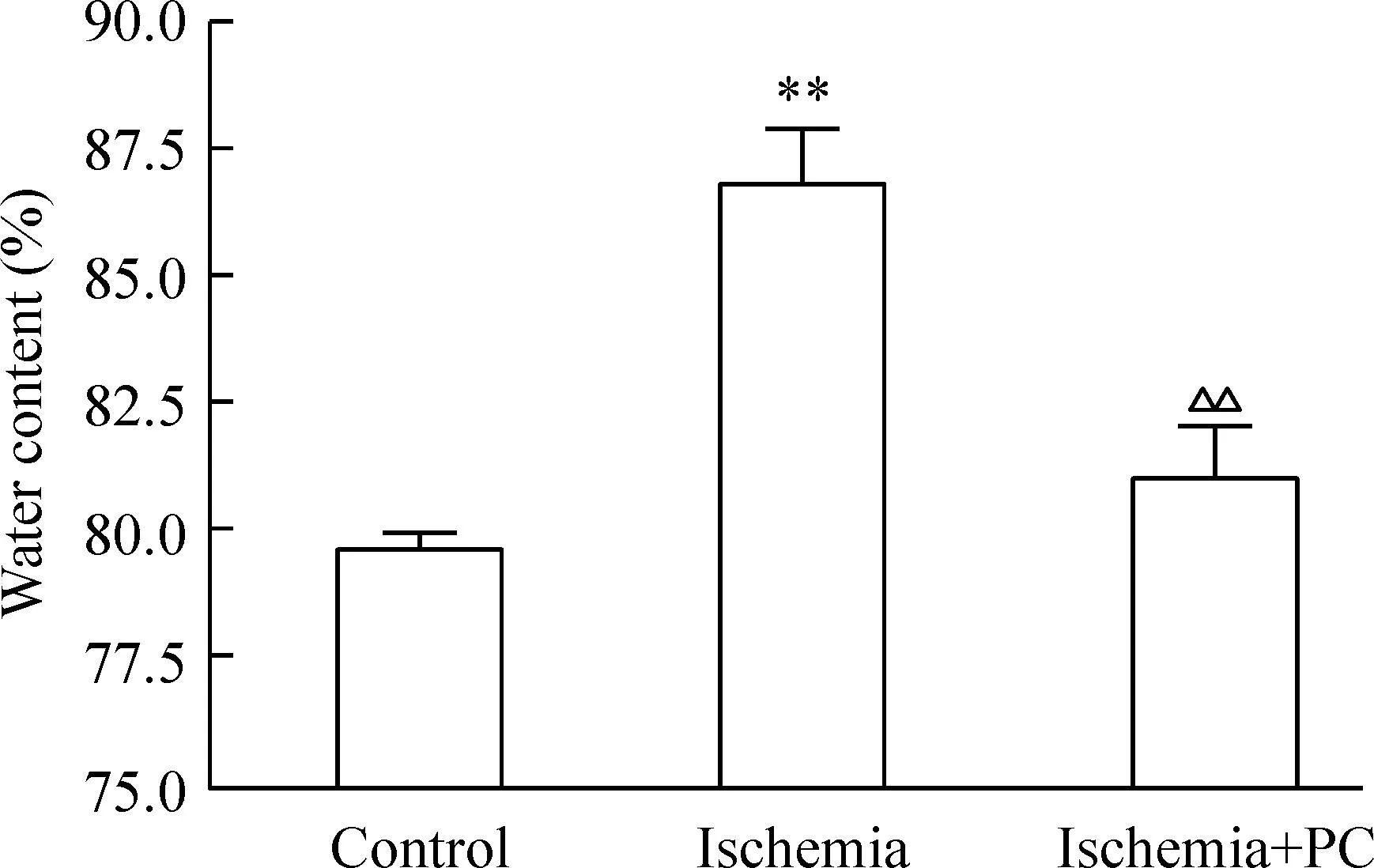
Figure 6.The effects of ischemic PC on the water content of the brain ischemic zone. Mean±SD.n=8.**P<0.01vscontrol;△△P<0.01vsischemia.
图6缺血PC对脑缺血区含水量的影响
实验结果发现,树鼩脑缺血后海马神经元的坏死与凋亡呈现出明显的选择性损伤特点,即以CA1区神经元损伤为主,且以缺血24 h为著,符合神经元迟发性死亡(delayed neuronal death,DND)及神经元缺失的病理特点[9]。实验后24 h树鼩脑缺血区rCBF明显降低,机制主要涉及3方面:(1)光化学诱导血管内皮细胞受损、血小板黏附和聚集以致微血管阻塞;(2)缺血区微血栓形成释放的缩血管物质使rCBF减少;(3)血管周围脑水肿导致的继发性血管闭塞。以上因素是导致脑缺血时海马神经元继发性损伤和迟发性坏死的关键所在。我们的观察发现,树鼩脑缺血时海马CA1区神经元的坏死与凋亡在时间和空间上可相互重叠,缺血区rCBF的降低而使脑含水量增加;其机制主要涉及线粒体能量匮乏导致的细胞毒性水肿和BBB受损引起的血管源性水肿两方面,是导致神经元损伤和脑梗死的主要原因。本研究采用MRI技术监测树鼩脑梗死体积的变化,为精准测量小动物脑缺血时脑梗死体积的改变,进而为评估缺血PC的脑保护作用提供了新的科学依据。已知BBB主要由脑微血管内皮细胞、基膜和胶质细胞组成,相邻内皮细胞间的TJ以拉链形式相互结合而封闭细胞间的缝隙,是构成BBB屏障功能的重要物质基础;而TJ的occludin和ZO-1则是控制物质穿过内皮和上皮细胞间连接的关键结构,在维持细胞极性、黏附性以及调节细胞增殖及分化具有重要作用[10]。业已证明,TJ的occludin经序列分析其具有4个跨膜区,N端对TJ发挥屏障功能起着关键作用,C端与ZO-1相连而使跨膜蛋白和细胞骨架贴在一起,有利于识别TJ的位置以及生物信号的传递[10-12],既是TJ形成的装配平台,又是occludin与细胞内骨架系统连接的信号机制中的重要物质基础[11]。我们经免疫组化定位检测显示,occludin/ZO-1表达与脑血管分布关系密切,且与rCBF的增加与减少呈平行改变。为阐明缺血PC增加rCBF的作用是否会促进脑水肿或加剧继发性脑损伤,我们观察了缺血PC对TJ表达的改变以及对脑水肿的影响。Western blot结果发现,脑缺血组rCBF明显降低,occludin/ZO-1表达明显下调且脑水肿明显,后者既是细胞代谢障碍与血管通透性增加共同作用的结果,也是导致脑梗死的原因。而缺血PC处理后,随着rCBF的恢复和组织缺血状态的改善,微血管occludin/ZO-1表达上调可能是减轻血管源性脑水肿和抑制神经元继发性损伤的关键所在。此结果将为临床采用PC改善脑缺血的非药物干预提供了重要的实验依据。缺血PC通过生物信号转导途径而提高组织的缺氧耐受以及机械信号转导而恢复组织供血的重要抗损伤反应,其使缺血时间窗后延的同时又抑制后续的炎症反应[3,9]。新近研究证实,增加紧密连接蛋白ZO-1的表达或修复紧密连接ZO-1的异常分布可改善BBB通透性异常增高所引起的病理改变,而TJ作为一种多功能生物学复合物,能通过调控细胞间的黏附、增殖与分化,在多种信号转导通路中起着重要作用[10-13]。本研究结果表明,光化学诱导树鼩血栓性脑缺血时rCBF、脑含水量及梗死体积3项主要观测指标具有明显改变,表现为缺血区rCBF锐减、脑水肿及脑梗死形成;其中神经元的凋亡与坏死则是脑梗死主要原因。而缺血PC增加rCBF而不促进脑水肿的机制可能是PC改善局部血流、缓解组织缺氧而上调微血管occludin/ZO-1表达的结果。由于血管机械张力可加快血清和糖皮质激素诱导的蛋白激酶1的活化,提示缺血PC的保护作用可能与蛋白激酶1有关[14]。最近,我们用氟代柠檬酸钠抑制星形胶质细胞的代谢后,缺血PC介导的脑保护作用明显减弱(待发表资料),推测星形胶质细胞在血管内皮细胞间信息网络的重建可能具有重要作用,其分子机制正在探索。
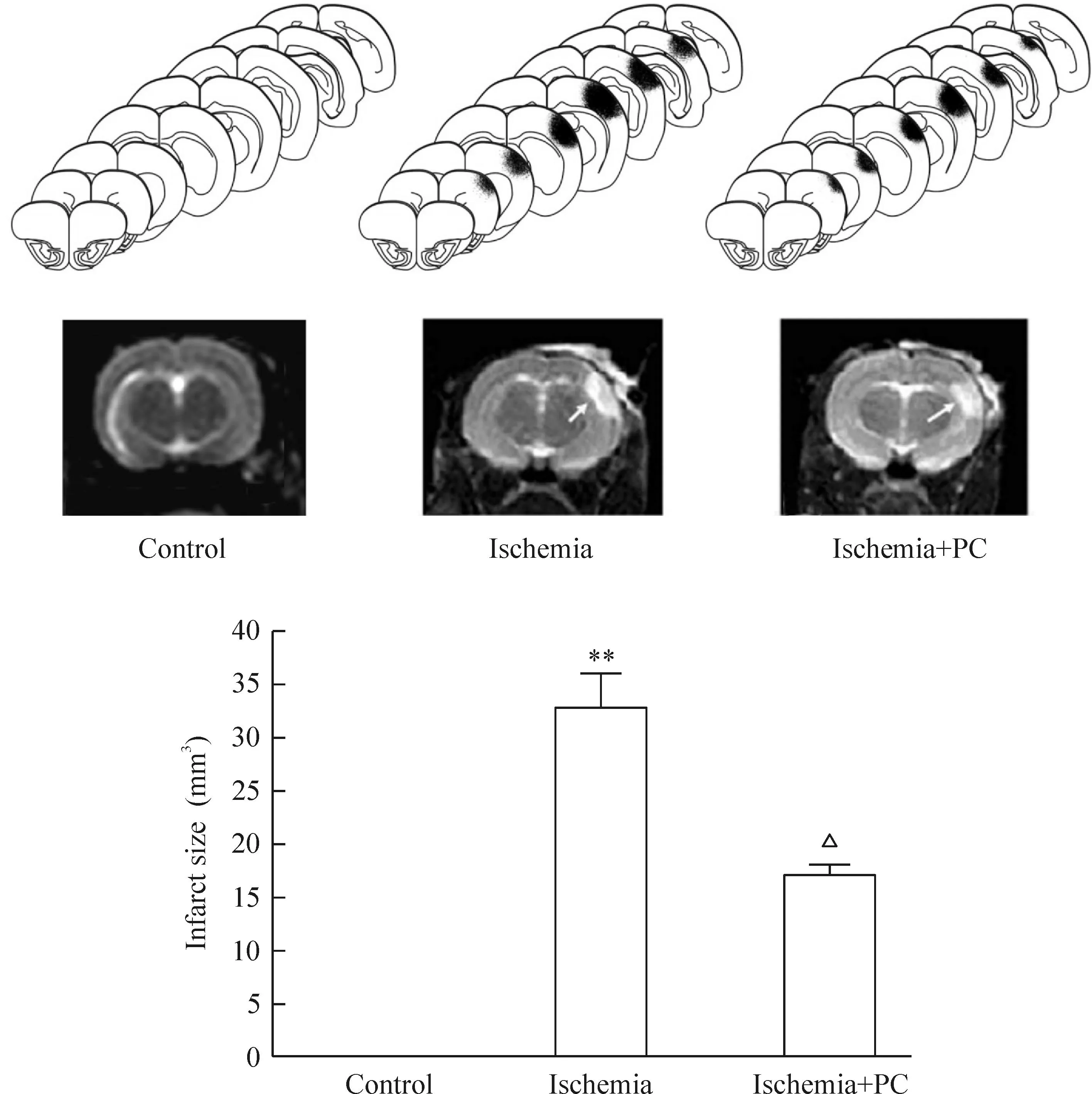
Figure 7.The effects of ischemic PC on the volume of cerebral infarction. Mean±SD.n=3.**P<0.01vscontrol;△P<0.05vsischemia.
图7缺血PC对树鼩脑梗死体积的影响
[参考文献]
[1]Lo EH, Broderick JP, Moskowitz MA. tPA and proteolysis in the neurovascular unit[J]. Stroke, 2004, 35(2):354-356.
[2]Pradilka N, Drunalini P, Qin H, et al.Delayed remote ischemic postconditioning improves long term sensory motor deficits in a neonatal hypoxic ischemic rat model[J]. PLoS One, 2014, 9(2):e90258.
[3]李树清,罗海芸,俞志成. 后适应对树鼩不同脑缺血模型同一“时间窗”海马神经元保护的比较[J]. 中国病理生理杂志, 2011, 27(5): 890-894.
[4]Feng R, Li SQ, Li F. Toll-like receptor 4 is involved in ischemic tolerance of postconditioning in hippocampus of tree shrews to thrombotic cerebral ischemia[J]. Brain Res, 2011, 1384:118-127.
[5]Walberer M, Stolz E, Muller C, et al. Experimental stroke-ischaemic lesion volume and edema formation differ among rat strains (a comparison between Wistar and Sprague-Dawley rats using MRI)[J]. Lab Anim, 2006, 40(1):1-8.
[6]Gerriets T, Stolz E, Walberer M, et al. Noninvasive quantification of brain edema and the space-occupying effect in rat stroke models using magnetic resonance imaging[J]. Stroke, 2004, 35(2):566-571.
[7]Dezfulian C, Garrett M, Gonzalez NR. Clinical application of preconditioning and postconditioning to achieve neuroprotection[J]. Transl Stroke Res, 2013, 4(1):19-24.
[8]Wu H, Lei S, Yuan J, et al.Ischemic postconditioning downregulates Egr-1 expression and attenuates postischemic pulmonary inflammatory cytokine release and tissue injury in rats[J]. J Surg Res, 2013, 181(2):204-212.
[9]Zhao YD, Cheng SY, Xiao Z, et al. Dendritic development of hippocampal CA1 pyramidal cells in a neonatal hypoxia-ischemia injury model[J]. J Neurosci Res, 2013, 91(9):1165-1173.
[10]Mark WM, Margaret MW, Eugene BC. Roles of ZO-1, occuldin and actin in oxidant induced barrier disruption[J]. Am J Physiol Gastrointest Liver Physiol, 2002, 290(2):G222-G231.
[11]Shang XY, Lin XJ, Manorek G, et al.Claudin-3 and claudin-4 regulate sensitivity to cisplatin by controlling expression of the copper and cisplatin influx transporter CTR1[J]. Mol Pharmacol, 2013, 83(1):85-94.
[12]Müller SL, Portwich M, Schmidt A, et al. The tight junction protein occludin and the adherens junction protein α-catenin share a common interaction mechanism with ZO-1[J]. J Biol Chem, 2005, 280(5): 3747-3756.
[13]王新施,朱攀,朱振国,等. 咪唑克生对体外血脑屏障炎症模型通透性的影响[J]. 中国病理生理杂志, 2015, 31(4):669-674.
[14]Aoyama T, Matsui T, Novikov M, et al. Serum and glucocorticoid-responsive kinase-1 regulates cardiomyocyte survival and hypertrophic response [J]. Circulation, 2005, 111(13):1652-1659.
(责任编辑: 林白霜, 罗森)
Ischemia postconditioning induces tight junction protein expression and inhibits brain edema after thrombotic cerebral ischemia in tree shrews
LI Shu-qing, LI Fan, HE Liang, HE Bo
(DepartmentofPathophysiology,SchoolofBasicMedicalSciences,KunmingMedicalUniversity,Kunming650050,China.E-mail:shuqing28@hotmail.com)
[ABSTRACT]AIM: To assess whether the expression of tight junction (TJ) proteins, occludin/zonula occludins (ZO)-1, and regional cerebral blood flow (rCBF) link to brain edema in tree shrews during thrombotic cerebral ischemia and ischemic postconditioning (PC), and to explore how TJ affects brain edema and cerebral infarction. METHODS: Tree shrews were randomly grouped into control, ischemia and cerebral ischemia+PC (n=23), and the remaining 3 animals were used for magnetic resonance imaging (MRI). The local cerebral thrombosis were induced by photochemical reaction in the tree shrews, and ischemic PC was established at 4 h after induction of cerebral ischemia followed by clipped ipsilateral common carotid artery (5 min×3). The changes of the neural ultrastructure were observed under electron microscope. The neuronal apoptosis was analyzed by the method of TUNEL. Laser Doppler brain flowmetry was used to monitor the rCBF. The protein levels of occludin/ZO-1 were determined by immunochemistry and Western blot. The cerebral infarction volume was detected by MRI. The brain water content was measured by dry-wet weight method. RESULTS: Induction of cerebral ischemia led to a significant reduction of the normal neuron numbers in the hippocampal CA1 area, and conversely, the number of neurons with abnormal ultrastructure was increased. The TUNEL positive cells were increased significantly (P<0.01) in ischemia group. Moreover, the rCBF decreased significantly (P<0.01), and occludin/ZO-1 protein expression decreased (P<0.01). The brain water content and cerebral infarction volume were significantly increased (P<0.01). Ischemic PC increased the rCBF and the occludin/ZO-1 expression, but reduced the brain water content, the TUNEL positive cells, and the infarction volume (P<0.01). CONCLUSION: Ischemic PC increases the rCBF but not the local water content, suggesting that reduced cerebral infarction volume after ischemia PC is associated with the attenuation of cerebral edema by the enhancement of occludin/ZO-1 protein expression.
[KEY WORDS]Photochemistry reaction; Cerebral ischemia; Cerebral edema; Postconditioning; Tight junction protein; Magnetic resonance imaging; Tree shrews
doi:10.3969/j.issn.1000- 4718.2016.03.015
[中图分类号]R743.31
[文献标志码]A
通讯作者△Tel: 0871-65922858; E-mail: shuqing28@hotmail.com
*[基金项目]国家科技支撑计划(No. 2014BAI0101);国家自然科学基金面上项目(No. 30971171)
[收稿日期]2015- 10- 08[修回日期] 2015- 12- 29
[文章编号]1000- 4718(2016)03- 0477- 08
杂志网址: http://www.cjpp.net

