NCA对受磷蛋白敲除小鼠心肌兴奋-收缩偶联的作用*
钟 鑫, 王喜尧, 梁晓辉, 杨东晓, 王育文△
(哈尔滨医科大学 1病理生理学教研室, 2附属第二医院检验科,黑龙江 哈尔滨 150081;3哈尔滨市红十字中心医院放射科,黑龙江 哈尔滨 150001)
NCA对受磷蛋白敲除小鼠心肌兴奋-收缩偶联的作用*
钟鑫1,王喜尧2,梁晓辉3,杨东晓2,王育文2△
(哈尔滨医科大学1病理生理学教研室,2附属第二医院检验科,黑龙江 哈尔滨 150081;3哈尔滨市红十字中心医院放射科,黑龙江 哈尔滨 150001)
[摘要]目的: 硝酰基(HNO)在轻微增加细胞内钙的基础上可以显著增加心肌肌丝对钙离子的反应性。本研究中,我们应用崭新的HNO供体乙酸1-亚硝基环己酯(NCA)来观察HNO对受磷蛋白敲除(PLB-KO)小鼠心室梳状肌的作用。方法: 小鼠右心室的完整梳状肌被连接在张力换能器与刺激电极之间,肌小节长度设定在2.2~2.3 μm之间,K-H液表面灌流后,Fura-2经玻璃微电极负载进行离子透入法检测[Ca2+]i,同时测定心肌收缩张力的变化。结果: PLB-KO小鼠心室梳状肌比野生型(WT)小鼠具有更高的钙瞬变及收缩力,同时展示负性收缩力-收缩频率相关性(FFR)。NCA(2.5 μmol/L)在不同浓度细胞外钙([Ca2+]o) 条件下增加PLB-KO及WT小鼠心肌收缩力,但并不影响PLB-KO小鼠的负性FFR。稳态条件下2组小鼠去肌膜梳状肌的收缩力-钙离子相关性无显著性差异,NCA则增加去肌膜梳状肌的钙离子的反应性。结论: NCA提供的HNO通过增加PLB-KO及WT小鼠心肌肌丝对钙离子的反应性而增强心肌收缩力;心肌细胞内钙瞬变的增加伴随收缩力的增强表明HNO可改善钙离子活性,进一步证实HNO作为正性肌力药物的作用效果。
[关键词]乙酸1-亚硝基环己酯; 硝酰基; 钙瞬变; 受磷蛋白
硝酰基(nitroxyl ,HNO)作为一氧化氮的单电子还原产物,对活体心脏发挥正性肌力作用[1]。HNO具备β受体激动剂的作用但不被β受体阻滞剂所阻断,且对细胞氧化还原状态十分敏感。最近对HNO在心脏作用机制的研究[2]中发现,HNO能够增加Ca2+从肌浆网(sarcoplasmic reticulum,SR) 的释放及肌丝对Ca2+反应性,与此同时HNO并不影响肌丝ATP酶的活性[3]。尽管HNO增加肌丝对Ca2+反应性的作用预示了其可能通过对肌丝蛋白质翻译后修饰的调控来对收缩力进行调节,但导致心肌收缩力变化的收缩期Ca2+瞬变的增加程度尚不清楚。
以往研究中使用的HNO供体为Angeli’s salt(AS)。AS不是纯HNO供体,可以同时释放HNO和亚硝酸盐。亚硝酸盐不刺激心肌产生收缩性反应,在体内主要导致血管舒张。乙酸1-亚硝基环己酯(1-nitrosocyclohexyl acetate,NCA)不释放亚硝酸盐,是较纯的HNO供体[4],其研究能对HNO生化作用及机制进行更有效的分析。
受磷蛋白(phospholamban,PLB)是一种肌浆网跨膜蛋白质,在去磷酸化状态下能够抑制SR Ca2+-ATP酶(SERCA2a) 的活性。肾上腺素能够刺激PLB发生磷酸化从而解除该抑制作用,造成Ca2+释放增多及心肌收缩力增强[5]。PLB在心肌兴奋-收缩偶联的作用已经在PLB基因敲除(PLBknockout,PLB-KO)小鼠进行了广泛的研究[6-7],PLB-KO与[Ca2+]i瞬变增加密切相关,由此导致心肌在基础条件下即呈现“高动力学状态”。[Ca2+]i瞬变的增加与SR Ca2+泵功能及SR Ca2+容量的增强是一致的。生理学方面, PLB-KO动物心脏对异丙肾上腺素的刺激产生更强的抵抗效果[8],其心脏乳头肌有时却呈现负性收缩力-收缩频率相关性(force-frequency relationship,FFR)[7]。这些研究结果表明[Ca2+]i对可能增加PLB-KO动物心脏[Ca2+]i的刺激因素具有弹性反应能力。
本研究中,我们验证了NCA这种崭新的HNO供体对野生型(wild-type,WT)及PLB-KO小鼠心室梳状肌[Ca2+]i及收缩力变化的影响。实验结果证实,NCA可以通过增加[Ca2+]i瞬变及肌丝对Ca2+反应性的协同作用来增加心肌收缩力。
材料和方法
1动物及试剂
实验中应用PLB-KO、WT小鼠及NCA均由美国约翰霍普金斯大学医学院麻醉实验室赠予。
2主要方法
2.1梳状肌制备及张力测定PLB-KO和WT小鼠腹腔注射戊巴比妥(100 mg/kg)麻醉,沿胸骨中部切开暴露心脏后迅速摘除心脏并将其放置在标本盘中。室温下进行主动脉插管并用含有95% O2及5% CO2的Kerb-Henseleit (K-H) 液逆行灌流(15 mL/min)。K-H液组成(mmol/L):NaCl 120,NaHCO320,KCl 5,MgCl21.2,glucose 10,CaCl20.5及2,3-丁二酮 (BDM)20,pH 7.35~7.45,室温21~22 ℃。取自于右心室的梳状肌置于张力换能器和刺激电极之间,然后对其进行K-H液表面灌流(10 mL/min),同时给予频率为0.5 Hz的刺激。解剖显微镜下(×40)标准刻度线测量梳状肌的尺寸, WT组为(0.89±0.04) mm 长,(0.19±0.01) mm 宽,(0.100±0.004) mm 厚; PLB-KO 组为(0.86±0.06) mm长,(0.19±0.01) mm宽,(0.110±0.005) mm厚。
应用张力换能系统(KG7, Scientific Instruments GmbH)对收缩力进行测量并以单位横截面积上所受的力(mN/mm2)来表示。肌小节长度通过激光衍射法[9]进行测量。通过网状二极管线阵系统(RC0100-RG512,EG&G Reticon)检测肌肉中部区域的衍射光线。衍射的初级光强度被整合,应用定制的肌小节长度检测系统(University of Calgary)测出光强度分布中值,从而决定肌小节长度。实验过程中静息肌小节长度设定为2.2~2.3 μm。
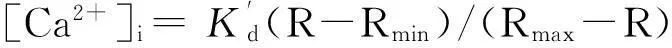
2.3梳状肌稳态激活作用及去肌膜心肌组织收缩力的测定高钾 K-H液对PLB-KO及WT小鼠心脏灌流,然后迅速分离梳状肌。梳状肌随后在舒张液(mmol/L: KCl 100,HEPES 25,K2EGTA 10, NaCrP 15,Na2ATP 5,MgCl25.15,leupeptin 0.5,pH 7.2)中用Triton X-100 (1%)去肌膜处理15~20 min。通过不同比例混合活化液(mmol/L: Ca2+-EGTA 10,KCl 100,HEPES 25,Na2CrP 15,Na2ATP 5,MgCl24.75, leupeptin 0.5,pH 7.2)及舒张液以获得多种[Ca2+]o浓度。稳态条件力-[Ca2+]i关系应用希尔公式来计算:F=Fmax[Ca2+]n/(Ca50n+ [Ca2+]n)。其中,F表示不同[Ca2+]下心肌稳态收缩力,Fmax表示最大[Ca2+]时收缩力,Ca50表示达到50% Fmax的[Ca2+],n代表希尔系数。
3统计学处理
实验数据均采用均数±标准差(mean±SD)表示。差异性分析采用配对t检验(两变量均数间差异比较)和单因素方差(随机设计的多个样本均数间比较)分析方法。以P<0.05为差异有统计学意义。
结果
1PLB-KO及WT小鼠心肌收缩力及[Ca2+]i的变化
图1显示正常条件下(刺激频率0.5 Hz、[Ca2+]o1.5 mmol/L)2组小鼠梳状肌收缩力及[Ca2+]i的变化轨迹,图2则显示不同浓度[Ca2+]o对PLB-KO及WT小鼠梳状肌收缩力及[Ca2+]i瞬变的影响。正常条件下,与WT组相比,PLB-KO组梳状肌表现更高的收缩力及[Ca2+]i瞬变(P<0.05)。不同浓度[Ca2+]o条件下,PLB-KO组梳状肌仍表现出更高收缩力及[Ca2+]i瞬变。这些结果与其它研究结果一致,表明PLB-KO梳状肌具备“高收缩”特性[6, 11]。同时也表明PLB-KO梳状肌在[Ca2+]o逐渐增加的条件下具有加大收缩力及[Ca2+]i瞬变振幅的能力。
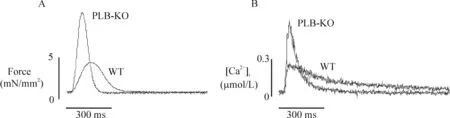
Figure 1.Representative raw recordings of force (A) and intracellular Ca2+transients (B) from WT and PLB-KO trabeculae. The muscles were stimulated at 0.5 Hz in the presence of 1.5 mmol/L external Ca2+.
图1正常心肌收缩力及[Ca2+]i变化
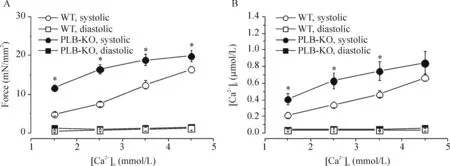
Figure 2.Force (A) and intracellular Ca2+concentration (B) in cardiac muscles from PLB-KO and WT mice at various external Ca2+concentrations. The muscles from PLB-KO mice had higher force development and greater Ca2+transients at any given external Ca2+concentrations. However, the increases (over baseline) for both force and Ca2+transients were more prominent in WT muscles. Mean±SD.n=9~10.*P<0.05vsWT group.
图2不同[Ca2+]o心肌收缩力及[Ca2+]i变化
我们也检测了收缩力-频率及[Ca2+]i-频率之间的关系。2组梳状肌在相同[Ca2+]o(1.5 mmol/L)下分别给予不同频率(0.5~3.0 Hz)的刺激,结果表明,WT组收缩力及[Ca2+]i瞬变振幅随刺激频率的增加而增加,而PLB-KO梳状肌则显示负性FFR及负性[Ca2+]i-频率关系。这些结果与以往研究结果相一致[7],表明PLB 在维持心肌正性FFR过程中的重要意义,见图3。
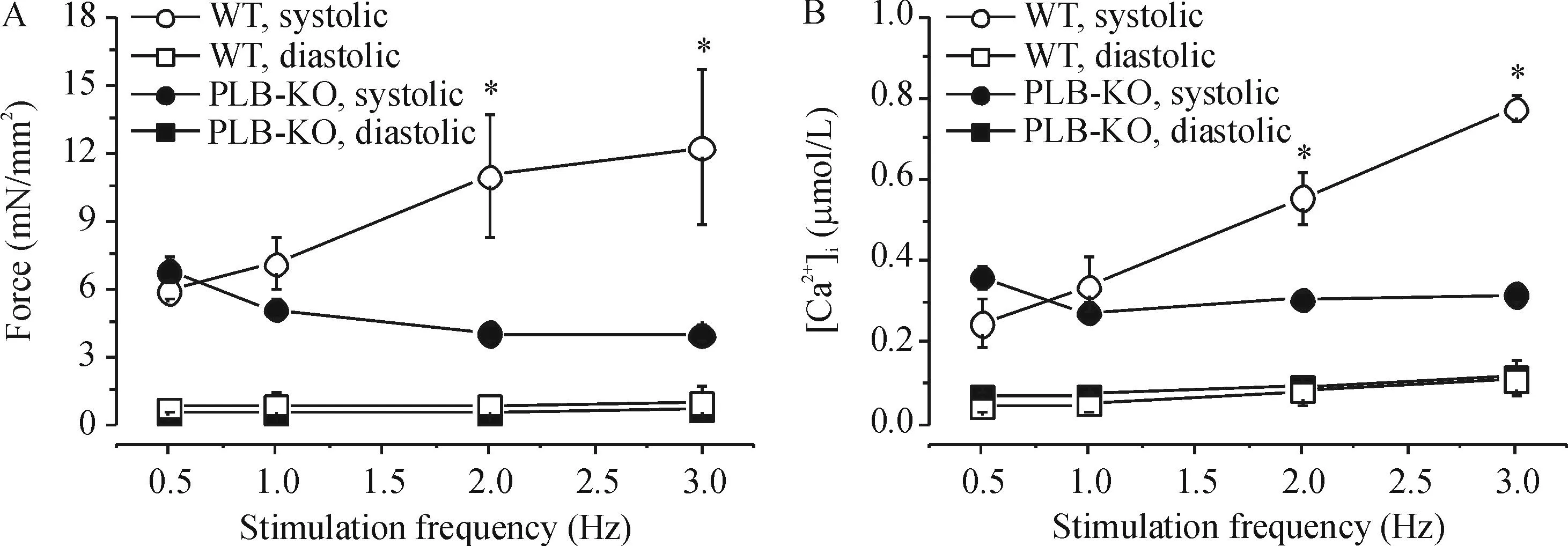
Figure 3.Force-frequency relationship in PLB-KO and WT muscles. A: the muscles from PLB-KO mice exhibited a negative force-frequency relationship, whereas the WT muscles had a positive force-frequency relationship; B: the changes in Ca2+transients followed force development. Mean±SD.n=6~8.*P<0.05vsPLB-KO group.
图3不同刺激频率心肌收缩力及[Ca2+]i变化
2NCA对PLB-KO及WT小鼠梳状肌收缩力及[Ca2+]i的作用
图4A显示在不同的[Ca2+]o条件下NCA(2.5 μmol/L)对PLB-KO梳状肌收缩力及[Ca2+]i瞬变的作用,NCA在不影响[Ca2+]i的情况下明显增强收缩力。而在WT组,NCA则增加[Ca2+]i同时更大幅度地增强了收缩力。图4B比较了以1.5 mmol/L [Ca2+]o为基线,给予4.5 mmol/L [Ca2+]o条件下NCA对收缩力及[Ca2+]i瞬变的作用效果。PLB-KO组梳状肌[Ca2+]i瞬变在基线基础上增加(36±8)%,收缩力则增加(85±7)%。 而WT组[Ca2+]i瞬变增加(129±18)% (P<0.05),收缩力增加(241±8)% (P<0.05)。这些结果表明HNO具有增强收缩力及[Ca2+]i瞬变的协同效果。
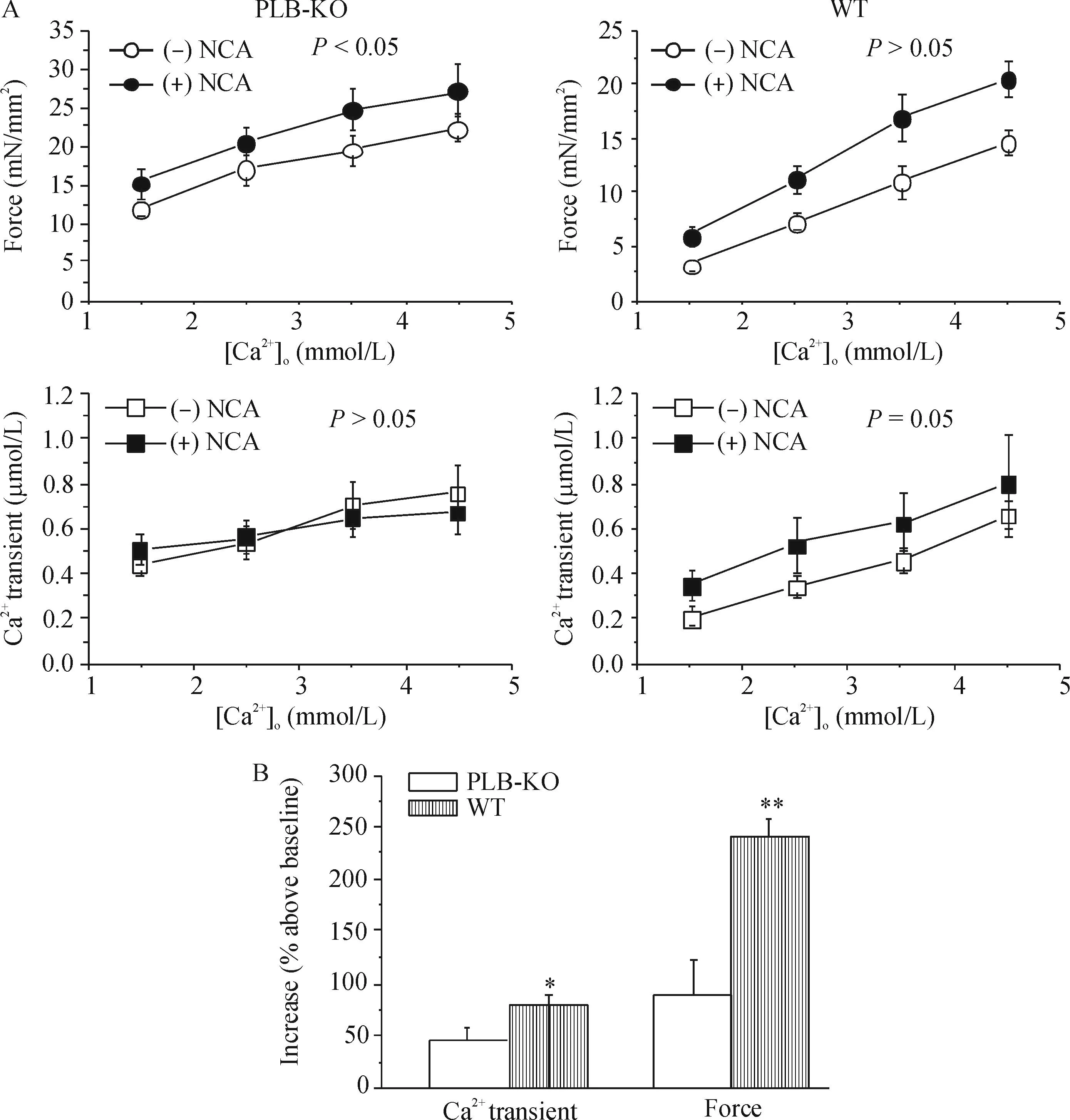
Figure 4.The effects of NCA (2.5 μmol/L) on systolic force and Ca2+transients at various external Ca2+concentrations (A), and pooled data of the effects of external Ca2+and NCA on the increases in Ca2+transients and force in PLB-KO and WT mice (B). Mean±SD.n=6~9.*P<0.05,**P<0.01vsPLB-KO group.
图4不同[Ca2+]o条件下NCA对心肌收缩力及[Ca2+]i的影响
为进一步证实上述结论,我们检测了NCA对PLB-KO梳状肌FFR的作用效果。NCA 在不同刺激频率下均可增加PLB-KO梳状肌收缩力但并不影响 [Ca2+]i变化,表现为负性FFR效果。在WT组,NCA 则表现为阳性FFR效果。在基本刺激频率下2组梳状肌收缩力及[Ca2+]i瞬变参数的变化,NCA不影响PLB-KO组收缩力及[Ca2+]i瞬变,WT组 [Ca2+]i瞬变则在NCA作用下增加超过100%,收缩力相应增加超过200%,见图5。
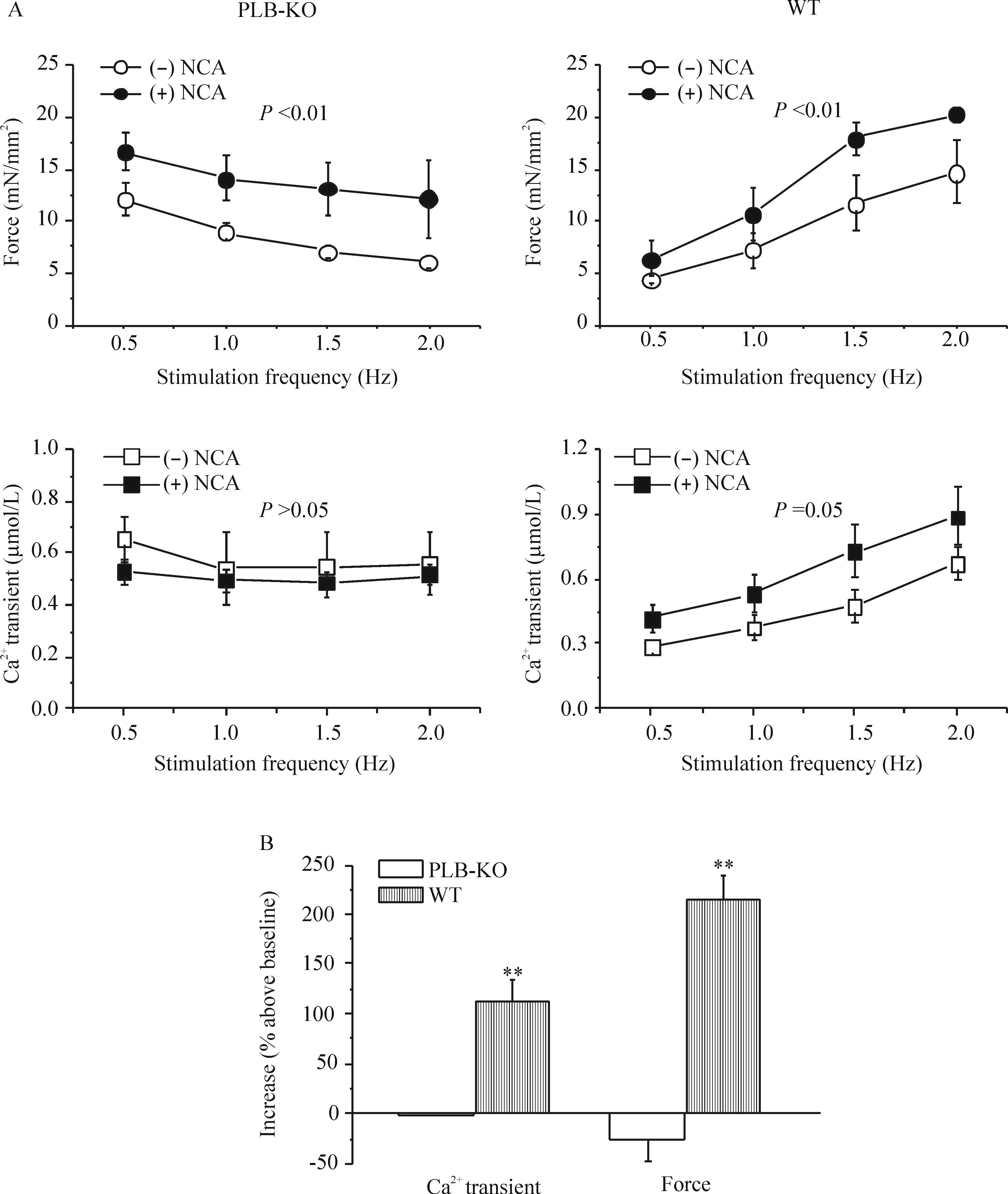
Figure 5.The effects of NCA on the force-frequency and Ca2+transient-frequency relationships in PLB-KO and WT muscles (A), and pooled data of the effects of NCA on force-frequency relationship in PLB-KO and WT muscles (B). Mean±SD.n=5~7.**P<0.01vsPLB-KO group.
图5不同刺激频率NCA对心肌收缩力及[Ca2+]i影响
3NCA对PLB-KO小鼠梳状肌稳态收缩力-[Ca2+]i关系的作用
前面结果显示在不同实验条件(多种[Ca2+]o或频率)下,相对于[Ca2+]i瞬变NCA可以更显著地增加梳状肌收缩力。为证实HNO可以增加肌丝对Ca2+的反应性,我们将2组梳状肌进行化学去膜以获得稳态活化状态 (图 6)。一些基本参数,如最大[Ca2+]时收缩力(Fmax)、50% 活化Ca2+浓度 (Ca50)及希尔系数(n)等2组间差别无统计学显著性。NCA给药后,PLB-KO组的Fmax增至(52.1±5.1) mN/mm2(P<0.05)且Ca50降至(0.61±0.10) μmol/L(P<0.05)。WT组NCA 给药后的Fmax增至(50.3±4.1) mN/mm2, Ca50则降至(0.77±0.11) μmol/L (P<0.05)。由此可见, 在PLB-KO及WT组NCA均以同样的方式增加Fmax并降低Ca50而不影响希尔系数。该结果表明HNO可以增加WT及PLB-KO小鼠梳状肌肌丝对Ca2+的反应性。
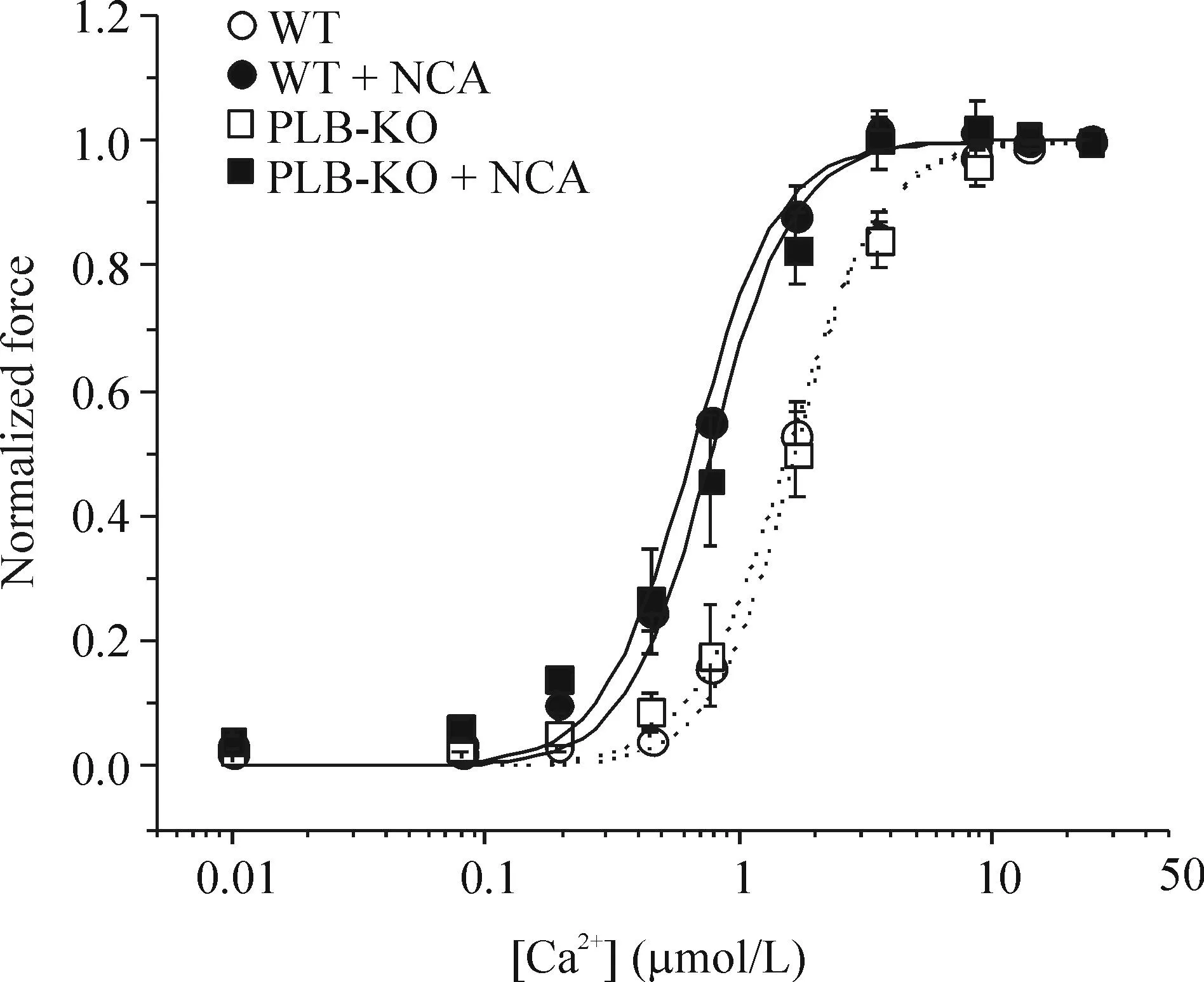
Figure 6.The effect of NCA on the force-[Ca2+] relationship in PLB-KO and WT muscles after skinning. The data were normalized to each maximal force value for comparison. Mean±SD.n=9~10.
图6NCA增加心肌纤维对Ca2+反应性
讨论
本研究中我们发现与WT小鼠相比,PLB-KO小鼠梳状肌表现更显著的收缩力及[Ca2+]i瞬变;当[Ca2+]o增加时,其收缩力及[Ca2+]i瞬变增加的程度较弱,呈现负性FFR。重要的是,在不同[Ca2+]o条件下,NCA并不增加PLB-KO小鼠心肌[Ca2+]i瞬变,且不改变其FFR。然而,稳态激活条件下,NCA则可以增加2组心肌的钙离子反应性。这些结果表明:(1) NCA增加WT及PLB-KO小鼠心肌的钙离子反应性;(2) NCA增加PLB调控的[Ca2+]i瞬变; (3) NCA具有协同增加[Ca2+]i瞬变及钙离子反应性的特殊效应。
我们在研究中发现NCA 不能增加PLB-KO小鼠梳状肌的[Ca2+]i瞬变,这表明SR的PLB是HNO的关键靶点,这也与最近一项研究结果即在WT PLB及无半胱氨酸PLB动物微粒体内SERCA2a能被HNO激活的结果相符合[12]。当给予HNO时,在表达SERCA2a 及 PLB 的微粒体内SERCA2a 活化作用增强,而在表达SERCA2a 及无半胱氨酸PLB 的微粒体内SERCA2a 活化作用则保持不变,这可能是HNO促PLB分子内半胱氨酸间形成二硫键所致[12]。
本研究中最重要的发现是NCA/HNO具有增加[Ca2+]i瞬变及肌丝对Ca2+反应性的协同效果。该协同作用只发生在收缩期,因为HNO并不增加舒张期张力及舒张时程[3]。另外,与传统的增加心肌收缩力的药物(如β受体激动剂,增加[Ca2+]i而降低肌丝对Ca2+反应性)不同,HNO的活性不依赖于cAMP-依赖性的蛋白激酶A(protien kinase A,PKA)及C( protien kinase C,PKC)[1]。β受体激动剂诱导的[Ca2+]i瞬变增加是由PLB的PKA磷酸化所致,PKA磷酸化后PLB的抑制作用被解除,从而允许更多的Ca2+从SR释放。肌钙蛋白TnI的磷酸化作用则降低了肌丝对Ca2+的反应性。HNO与levosimendan(钙敏剂,增加肌丝对Ca2+反应性,收缩期改变力-Ca2+关系)作用相似,但levosimendan也激活ATP敏感钾通道而增加心律失常的风险性[13]。Levosimendan结合在TnC的N末端,增加其对Ca2+亲和力。值得注意的是,碳酰胆碱能够抑制levosimendan的正性肌力作用,表明levosimendan的作用效果是cAMP依赖性的[14]。由此可见,HNO对心肌作用的唯一性表明其是一种新型的正性肌力制剂,其增加[Ca2+]i瞬变及肌丝对Ca2+反应性的协同作用也将HNO与其它正性肌力作用明显地区别开来。
HNO增加[Ca2+]i瞬变及肌丝对Ca2+反应性的作用取决其化学特征的唯一性。在化学上,HNO主要与巯基发生反应[15]。HNO与蛋白质巯基发生反应形成二硫键或蛋白质亚磺酰胺,这取决于是否存在邻位巯基或巯基的化学性质。多项研究证实HNO对心脏发挥的作用是选择性且可逆的[2-3],其正性肌力作用可被二硫苏糖醇(dithiothreitol,DTT)所阻断,表明其具有较强的氧化还原敏感性。临床上心衰的患者必须依赖正性肌力药物治疗。迄今为止,正性肌力代表药物包括β受体激动剂及磷酸二酯酶抑制剂,这两类药物均通过增加细胞内cAMP 及Ca2+水平发挥作用。然而,这些药物仅在短期内发挥效应,长期应用则增加患者死亡率。因此,临床上一直在寻求一种安全有效、可以长期口服治疗心衰的正性肌力药物。增加肌丝对Ca2+反应性的药物能够增加心肌收缩力而不影响[Ca2+]i瞬变,这种药物可以产生更安全的正性肌力反应。HNO增加心肌收缩力的作用并不影响舒张期张力及ATP的消耗,表明其可以提高心肌收缩作用的效率[3]。可以认为HNO作为一种新型正性肌力药物,在收缩期发挥增加[Ca2+]i瞬变及肌丝对Ca2+反应性的协同作用而不影响舒张期张力变化,其优势在于消耗较少能量而产生更强的收缩力。
总而言之,HNO在WT及PLB-KO小鼠梳状肌发挥正性肌力作用。在PLB-KO小鼠该作用主要是通过增加肌丝对Ca2+反应性而非增加[Ca2+]i来实现的;而对于WT小鼠,HNO则发挥增加肌丝对Ca2+反应性及[Ca2+]i瞬变的协同作用。HNO的这些作用进一步强调了其作为新型正性肌力药物可以在不影响舒张期张力的前提下,能够在收缩期放大钙信号产生更强的收缩力而发挥药理作用的唯一性。
[参考文献]
[1]Paolocci N, Katori T, Champion HC, et al. Positive inotropic and lusitropic effects of HNO/NO-in failing hearts: independence from beta-adrenergic signaling[J]. Proc Natl Acad Sci U S A, 2003, 100(9):5537-5542.
[2]Tocchetti CG, Wang W, Froehlich JP, et al. Nitroxyl improves cellular heart function by directly enhancing cardiac sarcoplasmic reticulum Ca2+cycling[J]. Circ Res, 2007, 100(1): 96-104.
[3]Dai T, Tian Y, Tocchetti CG, et al. Nitroxyl increases force development in rat cardiac muscle [J]. J Physiol, 2007, 580(3):951-960.
[4]Sha X, Isbell TS, Patel RP, et al. Hydrolysis of acyloxy nitroso compounds yields nitroxyl (HNO) [J]. J Am Chem Soc, 2006, 128(30):9687-9692.
[5]MacLennan DH, Kranias EG. Phospholamban: a crucial regulator of cardiac contractility [J]. Nat Rev Mol Cell Biol, 2003, 4(7):566-577.
[6]Santana LF, Kranias EG, Lederer WJ. Calcium sparks and excitation-contraction coupling in phospholamban-deficient mouse ventricular myocytes[J]. J Physiol, 1997, 503(Pt1):21-29.
[7]Bluhm WF, Kranias EG, Dillmann WH, et al. Phospholamban: a major determinant of the cardiac force-frequency relationship[J]. Am J Physiol Heart Circ Physiol, 2000, 278(1): H249-H255.
[8]Luo W, Grupp IL, Harrer J, et al. Targeted ablation of the phospholamban gene is associated with markedly enhanced myocardial contractility and loss of beta-agonist stimulation[J]. Circ Res, 1994, 75(3):401-409.
[9]Gao WD, Backx PH, Azan-Backx M, et al. Myofilament Ca2+sensitivity in intact versus skinned rat ventricular muscle[J]. Circ Res, 1994, 74(3):408-415.
[10]Gao WG, Perez, NG, Marban E. Calcium cycling and contractile activation in intact mouse cardiac muscle[J]. J Physiol, 1998, 507(1):175-184.
[11]Wolska BM, Stojanovic MO, Luo W, et al. Effect of ablation of phospholamban on dynamics of cardiac myocyte contraction and intracellular Ca2+[J]. Am J Physiol, 1996, 271(1 Pt 1):C391-C397.
[12]Froehlich JP, Mahaney JE, Keceli G, et al. Phospholamban thiols play a central role in activation of the cardiac muscle sarcoplasmic reticulum calcium pump by nitroxyl[J]. Biochemistry, 2008, 47(50):13150-13152.
[13]Szilagyi S, Pollesello P, Levijoki J, et al. Two inotropes with different mechanisms of action: contractile, PDE-inhibitory and direct myofibrillar effects of levosimendan and enoximone[J]. J Cardiovasc Pharmacol, 2005, 46(3):369-376.
[14]Sato S, Talukder MA, Sugawara H, et al. Effects of levosimendan on myocardial contractility and Ca2+transients in aequorin-loaded right-ventricular papillary muscles and indo-1-loaded single ventricular cardiomyocytes of the rabbit[J]. J Mol Cell Cardiol, 1998, 30(6):1115-1128.
[15]Bartberger MD, Fukuto JM, Houk KN. On the acidity and reactivity of HNO in aqueous solution and biological systems[J]. Proc Natl Acad Sci U S A, 2001, 98(5):2194-2198.
(责任编辑: 陈妙玲, 罗森)
Effect of NCA on excitation-contraction coupling of cardiac muscle from phospholamban knockout mice
ZHONG Xin1, WANG Xi-yao2, LIANG Xiao-hui3, YANG Dong-xiao2, WANG Yu-wen2
(1DepartmentofPathophysiology,2Department,ClinicalLaboratory,TheSecondAffiliatedHospital,HarbinMedicalUniversity,Harbin150081,China;3DepartmentofRadiology,RedCrossCentralHospitalofHarbin,Harbin150001,China.E-mail:yuww060424@hotmail.com)
[ABSTRACT]AIM: Nitroxyl (HNO) increases myofilament Ca2+responsiveness relative to increases in intracellular Ca2+in cardiac muscle. In this study, we further investigated this effect of HNO on trabecular muscles from phospholamban knockout (PLB-KO) and wide-type (WT) mice using a novel HNO donor, 1-nitrosocyclohexyl acetate (NCA). METHODS: Trabecular muscles were dissected from the right ventricles of the rat hearts and mounted between a force transducer and a motor arm. The muscles were superfused with K-H solution (pH 7.4) at room temperature. Fura-2 was loaded into the trabecular muscles via electrophoresis. The length of the sarcomere was set to 2.2~2.3 μm. During steady-state activations, the maximal Ca2+-activated force and Ca2+required for 50% activation were measured. RESULTS: The intracellular Ca2+transients and force of the PLB-KO muscles at baseline were higher than those of the WT muscles and exhibited a negative force-frequency relationship (FFR). NCA (2.5 μmol/L) increased systolic force in both PLB-KO group and WT group at any given [Ca2+]o. However, there was more dramatic increase in the force development due to moderate increases in the intracellular Ca2+transients in the WT muscles when external Ca2+increased from 1.5 to 4.5 mmol/L under NCA. NCA did not affect the negative FFR in PLB-KO muscle. Steady-state force- Ca2+relations obtained from skinned muscles were not different between the 2 groups, while NCA increased Ca2+responsiveness in skinned muscles from both PLB-KO and WT mice.CONCLUSION: HNO increases force development in both PLB-KO and WT muscles as a result of increases in myofilament Ca2+responsiveness. The increased intracellular Ca2+transients are accompanied by greater force development in WT mice, suggesting that HNO improves Ca2+activation and establishes HNO as a positive inotropic agent with novel mechanisms.
[KEY WORDS]1-Nitrosocyclohexyl acetate; Nitroxyl; Calcium transients; Phopholamban
doi:10.3969/j.issn.1000- 4718.2016.03.006
[中图分类号]R329.21; R363
[文献标志码]A
通讯作者△Tel: 0451-86605075; E-mail: yuww060424@hotmail.com
*[基金项目]黑龙江省教育厅科学技术研究项目资助(No.12541384)
[收稿日期]2015- 07- 16[修回日期] 2016- 01- 05
[文章编号]1000- 4718(2016)03- 0418- 07
杂志网址: http://www.cjpp.net

