Livin基因修饰的骨髓间充质干细胞移植治疗对急性心肌梗死大鼠心功能的影响*
邹 兵, 谢军平, 吴清华△, 陈受琳, 肖鲁闽, 苏 海, 洪 葵, 吴延庆, 程晓曙
(南昌大学第二附属医院 1心血管内科, 2呼吸内科, 3麻醉科,江西 南昌 330006)
Livin基因修饰的骨髓间充质干细胞移植治疗对急性心肌梗死大鼠心功能的影响*
邹兵1,谢军平2,吴清华1△,陈受琳3,肖鲁闽1,苏海1,洪葵1,吴延庆1,程晓曙1
(南昌大学第二附属医院1心血管内科,2呼吸内科,3麻醉科,江西 南昌 330006)
[摘要]目的: 探讨livin修饰的骨髓间充质干细胞(MSCs)移植改善急性心肌梗死大鼠心功能的作用及livin和促凋亡蛋白caspase-3、caspase-7、caspase-9在感染后的表达情况。方法: 通过全骨髓培养法分离培养骨髓间充质干细胞,感染携带livin基因的重组腺病毒后用流式检测其对MSCs凋亡的影响。通过Western blot法分别检测livin、caspase-3、caspase-7和caspase-9的蛋白表达情况。采用冠状动脉左前降支结扎法建立心肌梗死模型,然后实验分4组进行:无胎牛血清的DMEM组;单纯干细胞治疗组(MSCs组);空载腺病毒转染干细胞组(rAd-control/MSCs)组;livin基因转染干细胞组(rAd-livin/MSCs组)。1个月后采用生理仪记录各组大鼠左室收缩压(LVSP)、左室舒张末压(LVEDP)、左室内压最大上升速率(+dp/dtmax)和左室内压最大下降速率(-dp/dtmax)来评价大鼠心功能。结果: rAd-livin/MSCs组凋亡率较MSCs组和rAd-control/MSCs组显著降低(P<0.05);rAd-livin/MSCs组抗凋亡蛋白livin明显上升(P<0.05),促凋亡蛋白caspase-3、caspase-7及caspase-9表达显著下降(P<0.05);细胞移植后1个月,rAd-livin/MSCs组心功能比MSCs组改善更明显(P<0.05)。结论: rAd-livin感染MSCs后可促进抗凋亡蛋白livin的表达,同时降低促凋亡蛋白caspase-3、caspase-7和caspase-9的表达及细胞凋亡率。rAd-livin/MSCs移植能进一步改善心肌梗死大鼠心功能。
[关键词]Livin基因; 间充质干细胞; 心肌梗死; 心功能
随着对急性心肌梗死(acute myocardial infarction,AMI)后再灌注治疗和药物治疗研究的进展,急性心肌梗死患者的生存率明显提高。但心肌梗死后,坏死心肌细胞不能再生而由纤维组织代替,由此可产生左心室重塑、心律失常和心力衰竭。虽然骨髓间充质干细胞(mesenchymal stem cells,MSCs)移植能改善心梗后心功能,但使用现有的方法移植到损伤局部组织的MSCs增殖能力有限[1],大部分细胞因环境不适而死亡,难以达到预期治疗效果。Livin是近年来发现的人类凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族的新成员。有研究显示livin抗凋亡作用强于其它IAP家族成员[2]。因此,本研究拟利用重组腺病毒把livin基因转移到MSCs中,并实现livin基因在MSCs中的表达,进而探讨livin基因修饰的大鼠骨髓MSCs移植后存活率及对心肌梗死大鼠心功能的影响。
材料和方法
1大鼠骨髓 MSCs的分离培养和扩增
无菌条件下取大鼠两侧股骨和胫骨,钳掉骨端,暴露骨髓腔,用5 mL注射器吸取含有20%胎牛血清的完全培养液4 mL冲出骨髓,收集在离心管中,用移液管反复吹打成单细胞悬液,移至培养瓶中。于48 h后半量换液, 5 d后全量换液,以后每2~3 d换液1次,待细胞生长至90%时,以1∶3传代,第3~5代培养的MSCs用于实验。
2实验方法
2.1流式细胞术检测rAd-livin 感染对MSCs凋亡的影响取第3代MSCs,至覆盖率达70%时,根据最佳的MOI值(1∶600)用rAd-livin或空载体腺病毒rAd-control(购自上海英潍捷基贸易有限公司)进行感染,感染24 h后换液,继续培养48 h,取rAd-livin/MSCs、rAd-control/MSCs及未感染的MSCs各1 mL(1×109/L),4 ℃ 1 000 r/min离心10 min,磷酸盐缓冲液冲洗,重复3次后将细胞重悬于200 μL结合缓冲液,加入10 μL Annexin V-FITC,避光反应15 min后,加入300 μL结合缓冲液和5 μL PI,经流式细胞仪检测,Cell Quest软件分析。
2.2Western blot检测抗凋亡蛋白livin及促凋亡蛋白caspase-3、caspase-7、caspase-9在细胞中的表达水平收集rAd-livin/MSCs、rAd-control/MSCs及未感染的MSCs提取蛋白。以考马斯亮蓝法测定蛋白浓度,SDS-聚丙烯酰胺凝胶电泳分离蛋白,电泳完毕,湿转至硝酸纤维素滤膜,50 g/L脱脂奶室温封闭2 h后,分别加入兔抗鼠livin、caspase-3、caspase-7和caspase-9 Ⅰ抗,室温孵育30 min,4 ℃过夜,TBST洗涤3次,每次10 min,加入辣根过氧化物酶标记的 II 抗(1∶3 000),室温孵育l h,TBST洗涤4次,每次15 min,ECL显影。以β-actin为内参照。用Quantity One软件对Western blot条带进行灰度分析。
2.3大鼠心肌梗死模型的制备及分组术前1 d禁食,取SD大鼠进行称重(250~300 g,由南昌大学实验动物中心提供),采用冠状动脉左前降支结扎法建立心肌梗死动物模型。心肌梗死模型成功15 min后,大鼠随机分为4组(每组15只),通过直视下分5点在心肌梗死区及其心梗交界区注射移植细胞。DMEM组注射无胎牛血清100 μL; MSCs组注射MSCs(100 μL,约l×106个细胞);rAd-control/MSCs组注射空载体感染的MSCs (100 μL,约l×106个细胞);rAd-livin/MSCs组注射 rAd-livin感染的MSCs (100 μL,约1×106个细胞)。注射后不缝心包,逐层缝合肌肉、皮肤。术后每只大鼠肌肉注射青霉素1×105U/d以预防感染,加强营养,维持1周。
2.4左心室功能的测定细胞移植4周后,用3%戊巴比妥钠麻醉大鼠,沿颈部正中切开,游离右颈总动脉,于远心端将颈动脉扎死,近心端将血流阻断,用手术剪在其中间呈45°朝近心端剪一个V字形切口,将20 G导管插入,恢复近心端的血流,进一步将导管插入左心室,另一端接上4道生理记录仪,记录大鼠最大左室收缩压(left ventricular systolic pressure,LVSP)、最大左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室内压最大上升速率(+dp/dtmax)和左室内压最大下降速率(-dp/dtmax);连续测取5次数据,每次间隔3 min,每1数据由3次较稳定数据求平均值作为结果。
3数据处理和统计学分析
用SPSS 17.0统计软件进行数据分析,所有计量资料以均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,组间两两比较采用SNK-q法,以P<0.05为差异有统计学意义。
结果
1转染后细胞凋亡率的变化
转染后rAd-livin组的细胞凋亡率较MSCs组降低(P<0.05),较rAd-control组显著降低(P<0.05),见图1。

Figure 1.The apoptotic rate of the MSCs detected by flow cytometry. Mean±SD.n=4.*P<0.05vsrAd-livin group.
图1经流式细胞术检测各组细胞凋亡情况
2转染后livin、caspase-3、caspase-7和caspase-9蛋白的表达
分别提取正常MSCs和经空载与目的基因转染处理后MSCs的蛋白,Western blot结果显示与MSCs和rAd-control组相比,rAd-livin组livin的表达显著增高(P<0.05),而caspase-3、caspase-7和caspase-9的表达明显下降(P<0.05),见图2。
3心功能测定结果
细胞移植4周后,用生理记录仪记录大鼠LVSP、LVEDP、+dp/dtmax和-dp/dtmax,其结果显示,rAd-livin/MSCs组、rAd-control/MSCs组和MSCs组的LVSP、LVEDP、 +dp/dtmax和-dp/dtmax较DMEM组都显著增加(P<0.05),rAd-livin/MSCs组较MSCs组增加更明显(P<0.05),见表1。
讨论
随着对危险因素的控制、药物与介入治疗,心肌梗死患者的生存数量与质量虽然得到了明显的提高与改善。然而,现有治疗方式并不能直接抑制心肌梗死患者的瘢痕形成与心室重构及其引起的心力衰竭与心律失常。通过干细胞移植可以稳定病损心脏结构,防止心肌重塑,避免导致充血性心衰,改善局部或总体心肌的收缩功能,干细胞移植治疗改善心功能成为一种新的治疗方式。然而,尽管在动物实验和临床实验都显示,干细胞移植能够改善心功能,但是移植后的干细胞注入心肌后其存活率很低[3],于是Saini等[4]将MSCs进行高压氧或凋亡蛋白酶抑制剂(CI)处理后再进行移植,结果显示无论是高压氧处理组还是CI组,其凋亡率都显著降低,而且同时进行高压氧和CI处理后,其凋亡率降低更显著,基因和蛋白表达检测表明其促凋亡蛋白caspase-1、-3、-6、-7和-9都显著降低,而保护性蛋白Akt、NF-κB和Bcl-2的表达则显著增加。Zhang等[5]则发现阿托伐他汀能够增加MSCs移植与成活率,且经阿托伐他汀处理后促凋亡蛋白Bim和Bax的表达降低,而抗凋亡蛋白Bcl-xL和Bcl-2的表达是增加的。Li等[6]将bcl-2基因修饰的MSCs移植入心肌梗死大鼠模型,发现Bcl-2能够增加移植后的MSCs的存活率,使得心功能明显改善。
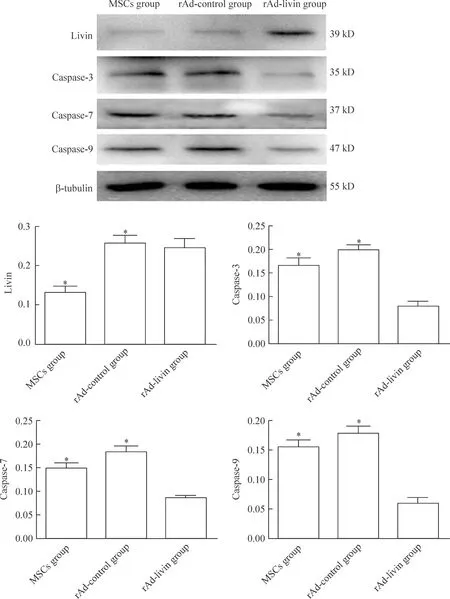
Figure 2.The expression of livin, caspase-3, caspase-7 and caspase-9 in MSCs after rAd-livin transfection. Mean±SD.n=4.*P<0.05vsrAd-livin group.
图2MSCs细胞在转染后livin、caspase-3、caspase-7和caspase-9蛋白的表达情况
表1移植后4周各组LVSP、LVEDP、 +dp/dtmax和-dp/dtmax的比较
Table 1.The comparison of LVSP, LVEDP, +dp/dtmaxand -dp/dtmaxbetween groups 4 weeks after transplantation (Mean±SD.n=11~13)

GroupLVSP(mmHg)LVEDP(mmHg)+dp/dtmax(mmHg/s)-dp/dtmax(mmHg/s)DMEM115.13±6.1114.66±0.955206.13±249.224275.10±362.15MSCs127.64±4.14*11.25±1.04*6837.08±220.78*5631.74±381.15*rAd-control/MSCs125.47±5.63*12.05±1.32*6516.33±229.17*5598.21±342.39*rAd-livin/MSCs138.12±4.86*#7.88±1.14*#7251.49±316.13*#6337.45±355.17*#
*P<0.05vsDMEM group;#P<0.05vsMSCs group.
Livin是近年来发现的人类IAP家族的新成员,其能够结合并抑制caspase-3、caspase-7和caspase-9的凋亡作用[7-9]。且有研究显示livin抗凋亡作用强于其它IAP家族成员[2]。
本实验通过重组腺病毒与抗凋亡基因livin重组后感染BMSCs,可使BMSCs的凋亡率降低,抗凋亡蛋白livin表达增加,而促凋亡蛋白caspase-3、caspase-7和caspase-9 的表达都下调。在心肌梗死大鼠体内的实验也证实转染目的基因后,能更好地改善心肌梗死大鼠的心功能,虽然作用机制及安全性仍需进一步的研究,但这不失为一种提高移植后MSCs存活率并进一步提高其改善心肌梗死心功能的方法。
[参考文献]
[1]Umezawa A, Terai M. Improvement of musculoskeletal function by cell-based therapy using mesenchymal stem cells with a prolonged life span[J]. Clin Calcium, 2005, 15(5):805-812.
[2]Kasof GM, Gomes BC. Livin, a novel inhibitor of apoptosis protein family member[J]. J Biol Chem, 2001, 276(5):3238-3246.
[3]Fisher SA, Doree C, Brunskill SJ, et al. Bone marrow stem cell treatment for ischemic heart disease in patients with no option of revascularization: a systematic review and meta-analysis[J]. PLoS One, 2013, 8(6):e64669.
[4]Saini U,Gumina RJ,Wolfe B, et al. Preconditioning mesenchymal stem cells with caspase inhibition and hyperoxia prior to hypoxia exposure increases cell proliferation[J]. J Cell Biochem, 2013, 114(11):2612-2623.
[5]Zhang Z, Li S, Cui M, et al. Rosuvastain enhances the therapeutic efficacy of adipose-derived mesenchymal stem cells for myocardial infarction via PI3K/Akt and MEK/ERK pathways[J]. Basic Res Cardiol, 2013, 108(2):333.
[6]Li W, Ma N, Ong LL, et al. Bcl-2 engineered MSCs inhibited apoptosis and improved heart function[J]. Stem Cells,2007, 25(8): 2118-2127.
[7]Schimmer AD. Inhibitor of apoptosis proteins: translating basic knowledge into clinical practice[J]. Cancer Res, 2004, 64(20):7183-7190.
[8]Liston P, Fong WG, Korneluk RG. The inhibitors of apoptosis: there is more to life than Bcl2[J]. Oncogene, 2003, 22(53):8568-8580.
[9]Nachmias B, Ashhab Y, Ben-Yehuda D. The inhibitor of apoptosis protein family (IAPs): an emerging therapeutic target in cancer[J]. Semin Cancer Biol, 2004, 14(4):231-243.
(责任编辑: 陈妙玲, 罗森)
Effect oflivin-modified BM-MSCs transplantation on cardiac function following acute myocardial infarction in a rat model
ZOU Bing1, XIE Jun-ping2, WU Qing-hua1, CHEN Shou-lin3, XIAO Lu-min1, SU Hai1, HONG Kui1, WU Yan-qing1, CHENG Xiao-shu1
(1DepartmentofCardiology,2DepartmentofRespiratory,3DepartmentofAnesthesiology,TheSecondAffiliatedHospital,NanchangUniversity,Nanchang330006,China.E-mail:ncwqh@163.com)
[ABSTRACT]AIM: To study the effect of livin gene-modified bone marrow mesenchymal stem cells (BM-MSCs) transplantation on the cardiac function following acute myocardial infarction in a rat model and the expression of livin, caspase-3, caspase-7 and caspase-9 in the livin gene-modified BM-MSCs. METHODS: The MSCs were obtained by the whole bone marrow culture method, and the apoptosis of the MSCs after infection with adenovirus vector carrying enhanced green fluorescent protein (EGFP) gene and livin recombinant vector (rAd-livin) were detected by flow cytometry. The expression of livin, caspase-3, caspase-7 and caspase-9 was detected by Western blot. After permanent left anterior descending artery occlusion, the rats were randomized to receive intramyocardial injection of DMEM without cells (vehicle group), or containing MSCs (MSCs group), MSCs (EGFP) (rAd-control/MSCs group) or MSCs (livin) (rAd-livin/MSCs group). Left ventricular systolic pressure (LVSP), left ventricular end-diastolic pressure (LVEDP), the maximum increased rate of left ventricular pressure (-dp/dtmax) and the maximum decline rate of left ventricular pressure (+dp/dtmax) were recorded for evaluating the cardiac functions. RESULTS: The apoptosis of rAd-livin/MSCs was significantly decreased as compared with MSCs and rAd-control/MSCs (P<0.05). Meanwhile, the expression of caspase-3, caspase-7 and caspase-9 was significantly downregulated as compared with the other 2 groups (P<0.05). The cardiac function in rAd-livin/MSCs group was significantly improved as compared with DMEM group, and those in the other 2 groups got the similar results, but the function in rAd-livin/MSCs group was better improved. Meanwhile, the number of surviving cells in rAd-livin/MSCs group was significantly improved as compared with the other 2 groups. CONCLUSION: The apoptosis of MSCs is decreased after rAd-livin transfection, and the expression of caspase-3, caspase-7 and caspase-9 is also significantly downregulated while the expression of livin is significantly upregulated. Transplantation of livin-modified BM-MSCs by lentiviral vector results in better prognosis for treating myocardial infarction by enhancing cell survival.
[KEY WORDS]Livin gene; Mesenchymal stem cells; Myocardial infarction; Cardiac function
doi:10.3969/j.issn.1000- 4718.2016.03.025
[中图分类号]R363
[文献标志码]A
通讯作者△Tel: 0791-86263601; E-mail: ncwqh@163.com
*[基金项目]江西省自然科学基金资助项目(No.20122BAB205028)
[收稿日期]2015- 07- 27[修回日期] 2015- 12- 30
[文章编号]1000- 4718(2016)03- 0539- 05
杂志网址: http://www.cjpp.net

