雷竹克隆系统出笋期有机碳分布变化规律
冀琳珂,谢锦忠,张 玮,卢 鹏,张 磊
中国林业科学研究院亚热带林业研究所,杭州 311400
雷竹克隆系统出笋期有机碳分布变化规律
冀琳珂,谢锦忠*,张 玮,卢 鹏,张 磊
中国林业科学研究院亚热带林业研究所,杭州 311400
植物光合碳同化物为植物的生长提供所需的物质和能量。目前,对植物有机碳分布虽已展开了大量研究,但对竹类植物出笋期有机碳转移机制的研究还比较缺乏。测定了分株数量为单株、双株和三株的雷竹克隆系统出笋期分株各器官的有机碳含量,以期进一步了解雷竹克隆系统出笋期有机碳转移变化规律。研究发现:雷竹分株不同器官有机碳含量差异显著,且在出笋期发生显著变化,出笋前:枝(52.64%)>叶(47.18%)>秆(40.98%)>鞭(40.13%)>根(35.14%),出笋完成后:枝(48.20%)>秆(47.84%)>叶(45.53%)>鞭(45.52%)>根(44.29%),枝、叶有机碳含量呈先下降后上升趋势,根、秆、鞭有机碳含量呈“N”型变化规律;单株、多株系统雷竹分株各器官有机碳含量降幅与出笋量成反比,随分株数量增加,出笋量增加,而各器官有机碳含量降幅减小;双株系统中1年生雷竹各器官有机碳含量降幅大于2年生竹,三株系统中3年生雷竹各器官有机碳含量降幅大于1年、2年生竹。这些结果表明:出笋影响雷竹各器官有机碳分配格局,出笋时各器官间有机碳资源发生转移,其中枝、叶有机碳含量降低而根、秆、鞭有机碳含量增加;各器官间源-汇关系发生变化,分株间有机碳资源存在共享,分株数量增加出笋量增加且系统内分株的损耗减小;分株年龄是影响雷竹不同器官出笋期有机碳含量变化的影响因素之一。因此,调整雷竹林年龄结构对提高雷竹林出笋量及经济效益有十分重要的现实意义。
雷竹;克隆系统;出笋期;有机碳分配格局
碳是重要的生命元素,是植物光合作用形成有机质不可或缺的元素之一。叶片是植物进行光合作用的主要场所(源),根、种子、果实等是消耗或贮存同化物的器官(汇),同化物在源-汇间的运输和再分配是植物生存、生长、繁殖的物质基础[1]。植物年龄不同、发育阶段不同,不同功能器官的源-汇关系会发生改变,碳素资源的分配格局可能会不同[2]。不同植物、不同器官、植物的木质组成、各器官相对位置以及气候、温湿度、地区差异、立地条件、年龄等均会影响植物内部有机碳分配格局[3- 5],近年来的研究表明:温带树种的含碳率范围为47.1%—51.4%[6],思茅松(PinusKesiyavar.langbianensis)人工中、幼龄林树干的含碳率显著高于其他器官,且由基部向上呈下降的趋势[7],人工红松(Pinuskoraiensis)林单株而言枝含碳率高于根含碳率[8]。
克隆植物在源-汇关系驱动下物质或资源可以通过连接物或间隔子在克隆分株间进行运输与分享[9- 10],因此,克隆植物各分株不但在垂直方向存在碳素源-汇关系,同时在水平方向相连的分株间也存在源-汇关系[11- 14]。克隆植物具有克隆整合、克隆可塑性及克隆繁殖等独特的生长、发育、繁殖方式[15],并且通过生理整合能够对所获取资源进行再分配[16],因此克隆分株间的碳素分布、整合格局及对不同程度的环境因子(如温、光、水、肥等)的各种响应机制及表征方式成为克隆植物生态学集中研究的重点问题[17- 18]。近年来对克隆植物的碳素分布及整合研究表明:毛竹(Phyllostachysedulis)各器官含碳率:枝>秆>叶>鞭>根[19];苦竹(Pleiobtastusamarus)各器官含碳率:秆>枝>叶>鞭>根[20];羊草(Leymuschinensis)的某些分株经受遮光和去叶干扰处理时,未被干扰的分株都能向干扰分株转移碳物质;对羊柴(Hedysarumlaeve)分株进行去叶处理时发现,去叶子株从未去叶母株获得的同化物相对于对照的未去叶分株有所增加[21];对结缕草(ZoysiajaponicaSteud)匍匐茎进行连接与切断对比试验,发现分株数量对其形态学指标均有显著促进作用[22],分株年龄是决定处于生长发育早期的欧亚活血丹(Glechomalongituba)分株间碳素源-汇关系的主要因素[23];聚花过路黄(Lysimachiacongestiflora)的分株种群密度及生物量随光照增强显著增加;局部遮光可以改变林生山黧豆(Lathyrussylvestris)光合产物的整合格局[24];模拟增温研究发现草本克隆植物地上生物量及叶片干质量都随着温度的升高而增加[25];在一定范围内随着水分的增加,草本克隆植物种群的叶片生物量占整个地上生物量的百分比显著增加[26]。
竹子是典型的木本克隆植物,具有很强的生理整合作用和异质环境适应能力,竹子通过生理整合作用即可通过相连分株间同化物、养分的传输对所获得的碳素资源进行再分配,从而提高整个系统的适合度。 目前关于植物有机碳分配格局的研究主要集中于针、阔叶乔、灌木树种[27]及草本型克隆植物,对竹类木本克隆植物有机碳的研究较少,且主要集中于单株或林分碳储量的研究,包括基于不同的模型比较和估计竹林的碳储量及不同类型森林系统中竹类植物碳储量的变化[28- 31],以及非结构性碳及地上生物量分配的研究[19,32],对于笋期克隆系统间碳素传导及源-汇关系变化引起的碳流动研究尚不多见。雷竹(Phyllostachysviolascens)是我国竹类资源中重要的笋用竹种,属中、小型散生竹,出笋早、笋期长、笋味鲜美、产量高、经济效益好,是浙江省笋用竹主产区主栽竹种之一。雷竹出笋生长迅速,从出笋到幼竹形成仅需40—60 d,研究笋-幼竹快速生长期的有机碳分布变化、转移机制,对于竹子的生存、生长、繁殖扩张和资源利用等具有重要的生态学意义,对调整林分结构、合理培育竹林具有重要的现实意义。因此,本文以切断试验法[33]切鞭,湿烧法[17]测定出笋不同时期雷竹各器官有机碳含量,旨在探讨:雷竹不同器官有机碳分配格局及源-汇关系驱动下不同分株数的雷竹克隆系统出笋期碳素分配转移规律,以期为雷竹林的合理经营提供一定的理论基础。
1 材料与方法
1.1 研究区概况
试验地区位于浙江省杭州市富阳区春建乡云二村(119°57′E,30°03′N)。气候属亚热带季风气候,四季分明,降水充沛,光照充足,温和湿润,气候垂直变化明显。年均温度16.3 ℃,年均降水量1479.3 mm,年日照时数1759.2 h,无霜期约238 d。
1.2 研究方法
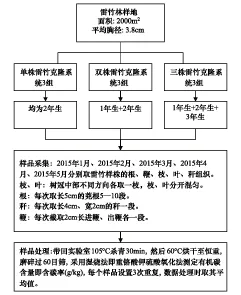
图1 试验研究方法Fig.1 Study method of experiment
2015年1月,在试验区选择生长良好的雷竹林地,在样地内选择地下鞭系相连的雷竹克隆系统进行切鞭处理,选取分株数量分别为单株、双株和三株的克隆系统各3组,切鞭时进鞭、出鞭各保留50 cm以上, 鞭全长为2 m左右,单株克隆系统雷竹年龄均为2年生,双株克隆系统为1年生、2年生雷竹各1株,三株克隆系统为1年生、2年生、3年生雷竹各1株。所选雷竹生长健壮,秆通直圆满,无疤结、无损伤、胸径径阶为4 cm。具体实验过程见图1。
1.3 数据处理与分析
实验数据在Excel 2003统计软件中进行整理和图表制作,重复测量方差分析采用SPSS 19.0统计软件中的one-way repeated measures ANOVA方法,多重比较采用Duncan方法完成。所有测定值均为平均值±标准偏误差。
2 结果分析
2.1 雷竹克隆系统中各器官有机碳含量变化规律
出笋前各器官含碳率分配格局:枝(52.64%)>叶(47.18%)>秆(40.98%)>鞭(40.13%)>根(35.14%)。出笋完成后各器官含碳率分配格局:枝(48.20%)>秆(47.84%)>叶(45.53%)>鞭(45.52%)>根(44.29%)。出笋前后,各器官碳素分布格局发生变化,枝、叶含碳率降低,根、秆、鞭含碳率升高。
采用重复测量法分析出笋期不同分株数雷竹克隆系统各器官有机碳含量结果显示,单株、双株、三株雷竹克隆系统有机碳含量随时间变化差异均显著,各系统中雷竹分株不同器官间有机碳含量差异均显著,处理时间及分株器官对各系统有机碳含量均有交互作用,即各系统有机碳含量随着处理时间的变化而变化,并且时间因素因器官的不同而不同(表1)。
不同分株数雷竹克隆系统立竹器官有机碳含量的多重比较表明,单株雷竹克隆系统中雷竹各器官有机碳含量:枝>秆>鞭>叶>根;其中枝有机碳含量显著高于叶、秆、鞭,枝、叶、秆、鞭有机碳含量显著高于根;双株雷竹克隆系统中雷竹各器官有机碳含量:枝>叶>秆>鞭>根,其中枝、叶、根、秆有机碳含量显著高于根;三株雷竹克隆系统中雷竹各器官有机碳含量:枝>叶>秆>鞭>根;其中枝有机碳含量显著高于叶、秆、鞭,枝、叶、秆、鞭有机碳含量显著高于根(表2)。
表1 不同分株数雷竹克隆系统各器官有机碳含量重复测量方差分析结果
Table 1 ANOVA for repeated measurements in organic carbon content of the various organs in different rametsPhyllostachysviolascenssystem
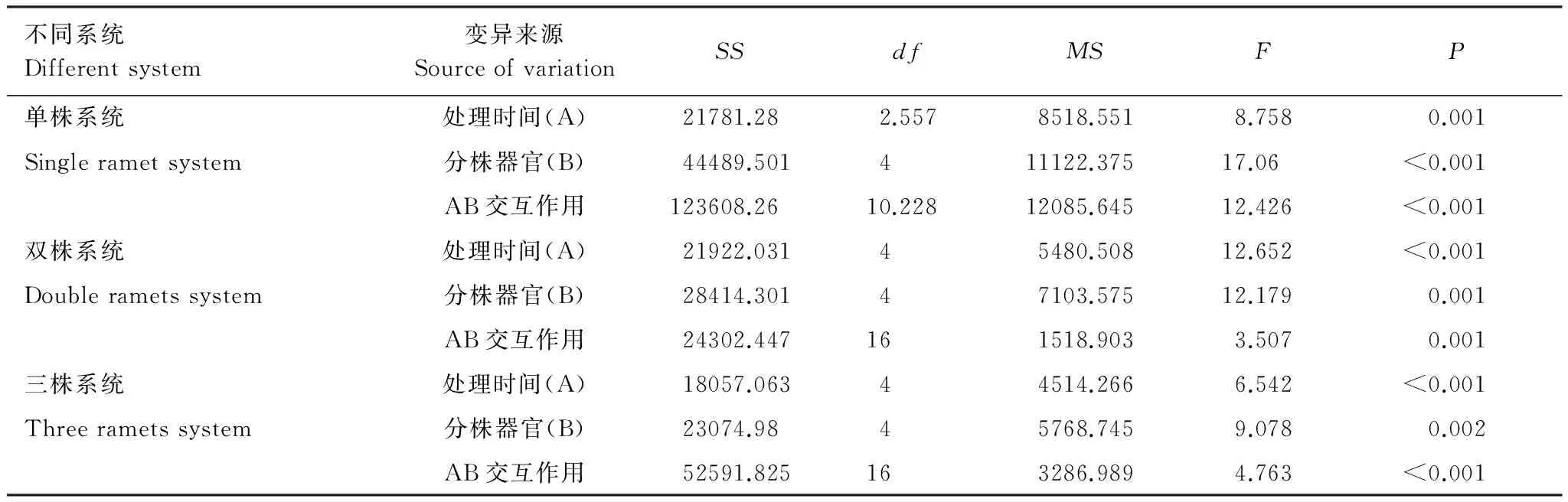
不同系统Differentsystem变异来源SourceofvariationSSdfMSFP单株系统处理时间(A)21781.282.5578518.5518.7580.001Singlerametsystem分株器官(B)44489.501411122.37517.06<0.001AB交互作用123608.2610.22812085.64512.426<0.001双株系统处理时间(A)21922.03145480.50812.652<0.001Doublerametssystem分株器官(B)28414.30147103.57512.1790.001AB交互作用24302.447161518.9033.5070.001三株系统处理时间(A)18057.06344514.2666.542<0.001Threerametssystem分株器官(B)23074.9845768.7459.0780.002AB交互作用52591.825163286.9894.763<0.001
SS: 离差平方和;df: 自由度;MS: 均方
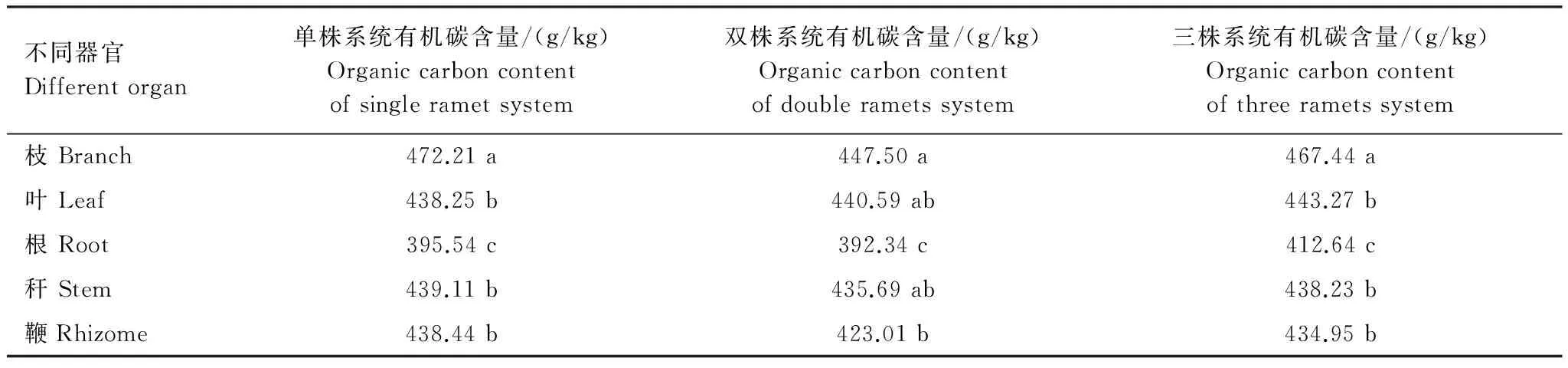
表2 不同分株数雷竹克隆系统中各器官出笋期有机碳含量差异性比较
*小写字母表示同一系统不同器官比较; 不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)
由图2可知,出笋期雷竹克隆系统中不同器官有机碳含量变化规律不同,随处理时间的延长,枝、叶有机碳含量呈现先降低后升高的趋势,根、秆、鞭有机碳含量呈“N”型变化趋势;如图1所示,单株雷竹克隆系统中,出笋前(1月)各器官有机碳含量差异显著,各器官有机碳含量依次为:枝>叶>秆>鞭>根;随出笋开始,雷竹枝、叶有机碳含量显著降低,根、秆、鞭有机碳含量显著升高,至3月份根、秆、鞭有机碳含量已显著高于枝、叶;随出笋期延长,雷竹各器官有机碳含量差异减小,至5月份笋期结束,除根外其余器官有机碳含量无显著差异,各器官有机碳含量依次为:枝>秆>鞭>叶>根。
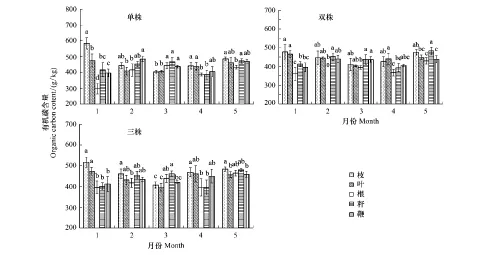
图2 雷竹克隆系统各器官出笋期有机碳含量Fig.2 The organic carbon content of different organs in different phyllostachys violascens system字母表示同一时期同一系统内不同器官比较;不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)
双株雷竹克隆系统中(图2),出笋前(1月)各器官有机碳含量差异显著,各器官有机碳含量依次为:枝>叶>秆>鞭>根;随出笋开始,雷竹枝、叶有机碳含量显著降低,根、秆、鞭有机碳含量显著升高,至3月份秆、鞭有机碳含量已显著高于枝、叶、根;随出笋期延长,雷竹枝、叶有机碳含量逐渐上升而根、秆、鞭有机碳含量逐渐降低,至4月份枝、叶有机碳含量显著高于根、秆、鞭;随出笋期结束,各器官有机碳含量均有所上升,至5月份笋期结束,各器官有机碳含量依次为:秆>枝>叶>鞭>根。
三株雷竹克隆系统中(图2),出笋前(1月)枝、叶有机碳含量显著高于根、秆、鞭,各器官有机碳含量依次为:枝>叶>鞭>秆>根;随出笋开始,雷竹枝、叶有机碳含量显著降低,根、秆、鞭有机碳含量显著升高,至3月份根、秆、鞭有机碳含量已显著高于枝、叶;随出笋期延长,雷竹枝、叶有机碳含量逐渐上升而根、秆、鞭有机碳含量逐渐降低,至4月份枝、叶有机碳含量高于根、秆、鞭;随出笋期结束,各器官有机碳含量均有所上升,至5月份笋期结束,各器官有机碳含量无显著差异,有机碳含量依次为:枝>秆>根>叶>鞭。
上述结果表明,雷竹不同器官有机碳含量分布格局为出笋前:枝>叶>秆>鞭>根,出笋完成后:枝>秆>叶>鞭>根,枝、叶有机碳含量显著降低,根、秆、鞭有机碳含量显著升高,不同雷竹克隆系统中各器官有机碳含量差异均显著。不同分株雷竹克隆系统笋期各器官有机碳含量发生显著变化,枝、叶有机碳含量均呈先降低后升高趋势,根、秆、鞭有机碳含量均呈“N”型变化规律,但变化时期不尽相同,说明出笋影响雷竹各器官的有机碳含量分布,出笋期各器官间源-汇关系格局发生变化,雷竹不同器官间碳素资源在源-汇关系驱动下发生转移,使各器官有机碳分布格局发生变化。
2.2 不同分株系统雷竹克隆系统有机碳含量变化规律分析
采用重复测量法分析不同分株数雷竹克隆系统出笋期各器官有机碳含量结果表明(表3):雷竹克隆系统中枝、叶、根、秆、鞭各器官有机碳含量随时间变化差异均显著(P<0.05),不同系统间,鞭有机碳含量差异显著,其他器官均无显著差异。不同分株数与监测时间对枝、根有机碳含量有交互作用,对叶、秆、鞭无交互作用,即各器官有机碳含量随笋期延长而不同,并且时间因素因分株数量不同而不同。
表3 不同分株数雷竹克隆系统各器官有机碳含量重复测量方差分析结果
Table 3 ANOVA for repeated measurements in organic carbon content of the various organs in different rametsPhyllostachysviolascenssystem
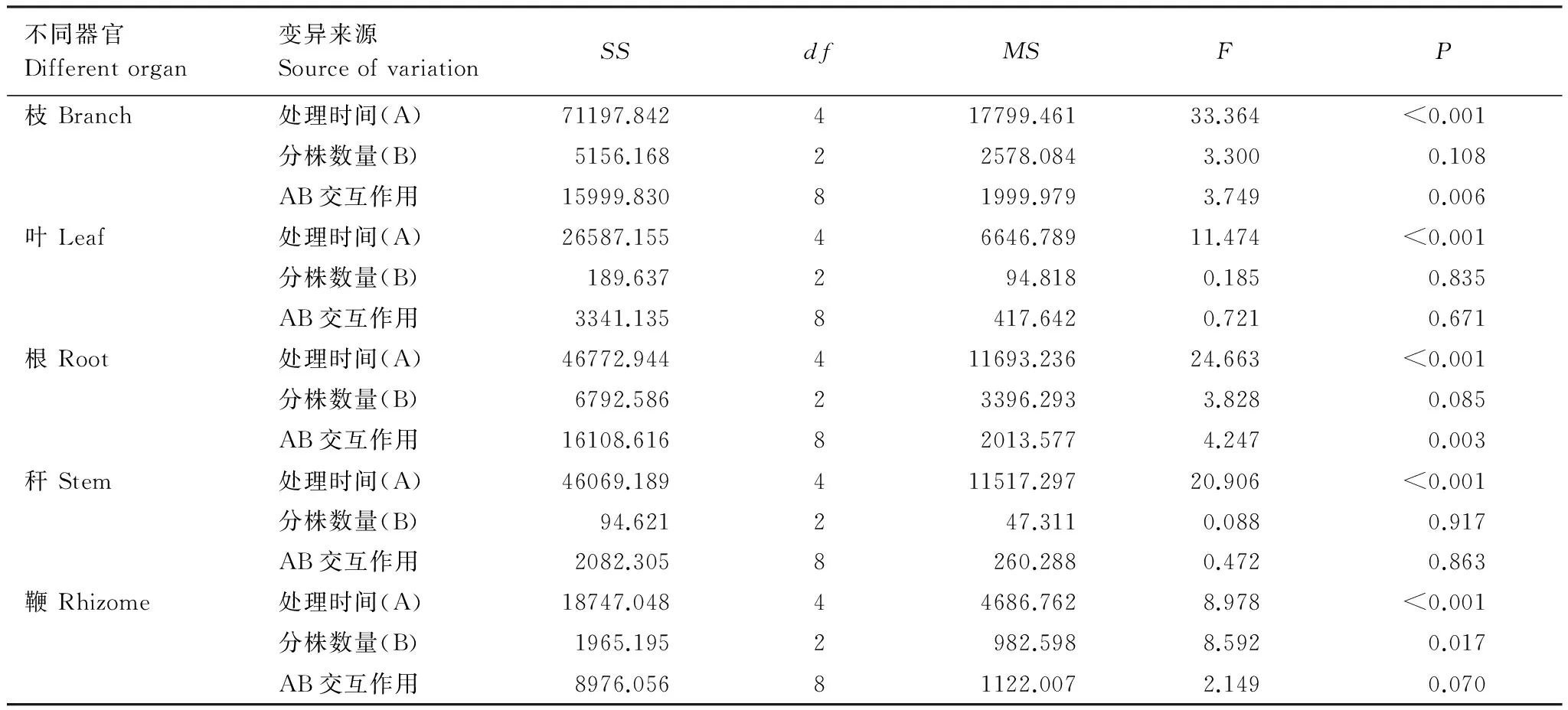
不同器官Differentorgan变异来源SourceofvariationSSdfMSFP枝Branch处理时间(A)71197.842417799.46133.364<0.001分株数量(B)5156.16822578.0843.3000.108AB交互作用15999.83081999.9793.7490.006叶Leaf处理时间(A)26587.15546646.78911.474<0.001分株数量(B)189.637294.8180.1850.835AB交互作用3341.1358417.6420.7210.671根Root处理时间(A)46772.944411693.23624.663<0.001分株数量(B)6792.58623396.2933.8280.085AB交互作用16108.61682013.5774.2470.003秆Stem处理时间(A)46069.189411517.29720.906<0.001分株数量(B)94.621247.3110.0880.917AB交互作用2082.3058260.2880.4720.863鞭Rhizome处理时间(A)18747.04844686.7628.978<0.001分株数量(B)1965.1952982.5988.5920.017AB交互作用8976.05681122.0072.1490.070
不同分株系统中各器官有机碳含量随出笋期延长发生变化,由表4可知,单株、双株、三株雷竹克隆系统枝有机碳含量1月份单株系统显著高于双株、三株系统,其他时期无显著差异;叶、秆有机碳含量笋期无显著差异;根有机碳含量1月份差异显著,三株系统高于单、双株系统,2月份无显著差异,3月份双株系统显著高于单、三株系统,4月份无显著差异,至5月份三株系统显著高于单、双株系统;鞭有机碳含量出笋前各系统无显著差异,2月份单株系统显著高于双株、三株系统,随笋期延长至出笋完成各系统无显著差异。
由表4可得,单株系统各器官含碳率降幅:枝(17.99%)>秆>鞭>叶>根(5.61%);双株系统各器官含碳率降幅:枝(6.65%)>叶>秆>根>鞭(3.51%);三株系统各器官含碳率降幅:枝(10.99%)>叶>秆>根>鞭(1.44%)。总体来讲,不同分株数雷竹克隆系统各器官有机碳含量降幅:单株系统>多株系统。不同分株数雷竹克隆系统出笋的含碳量不同,单株系统(24.62g)<双株系统(29.30g)<三株系统(44.55g),由此可知,单株雷竹克隆系统与多株克隆系统间各器官有机碳含量降幅与出笋量成反比。
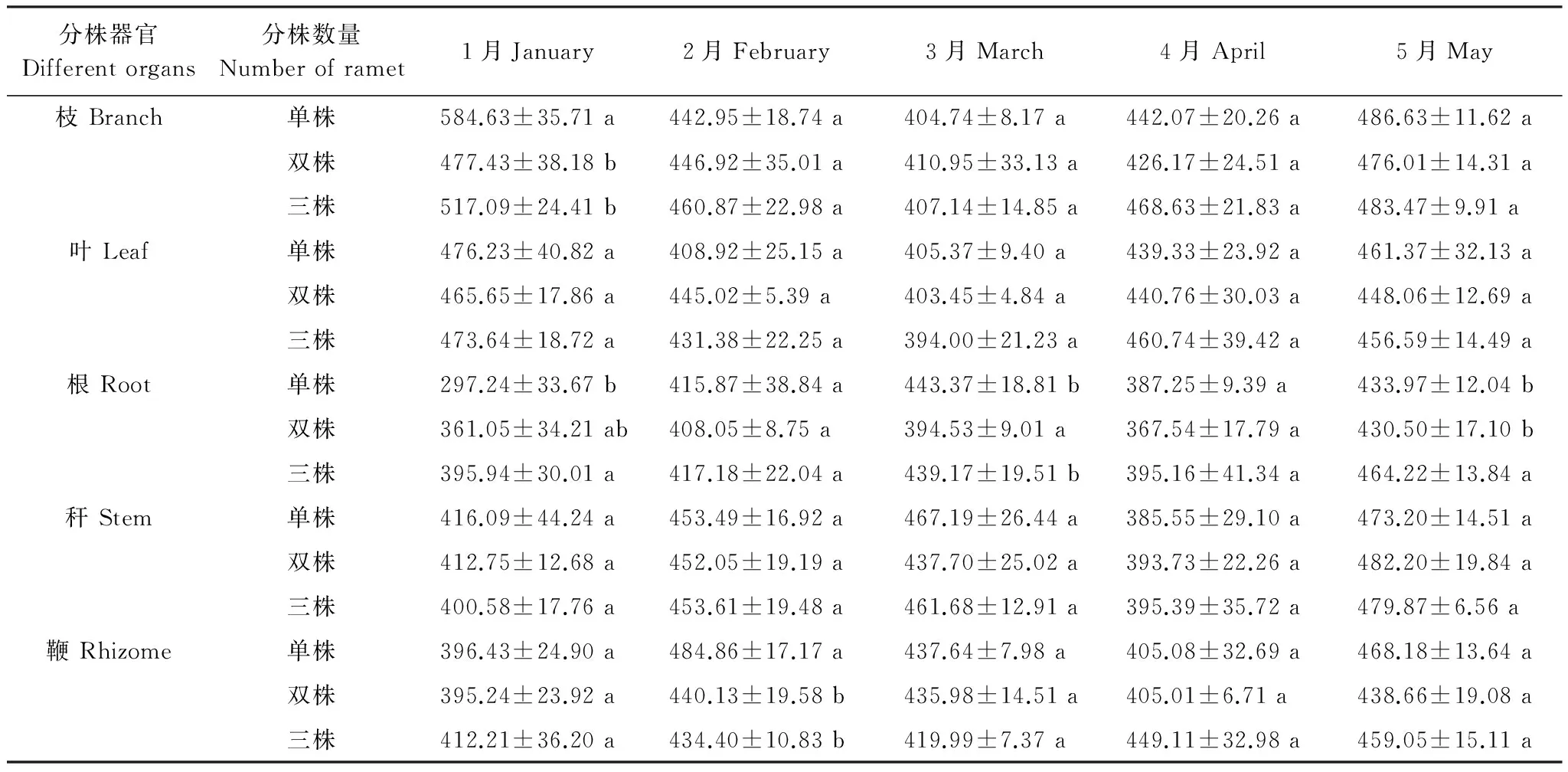
表4 不同分株数雷竹克隆系统各器官出笋期有机碳含量/(g/kg)
上述结果表明,笋期叶、秆有机碳含量不同分株数雷竹克隆系统间无显著差异,枝、根、鞭有机碳含量不同分株数雷竹克隆系统在出笋不同时期存在显著差异。单株雷竹克隆系统和多株雷竹克隆系统间各器官有机碳含量降幅与出笋量成反比,即随克隆分株数量增加,出笋量增加,而系统内分株各器官有机碳含量降幅减小,不同雷竹克隆系统分株数量影响雷竹各器官有机碳含量变化。
2.3 多株雷竹克隆系统不同年龄分株有机碳分布变化规律
采用单因素重复测量法分析双株、三株雷竹克隆系统中不同年龄分株出笋期各器官有机碳含量,结果如表5所示,双株、三株系统各器官出笋不同阶段有机碳含量差异均显著。双株系统中不同年龄雷竹鞭出笋期有机碳含量差异显著,其它器官则差异不显著;监测时间与分株年龄对根、秆有机碳含量有交互作用,即根、秆的有机碳含量随时间变化而变化,且时间因素随雷竹克隆分株系统的不同而不同,对其他器官有机碳含量则无交互作用。三株系统中不同年龄雷竹枝、秆、鞭出笋期有机碳含量差异显著,叶、根出笋期有机碳含量差异则不显著;监测时间与分株年龄对叶、根、秆出笋期含碳量变化有交互作用,对其他器官则无交互作用。
表5 不同年龄雷竹克隆分株各器官有机碳含量重复测量方差分析结果
Table 5 ANOVA for repeated measurements in organic carbon content of the various organs in different rametsPhyllostachysviolascenssystem
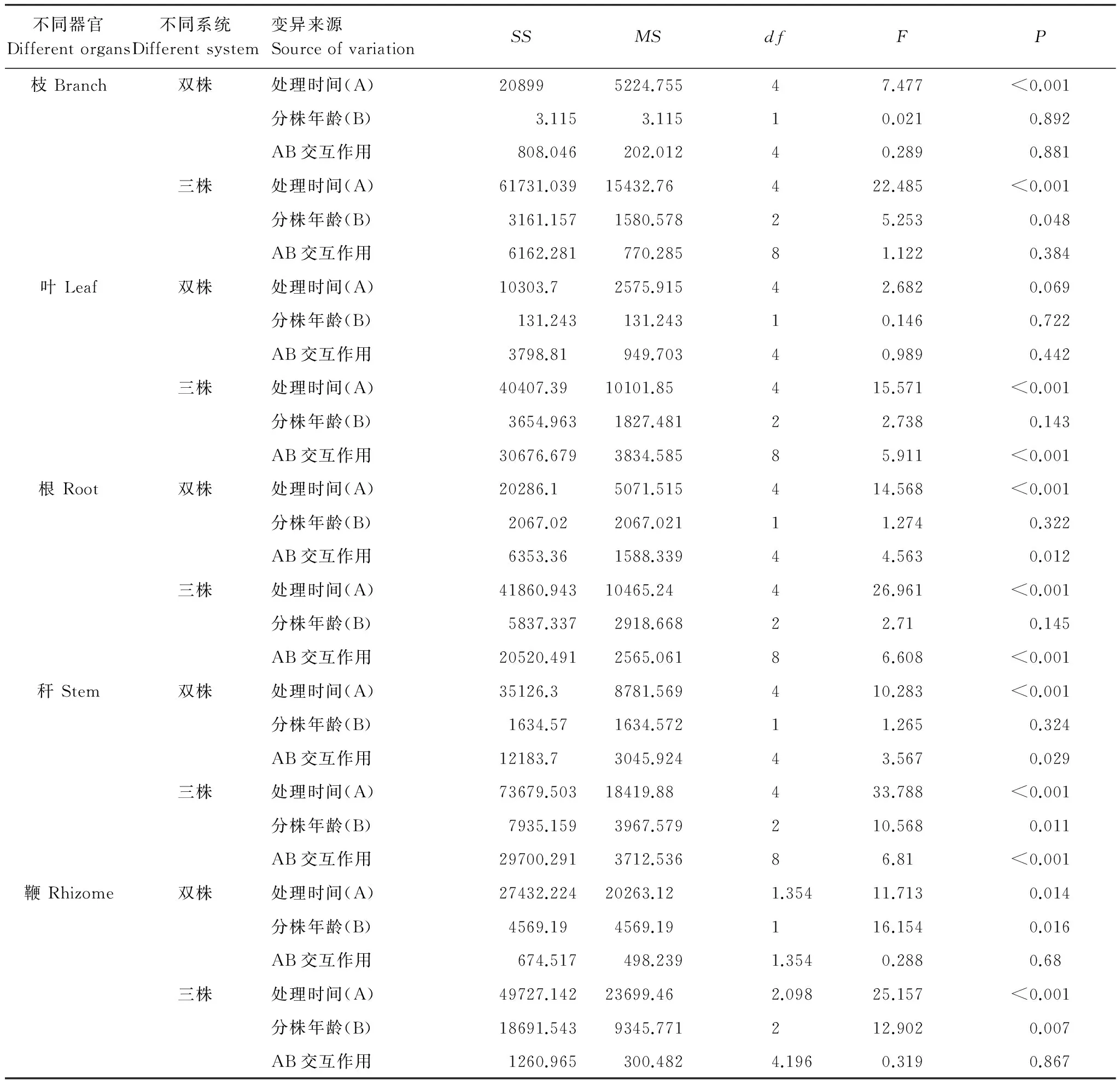
不同器官Differentorgans不同系统Differentsystem变异来源SourceofvariationSSMSdfFP枝Branch双株处理时间(A)208995224.75547.477<0.001分株年龄(B)3.1153.11510.0210.892AB交互作用808.046202.01240.2890.881三株处理时间(A)61731.03915432.76422.485<0.001分株年龄(B)3161.1571580.57825.2530.048AB交互作用6162.281770.28581.1220.384叶Leaf双株处理时间(A)10303.72575.91542.6820.069分株年龄(B)131.243131.24310.1460.722AB交互作用3798.81949.70340.9890.442三株处理时间(A)40407.3910101.85415.571<0.001分株年龄(B)3654.9631827.48122.7380.143AB交互作用30676.6793834.58585.911<0.001根Root双株处理时间(A)20286.15071.515414.568<0.001分株年龄(B)2067.022067.02111.2740.322AB交互作用6353.361588.33944.5630.012三株处理时间(A)41860.94310465.24426.961<0.001分株年龄(B)5837.3372918.66822.710.145AB交互作用20520.4912565.06186.608<0.001秆Stem双株处理时间(A)35126.38781.569410.283<0.001分株年龄(B)1634.571634.57211.2650.324AB交互作用12183.73045.92443.5670.029三株处理时间(A)73679.50318419.88433.788<0.001分株年龄(B)7935.1593967.579210.5680.011AB交互作用29700.2913712.53686.81<0.001鞭Rhizome双株处理时间(A)27432.22420263.121.35411.7130.014分株年龄(B)4569.194569.19116.1540.016AB交互作用674.517498.2391.3540.2880.68三株处理时间(A)49727.14223699.462.09825.157<0.001分株年龄(B)18691.5439345.771212.9020.007AB交互作用1260.965300.4824.1960.3190.867
如表6所示,分析双株、三株雷竹克隆系统中不同年龄雷竹分株各器官有机碳含量可知,出笋前(1月),双株系统中不同年龄分株仅鞭有机碳含量差异显著,而三株系统中叶、根、鞭不同年龄分株差异显著,不同器官差异性不同。随笋期延长,双株、三株系统中不同年龄分株各器官有机碳含量差异性发生变化。由表6可知,出笋期,各器官有机碳含量均有先降低再升高趋势,双株系统中1年生雷竹各器官含碳率降幅:枝(8.71%)>秆(7.48%)>根(4.75%)>鞭(4.38%)>叶(3.59%);2年生雷竹各器官含碳率降幅:枝(6.78%)>鞭(4.49%)>根(3.93%)>秆(3.55%)>叶(2.57%)。总体来讲,1年生雷竹出笋期有机碳含量降幅大于2年生竹。三株系统中,1年生雷竹各器官含碳率降幅:秆(12.46%)>枝(9.26%)>根(7.07%)>叶(4.16%)>鞭(3.37%);2年生雷竹各器官含碳率降幅:枝(11.52%)>叶(9.23%)>根(4.59%)>秆(3.53%)>鞭(3.11%);3年生雷竹各器官含碳率降幅:叶(15.05%)>枝(12.2%)>秆(7.83%)>根(7.38%)>鞭(4.83%)。总体来讲,同一器官不同年龄出笋时有机碳含量降幅为3年生雷竹降幅大于1年、2年生竹,表明同一系统中分株年龄影响出笋时各器官有机碳含量变化量。
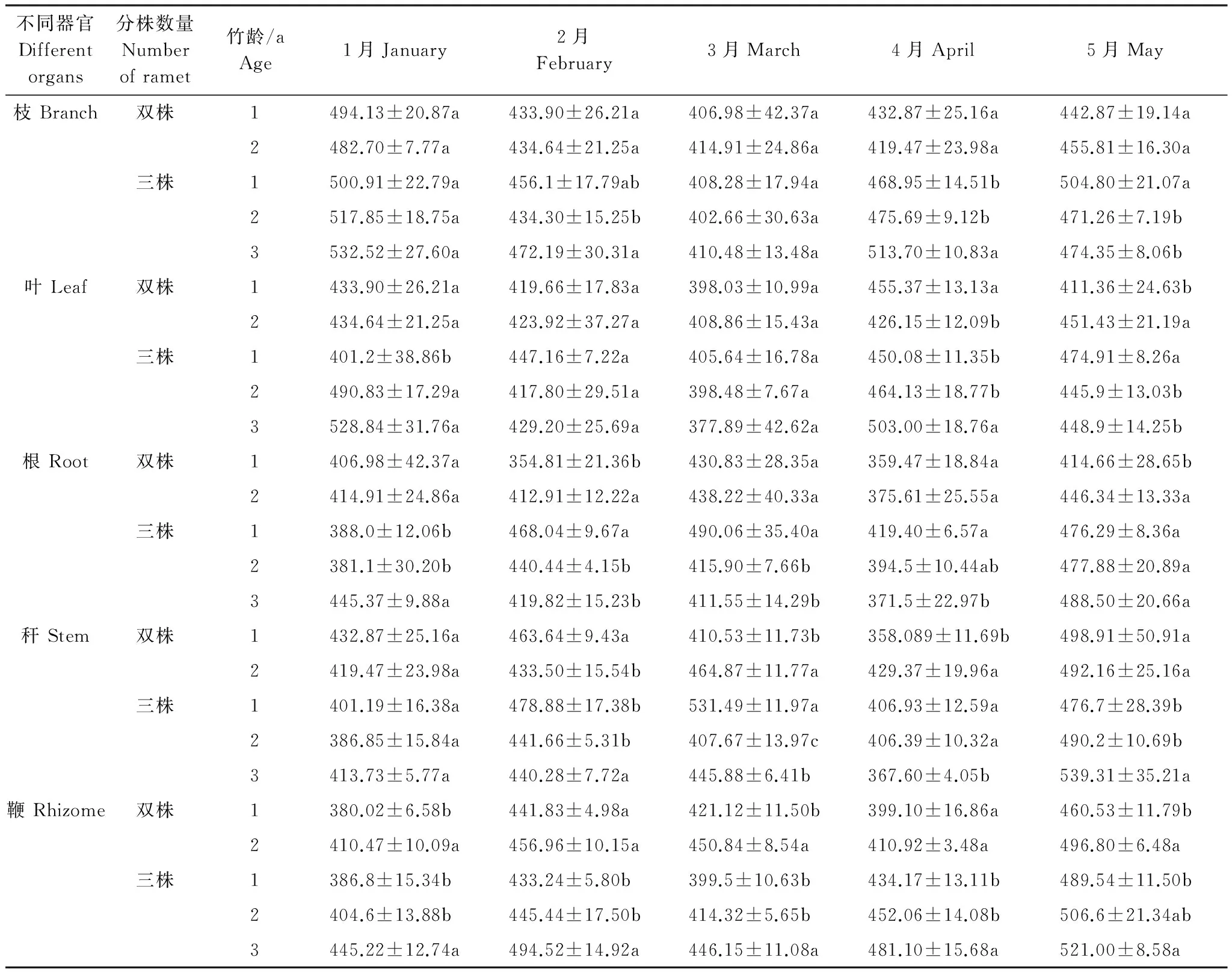
表6 不同分株数雷竹克隆系统不同年龄雷竹各器官有机碳含量/(g/kg)
上述结果表明,多株雷竹克隆系统中不同年龄分株有机碳含量变化量不同,双株系统中1年生雷竹各器官有机碳含量降幅大于2年生竹,三株系统中3年生雷竹各器官有机碳含量降幅大于1年、2年生竹,说明分株年龄是影响雷竹不同器官对出笋响应有机碳含量变化的因素之一。
3 结论与讨论
克隆植物具有生理整合、克隆生长等独特生态适应特性[34- 36],在异质环境条件下,这种特性会体现得更加明显[37]。碳素或光合产物在克隆植物分株间的分配是其生理整合过程中非常重要的一部分,由于特殊的生长、繁殖方式,使得克隆植物的碳素分配格局更加复杂[38]。克隆植物种类不同、所处的生境及发育阶段不同,其碳素的分配格局也可能不同[1]。本研究发现,雷竹不同器官有机碳含量范围为:35.14%—52.64%,大小顺序依次为:枝(52.64%)>叶(47.18%)>秆(40.98%)>鞭(40.13%)>根(35.14%),这与王兵等[39]研究的毛竹各器官含碳率介于42.22%—47.53%,各器官大小顺序依次为:秆(47.53%)>枝(46.49%)>鞭(46.10%)>根(45.30%)>叶(42.22%)不同,由此可以看出,各器官碳含量的分配格局因竹种的不同而存在差异。
同种克隆植物的碳素整合格局会因环境资源条件及植株生长发育阶段等因素的不同发生适应性调整或改变[40],研究表明随光照强度增加,华西箭竹(Fargesianitida)的生物量积累逐渐增大[41],本研究表明出笋生长影响雷竹克隆系统中分株各器官碳素分配格局,各器官间有机质资源发生转移,出笋生长使雷竹无性系种群产生生理整合的响应。理论上,竹林出笋时会造成种群资源损耗,种群通过提高生产强度以应对这种损耗,3—4月为出笋期,由于此时环境温度低,光照较弱,光合作用固定同化物能力较弱,而出笋生长十分迅速,仅依靠光合作用固定同化物不能满足笋的快速生长,主要还是依靠竹林种群的营养储存,这与潘雁红等人的研究结果一致[42]。尚未发育完全的幼株通常作为接受同化产物的汇,而相连的母株则是制造和输出同化产物的源[1],即在出笋过程中,母株作为同化物源利用自身贮存的有机同化物资源供应笋生长,这与对根茎克隆植物毕氏苔草(Carexbigelowii)和灯心草(Unciniameridensis)的研究结果相同[10]。在出笋生长的不同阶段,雷竹分株枝、叶含碳率随时间呈“∨”型变化趋势,根、秆、鞭含碳率呈“N”型变化趋势,各器官间的源-汇格局发生变化,推断这可能是由于雷竹克隆系统内母株充当制造和输出同化产物的源,将同化产物通过连接物(地下茎)源源不断的供给幼笋,在同一分株内枝、叶、秆中贮存的同化物传递至根、鞭贮存,出笋生长开始时根、鞭由原来有机同化物的汇变为源利用自身贮存的有机同化物供应笋的快速生长。随着幼株发育过程逐渐完成,它们可能最终变得完全独立而不再需要邻近相连母株的支持,于是便停止这种运输[43],则母株各器官含碳率逐渐上升,这与Price[44]对克隆植物虎仗(Reynoutriajaponica)的研究结果基本一致,即在冬季根、秆中同化物含量增加,成为源-汇关系中的汇,次年春季分株进行生长时,根、秆成为同化物的源将贮存的有机物运输至新生分株中。不同系统各器官有机碳含量下降或上升时期有所不同,这是由于在不同系统中,开始发笋及笋停止生长的时间有所差异。
本研究中,由于所选雷竹样株生长状况基本相同,各株径阶大小一致,可视为各株雷竹生物量大小基本相同。分析发现单株、多株系统各器官含碳率降幅与出笋量成反比,即单株系统出笋量小于多株系统,但各器官出笋时含碳率降幅大于多株系统,可能是由于多株系统水平方向分株间也存在源汇关系[44],相连分株有机碳资源均向相连基部运输供应笋的生长,多个分株同时为出笋提供有机质资源,因此多株系统各器官含碳率降幅相对于单株低。由于分株比例越大,供体分株生物量越大,在碳素资源传递过程中,供体分株的耗损对供体分株造成的损失越小,同时由于分株比例越大,资源传输需要消耗的能量也越少,对供体分株的耗损越小,因而生理整合强度越大[45- 46]。生理整合研究表明:资源在克隆分株间的传递具有双向性[47],王昱生等人利用14C标记的方法示踪克隆羊草内部光合有机产物存在向顶、向基及水平方向的传递,但其传递方向及传递的量很难精确描述[2]。本研究对不同分株数的克隆系统研究也表明在面对一定的资源压力时,多株系统分株间资源进行共享,其共享强度还需要在以后的研究中进行进一步探讨。出笋期,多株雷竹克隆系统内分株年龄影响各器官含碳率的变化幅度,双株系统1年生竹变化量大于2年生竹,3年生竹变化量大于1、2年生竹,可能是由于1年生竹光合能力较强,3年生竹贮存的同化物较多,通过相连的基茎为出笋提供碳素资源,这与石松属植物(Lycopdiumantoninum)及沙丘苔草(Carexarenaria)植物的研究结果一致[1],即不同年龄分株整合强度及整合能力可能不同,这是因为不同年龄分株,可以具有不同的光合能力和光合生产量[2],各分株之间资源转移速率与转移强度很可能是不同的。
综上所述,雷竹不同器官对出笋的响应为有机质资源发生转移,分株内碳素分配格局发生变化,各器官间的源-汇关系也会发生改变以满足笋的快速生长。供体分株数量与出笋量是影响碳素资源传递的重要因素,但决定相连分株间碳素资源转移强度的并不完全是分株数目和出笋量,还包括克隆系统内雷竹分株的年龄。在经营雷竹林时,提高雷竹林株间连接度,在除草、施肥、整地时避免断鞭,以便提高碳素资源整合度,调整雷竹林的年龄结构,相对较多地保留高光合能力的1年生竹和同化物贮存能力较高的3年生竹,调整雷竹林密度,提高雷竹林光合生产力对提高雷竹林的出笋量及其经济效益有一定的现实意义。对于克隆植物内部资源的整合影响因素较多,内部生理机制的影响及同化物转移强度、转移方向在未来研究中可以通过同位素示踪及多年限重复试验进行进一步研究,对雷竹林的经营具有十分重要的意义。
[1] 盛丽娟, 李德志, 朱志玲, 王绪平, 石强, 王超华, 范旭丽, 柯世朕. 克隆植物的碳素生理整合及其生态学效应. 应用与环境生物学报, 2007, 13(6): 888- 894.
[2] 王昱生, 洪锐民, 黄大明, 滕小华, 李月树, 盐见正卫, 中村未树. 羊草种群克隆分株之间光合产物的转移. 生态学报, 2004, 24(5): 900- 907.
[3] 于文龙, 许民. 区域尺度下不同树种木材含碳率测定研究. 安徽农业科学, 2013, 41(4): 1571- 1572.
[4] 徐小静, 朱向辉, 汪方德, 毛华英, 程清明, 汪良义, 汪传佳, 朱汤军. 毛竹等11种浙江省碳汇造林树种含碳率分析. 竹子研究汇刊, 2009, 28(1): 21- 24.
[5] 周国模, 姜培坤. 毛竹林的碳密度和碳贮量及其空间分布. 林业科学, 2004, 40(6): 20- 24.
[6] Zhang Q Z, Wang C K, Wang X C, Quan X K. Carbon concentration variability of 10 Chinese temperate tree species. Forest Ecology and Management, 2009, 258(5): 722- 727.
[7] 李江, 翟明普, 朱宏涛, 孟梦, 邱琼, 毛云玲, 陈宏伟, 郭永清. 思茅松人工中幼林的含碳率研究. 福建林业科技, 2009, 36(4): 12- 15.
[8] 付尧, 孙玉军. 植物有机碳测定研究进展. 世界林业研究, 2013, 26(1): 24- 30.
[9] Mogie M, Hutchings M J. Phylogeny, ontogeny and clonal growth in vascular plant. In: van Groenendael J, de Kroon H, eds. Clonal Growth in Plants: Regulation and Function. The Hague: SPB Academic Publishing, 1990: 3- 22.
[10] 何莹莹, 李德志, 徐洁, 王浩, 程立丽, 刘微. 不同光照条件下结缕草全株碳素生理整合格局及其生态效应. 植物资源与环境学报, 2013, 22(4): 1- 10.
[11] Li D Z, Takahashi S. Particularities of clonal plant species induced by physiological integration. Journal of Japanese Society of Grassland Science, 2003, 49(4): 395- 402.
[12] Hartnett D C, Bazzaz F A. Physiological integration among intraclonal ramets inSolidagocanadensis. Ecology, 1983, 64(4): 779- 788.
[13] Hartnett D C, Bazzaz F A. The genet and ramet population dynamics ofSolidagocanadensisin an abandoned field. Journal of Ecology, 1985, 73(2): 407- 413.
[14] Hartnett D C, Bazzaz F A. The integration of neighbourhood effects by clonal genets inSolidagocanadensis. Journal of Ecology, 1985, 73(2): 415- 427.
[15] 褚延梅, 杨健, 李景吉, 彭培好. 三种增温情景对入侵植物空心莲子草形态可塑性的影响. 生态学报, 2014, 34(6): 1411- 1417.
[16] 朱志玲. 不同土壤水分条件下断秆处理对克隆植物结缕草表型可塑性的影响. 安徽农业科学, 2010, 38(33): 18627- 18630.
[17] 汤俊兵, 肖燕, 安树青. 根秆克隆植物生态学研究进展. 生态学报, 2010, 30(11): 3028- 3036.
[18] 付京晶, 周华坤, 赵新全, 陈哲, 温军, 姚步青, 杨元武, 金艳霞. 草原克隆植物对光、温、水、肥和牧压变化梯度的响应. 草业科学, 2013, 30(4): 616- 626.
[19] 刘骏, 杨清培, 杨光耀, 方楷, 章情, 戴艳艳, 乐冬英, 欧阳明. 厚壁毛竹非结构性碳水化合物分配格局. 江西农业大学学报, 2011, 33(5): 924- 928.
[20] 何亚平, 费世民, 蒋俊明, 陈秀明, 余英, 唐森强, 朱维双. 长宁毛竹和苦竹有机碳空间分布格局. 四川林业科技, 2007, 28(5): 10- 14.
[21] 张称意, 杨持, 董鸣. 根秆半灌木羊柴对光合同化物的克隆整合. 生态学报, 2001, 21(12): 1986- 1993.
[22] Li D Z, Takahashi S, Zhu T C. Effects of soil nitrogen availability and clonal integration on the branching behaviors ofZoysiajaponica. Acta Prataculturae Sinica, 2006, 15(5): 135- 146.
[23] Price E A C, Marshall C, Hutching M J. Studies of growth in the clonal herbGlechomahederacea. I. Patterns of physiological integration. Journal of Ecology, 1992, 80(1): 25- 38.
[24] 陈劲松, 董鸣, 于丹, 刘庆. 不同光照条件下聚花过路黄的克隆构型和分株种群特征. 应用生态学报, 2004, 15(8): 1383- 1388.
[25] Ren F, Zhou H K, Zhao X Q, Han F, Shi L N, Duan J C, Zhao J Z. Influence of simulated warming using OTC on physiological-biochemical characteristics ofElymusnutansin alpine meadow on Qinghai-Tibetan plateau. Acta Ecologica Sinica, 2010, 30(3): 166- 171.
[26] 徐德兵, 赵粉侠, 贺斌, 李甜江, 段宗亮, 李根前. 中国沙棘克隆生长格局对不同灌水强度的响应. 东北林业大学学报, 2008, 36(9): 31- 32, 41- 41.
[27] 马钦彦, 陈遐林, 王娟, 蔺琛, 康峰峰, 曹文强, 马志波, 李文宇. 华北主要森林类型建群种的含碳率分析. 北京林业大学学报, 2002, 24(5/6): 96- 100.
[28] Yen T M, Ji Y J, Lee J S. Estimating biomass production and carbon storage for a fast-growing makino bamboo (Phyllostachysmakinoi) plant based on the diameter distribution model. Forest Ecology and Management, 2010, 260(3): 339- 344.
[29] Sohel S I, Alamgir M, Akhter S, Rahman M. Carbon storage in a bamboo (Bambusavulgaris) plantation in the degraded tropical forests: implications for policy development. Land Use Policy, 2015, 49: 142- 151.
[30] Yen T M, Lee J S. Comparing aboveground carbon sequestration between moso bamboo (Phyllostachysheterocycla) and China fir (Cunninghamialanceolata) forests based on the allometric model. Forest Ecology and Management, 2011, 261(6): 995- 1002.
[31] Nath A J, Das G, Das A K. Above ground standing biomass and carbon storage in village bamboos in North East India. Biomass and Bioenergy, 2009, 33(9): 1188- 1196.
[32] 方楷, 杨清培, 赵广东, 杨光耀, 施建敏, 郭起荣. 江西主要竹类植物碳密度的时空差异分析. 江西科学, 2010, 28(4): 449- 452.
[33] Wang Z W, Li L H, Han X G, Dong M. Do rhizome severing and shoot defoliation affect clonal growth ofLeymuschinensisat ramet population level?. Acta Oecologica, 2004, 26(3): 255- 260.
[34] 周资行, 焦健, 李毅, 李永兵, 张世虎. 民勤沙拐枣克隆种群构件结构及与环境因子的灰色关联分析. 林业科学, 2012, 48(5): 141- 149.
[35] Riis T, Lambertini C, Olesen B, Clayton J S, Brix H, Sorrell B K. Invasion strategies in clonal aquatic plants: Are phenotypic differences caused by phenotypic plasticity or local adaptation?. Annals of Botany, 2010, 106(5): 813- 822.
[36] Yu F H, Wang N, He W M, Chu Y, Dong M. Adaptation of rhizome connections in drylands: increasing tolerance of clones to wind erosion. Annals of Botany, 2008, 102(4): 571- 577.
[37] Liu H D, Yu F H, He W M, Chu Y, Dong M. Are clonal plants more tolerant to grazing than co-occurring non-clonal plants in inland dunes?. Ecological Research, 2007, 22(3): 502- 506.
[38] Marshall C, Sgar G R. The interdependence of tillers inLoliummultiflorumLam.—a quantitative assessment. Journal of Experimental Botany, 1968, 19(4): 785- 794.
[39] 王兵, 杨清培, 郭起荣, 赵广东, 方楷. 大岗山毛竹林与常绿阔叶林碳储量及分配格局. 广西植物, 2011, 31(3): 342- 348.
[40] Xu C Y, Schooler S S, Van Klinken R D. Effects of clonal integration and light availability on the growth and physiology of two invasive herbs. Journal of Ecology, 2010, 98(4): 833- 844.
[41] 陶建平,宋利霞. 亚高山暗针叶林不同林冠环境下华西箭竹的克隆可塑性. 生态学报,2006,26(12):4019- 4026.
[42] 潘雁红, 高贵宾, 吴良如, 钟浩, 周鸿翔, 袁娜. 生理整合对覆盖雷竹林克隆分株光合性状的影响. 安徽农业科学, 2015, 43(17): 230- 231, 245- 245.
[43] Marshall C. Source-sink relations of interconnected ramets//van Groenendael J M, de Kroon H, eds. Clonal Growth in Plants: Regulation and Function. The Hague: SPB Academic Publishing, 1990: 23- 41.
[44] Price E A C, Gamble R, Williams G G, Marshall C. Seasonal patterns of partitioning and remobilization of14C in the invasive rhizomatous perennial Japanese knotweed (Fallopiajaponica(Houtt.) Ronse Decraene). Evolutionary Ecology, 2001, 15(4/6): 347- 362.
[45] Li Q, Liu X, Yue M, Tang W T, Meng Q C. Response of physiological integration inTrifoliumrepensto heterogeneity of UV-B radiation. Flora-Morphology, Distribution, Functional Ecology of Plants, 2011, 206(8): 712- 719.
[46] 李倩, 刘晓, 张晓飞, 张瑞昌, 柴永福, 岳明. UV-B辐射方向对白三叶克隆整合的影响. 生态学报, 2014, 34(13): 3568- 3575.
[47] 程立丽, 李德志, 朱志玲, 何莹莹, 王浩, 纪倩倩, 刘微, 陈慧娟, 赖苏雯. 克隆植物结缕草的水分生理整合格局特征及其生态效应分析. 西北植物学报, 2013, 33(7): 1442- 1451.
Organic carbon allocation pattern and changes regulation in various organs ofPhyllostachysviolascensclone system in shooting period
JI Linke, XIE Jinzhong*, ZHANG Wei, LU Peng, ZHANG Lei
TheResearchInstituteofSubtropicalForestry,TheChineseAcademyofForestry,Hangzhou311400,China
Carbon assimilation from photosynthesis provides most substrates and energy for plant growth. To date, the distribution of carbon in various plant species has been intensively studied. However, information on carbon distribution during the shooting period in bamboo plants is limited. In this study, carbon distribution in different organs ofPhyllostachysviolascensplants with one, two, or three ramets was investigated during the shooting period, which enabled further study of the mechanisms that regulate bamboo species development. The results showed that the organic carbon content was significantly different in various organs ofP.violascensand that it changed significantly during the shooting period. Before the shooting period started, organic carbon content decreased in the order branch > leaf > stem > ramet > root; after shooting was completed, it decreased in the order branch > stem > leaf > ramet > root. Organic carbon initially decreased and then subsequently increased in branch and leaf and there was an “N”-like variation in organic carbon content in root, stem, and rhizome. The decrease in organic carbon content was negatively related to the shoot yield in both single and multi-ramet plants. The magnitude of the reduction in organic carbon content of various organs decreased with increasing ramet number and shoot output. Variation in organic carbon content was also found between plants with different ramet age. In the two-ramet plants, the reduction in organic carbon content was larger in 1-year-old plants than in 2-year-old plants, and in three-ramet plants, the reduction in organic carbon content was larger in 3-year-old plants than in 2-year-old and 1-year-old plants. These findings indicate that bamboo shooting affects organic carbon allocation, with a decrease in branch and leaf content and an increase in root, stem, and rhizome content. The potential source-sink relationship of different organs changes to provide organic carbon for bamboo shoots. Physiological integration of photosynthetic products occurs within the clonal segments ofP.violascens. With an increasing number of ramets, organic carbon in the shoots increased and loss of organic carbon in the ramets decreased. The organic carbon content also varied withP.violascensplant age during the shooting period. These findings have important practical implication in terms of shoot output and economic benefit, by adjusting the natural above-ground structure ofP.violascens.
Phyllostachysviolascens; clone system;shooting period;organic carbon allocation pattern
浙江省林业科技推广资助项目(2015B05);中国林业科学研究院基本科研业务费专项资金项目(2016)
2015- 12- 14;
2016- 05- 30
10.5846/stxb201512142488
*通讯作者Corresponding author.E-mail: jzhxie@163.net
冀琳珂,谢锦忠,张玮,卢鹏,张磊.雷竹克隆系统出笋期有机碳分布变化规律.生态学报,2016,36(23):7624- 7634.
Ji L K, Xie J Z, Zhang W, Lu P, Zhang L.Organic carbon allocation pattern and changes regulation in various organs ofPhyllostachysviolascensclone system in shooting period.Acta Ecologica Sinica,2016,36(23):7624- 7634.

