模拟热浪及强降温对Apo E-/-小鼠冠心病影响的实验研究
刘昊辰 张书余 周妍妍 况正中(1 南京信息工程大学应用气象学院,南京 10044; 河北省信息工程学校,保定 071030)
模拟热浪及强降温对Apo E-/-小鼠冠心病影响的实验研究
刘昊辰1,2张书余2周妍妍1,2况正中1,2
(1 南京信息工程大学应用气象学院,南京 210044; 2 河北省信息工程学校,保定 071030)
摘要:模拟一次典型天气过程,对比过程中Apo E-/-小鼠体重、肛温及HSP60、SOD、TNF、sICAM-1、HIF-1α、ET-1、NO的变化,探讨冷热刺激对小鼠的影响,为进一步探讨对心脑血管疾病的影响奠定基础。通过分析南京市实际气象要素资料,选取一次典型天气过程,并利用气象环境模拟箱模拟,将Apo E-/-小鼠分为实验组和对照组,每组6只,测量实验过程中各组小鼠体重、肛温,采用ELISA法测定热浪后小鼠HSP60、SOD、TNF、sICAM-1、HIF-1-、ET-1、NO变化情况。结果显示,小鼠体重不存在统计学差异(P>0.05),但在模拟实验过程结束后有所下降(P>0.05)。肛温热浪组与对照组相比有所升高(P>0.05),强降温组则又下降。HSP60、SOD、TNF、sICAM-1、HIF-1-表达水平上热浪组均高于对照组,与热浪组相比强降温组有所下降且具有统计学差异(P<0.05)。强降温将导致血管收缩。结果表明,热浪过程会加重动脉粥样硬化疾病的发生发展,强降温过程可能会极大地增加冠心病等心血管疾病的发病和死亡风险。
关键词:热浪,强降温,Apo E-/-小鼠,动脉粥样硬化,心脑血管疾病
Keyword:heat wave,strong cooling,Apo E Knockout Mice,atherosclerosis,cardiovascular disease
0 引言
心脑血管疾病是一类严重损害人类健康的疾病,它具有发病率高、致残率高、死亡率高等特点,其中冠心病、心肌梗死、脑卒中对健康威胁最为严重。而且,这类疾病的发生和患者的死亡与气象条件的剧烈变化存在着非常密切的关系[1]。动脉粥样硬化是冠心病发生的病理基础,临床研究表明,氧化应激及炎症反应在动脉硬化损伤的发生发展中起重要作用。心血管疾病患者体内炎症标志物水平较高[2],也有动物实验发现,热应激大鼠早期的炎性因子水平有上升趋势[3]。热休克蛋白(HSPs)也称热应激蛋白,具有细胞保护等多种生理功能,高温、缺氧等外界环境或发热、组织创伤等病理刺激均可促进HSP表达增加。HSP60是HSP家族中的重要一员,当机体遇到不良刺激时表达水平上升,可作为机体热应激能力与机体热耐性的敏感性特异指标。超氧化物歧化酶(SOD)是机体内一种重要的抗氧化生物酶,对维持机体氧化与抗氧化的平衡有重要意义,作为氧化应激及血管内皮功能研究的可靠指标,与心血管疾病的发病密切相关[4]。肿瘤坏死因子(TNF)、可溶性细胞间粘附分子1(sICAM-1)作为反映机体炎症水平的标志,其表达量的增加往往与急性血管疾病事件有关。另外,缺氧诱导因子-1α(HIF-1α)与缺血性心血管疾病的发生及病情相关,热浪发生时,环境温度和氧分压的变化可能使得机体HIF-1α的表达发生变化而与冠心病的发生发展有关。内皮素1(ET-1)与一氧化氮(NO)作为调节动物体内血管收缩平衡及心血管功能的重要因子,两者的动态平衡在血管平滑肌功能及血管张力的调节中具有重要的作用。两者的比值可以反映血管舒张水平,能够很好地反映热浪刺激对动物血管活动的影响。在研究心血管疾病发病和死亡方面具有重要指示意义。因此,本文选取HSP60、SOD、TNF、sICAM-1、HIF-1α、ET-1和NO作为检测指标。
近年来,南京高温及热浪天气发生频繁。通过前人研究可知,无论热刺激还是冷刺激均会对人体健康产生影响,而现实生活中往往会出现温度骤变过程,其对人体健康的影响研究相对较少。目前国内外关于高温热浪期间强降温的研究几乎是空白的,因此有必要研究热浪期间温度骤降过程对人体健康的影响。本文利用南京市实际气象资料,模拟一次典型热浪过程对Apo E-/-小鼠进行刺激,分析冷热刺激对Apo E-/-小鼠相关指标的影响。为研究热浪对心血管疾病的影响提供一个参考。
1 材料与方法
1.1仪器
TEM1880气象环境模拟试验箱,用于模拟温度随时间变化,并将实验Apo E-/-小鼠放入其中使其受到温度等气象要素的刺激。通过试验箱主控板,可以设定模拟天气过程中的温压值、温压变化斜率、程序运行方式(定值或程式)、程式段数、循环设置、预约设置以及设置温度(PID区间)的境界值等,且该设备能保证实验过程中有新鲜的空气进入,满足实验动物呼吸生理需求。
离心机(TDZ4-W),实验时离心3000r/min,15min后分离血浆并储存于-20℃低温冰箱中待检。
TH212专用测温仪,测温范围在-30~50℃之间,精度达到±0.2℃,分辨率为0.1℃,用于测量小鼠肛温。
此外还有电子天平,尾动脉无创血压仪,酶联免疫分析测定试剂盒等。
1.2实验动物选取
实验动物选用的是SPF级8周龄Apo E-/-基因敲除小鼠。Apo E基因敲除小鼠无论正常或高脂饮食,由于富含胆固醇的脂蛋白清除障碍,均可形成高血脂症,从而使得血浆胆固醇水平较高[5]。Yutaka Nakashima等的研究表明,动脉粥样硬化各阶段的病理表现均存在于Apo E基因敲除小鼠中,而且它能够在所有胸腹动脉中形成广泛的粥样硬化病变,认为Apo E基因敲除小鼠的动脉粥样硬化病变的发展同人类极其相似[6]。近年来,Apo E基因敲除小鼠已成为研究动脉粥样硬化发病机制以及抗动脉粥样硬化药理学研究等方面最重要的动物模型之一[7]。
1.3动物饲养及分组
实验采用8周龄SPF级Apo E基因缺陷小鼠18只,体重为25.2~31.0g,进行标准西方饮食饲养8周,严格控制昼夜节律,每日光照开始于08时,结束于20时,室内湿度保持在45%左右,环境温度控制在30℃。然后将18只小鼠按照体重配对并分为对照组(C)、热浪组(H)、强降温组(S),每组6只。将实验组小鼠放入气象环境模拟试验箱,暴露于一个完整的天气温度变化过程中,而对照组则继续按照适应期条件饲养。
1.4降温等级划分及实验过程
1.4.1降温等级划分
实验所使用的气象数据为江苏省南京市2001—2010年6—8月份逐时气象要素资料,在本次研究中采用气温这一单一要素。热浪的定义采用中国气象局制定的标准,即日最高气温≥35℃为高温且高温持续时间≥3d。而关于温度骤降的概念在气象上还没有一个明确的定量概念,因此,为了便于研究,本文参考冷空气等级国家标准(GB/T 20484—2006),根据历史气象数据的统计分析,制定了高温天气下降温的等级划分标准。划分的原则采用高温天气背景下,一定时段内持续降温幅度来具体划分降温等级。高温天气下降温判别标准:以1h、2h、4h、6h、8h连续降温幅度(∆T1、∆T2、∆T4、∆T6、∆T8)≥6℃为标准。将降温等级分为弱降温、中等降温、较强降温、强降温和气温骤降五个等级。详见表1。

表1 高温天气下降温等级划分标准Table 1 On the dividing standard of cooling level under the high temperature weather
1.4.2实验曲线建立
依据本文研究内容,本文选取了一次南京持续时长为3d的实际热浪过程以做探讨,实验模拟温度曲线模型选择为2006年6月19日5时—22日11时的高温热浪期间突然强降温天气过程,两小时持续降温幅度超过10℃。
模拟曲线如图1所示。对照组(C)实验温度选取为动物适应性饲养造模时的温度30℃,实验组分别为热浪组(H)、强降温组(S),对应图中2个采样点。热浪组和强降温组分别为了研究热刺激和温度骤降对Apo E-/-小鼠的影响。
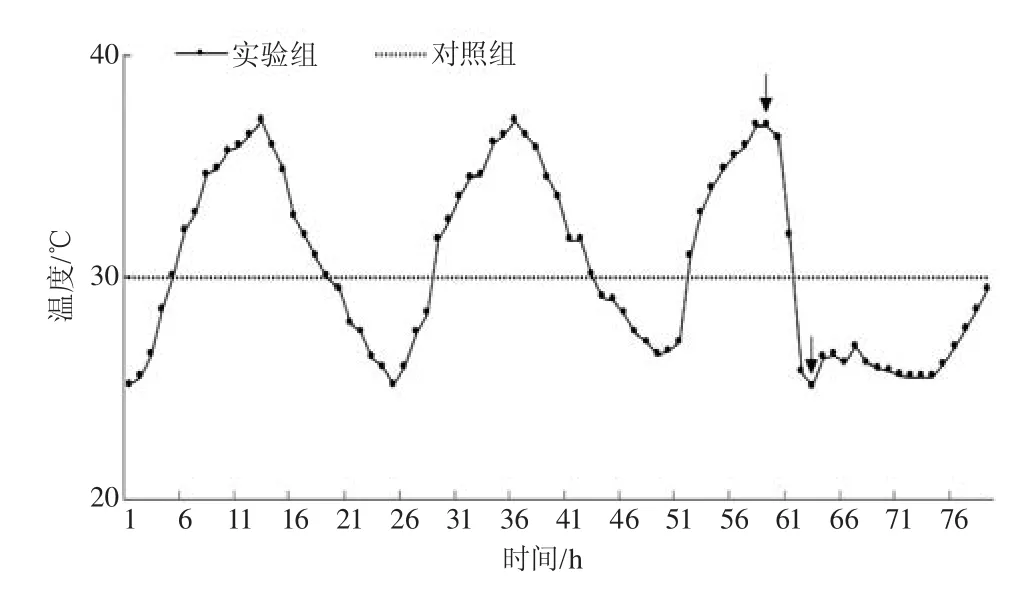
图1 实验温度曲线(箭头指出部分为采样点)Fig.1 The experimental temperature curve
1.4.3实验过程
对进行实验的小鼠进行随机分组后,首先按照适应期条件进行空白对照饲养一周,测量小鼠基本生理指标并记录。然后将12只实验组Apo E-/-小鼠放入气象环境模拟试验箱中按照实验温度设好程序,对小鼠进行刺激。在热浪过程结束温度骤降开始时刻(59h)和温度骤降过程结束时刻(63h),分别取出热浪组小鼠(6只)和强降温组小鼠(6只),测量其基本生理指标,包括肛温、体重。并摘取小鼠心脏,取心尖部称重,并加入9倍0.9%生理盐水进行匀浆,于3000r/min离心15min,取上清液于-20℃低温冰箱中存储,随后采用ELISA法测定小鼠HSP60、SOD、TNF、sICAM-1、HIF-1-、ET-1、NO变化情况。对照组饲养条件同适应期,检测步骤与实验组相同。
1.4.4统计分析
2 结果分析
2.1肛温与体重
肛温、体重是小鼠的基本生理指标,热浪过程期间小鼠肛温的波动情况能够反映出小鼠对冷、热刺激的直接反映。如表2所示,实验期间各实验组小鼠肛温和体重变化情况可以看出,各组间Apo E-/-小鼠体重变化不存在统计学差异(P>0.05),但在模拟实验过程期间小鼠体重呈现持续减轻的变化情况,热浪过程结束后较实验开始时下降了0.15g。与此同时,对小鼠肛温的检测结果可以得出,各组别小鼠肛温变化明显。随着实验过程的持续,热浪组小鼠肛温上升了0.06℃,与对照组小鼠肛温相比并无统计学差异(P>0.05)。但随着温度骤降过程的发生,小鼠肛温表现出明显的下降,强降温组小鼠肛温与对照组和热浪组相比分别下降了1和1.06℃,差异有统计学意义(P<0.05,P<0.01)。
表2 Apo E-/-小鼠肛温及体重变化比较(,n=6)Table 2 Rectal Temperature and Body Weight changes in Apo E-/-mice(,n=6)
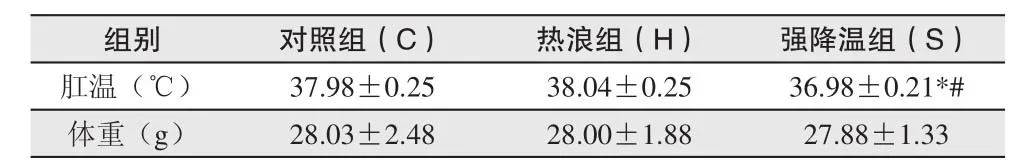
表2 Apo E-/-小鼠肛温及体重变化比较(,n=6)Table 2 Rectal Temperature and Body Weight changes in Apo E-/-mice(,n=6)
注:*为P<0.05与对照组相比;#为P<0.01与热浪组相比。
组别 对照组(C) 热浪组(H) 强降温组(S)肛温(℃) 37.98±0.25 38.04±0.25 36.98±0.21*#体重(g) 28.03±2.48 28.00±1.88 27.88±1.33
2.2HSP60、SOD、TNF、sICAM-1、HIF-1-
表3所示检测结果可以看出,热浪-强降温过程模拟结束后,Apo E-/-小鼠HSP60、SOD、TNF、sICAM-1、HIF-1α这五项检测指标的变化情况均表现出相同的趋势,即热浪组小鼠较对照组小鼠均有显著升高,而随着小鼠经历温度骤降过程的刺激后,五项指标有所缓解,均表现出不同程度的下降。其中,热浪组小鼠心肌组织匀浆HSP60含量较对照组升高了1.43ng/ml,升高显著,具有统计学差异(P <0.05),强降温过程使得HSP60表达水平恢复,与热浪组相比差异有显著性(P<0.05)。热浪组SOD表达水平上升十分明显,与对照组相比上升幅度高达45.72%,具有统计学差异(P<0.01),温度骤降的发生也使得强降温组小鼠SOD表达水平有所下降,与对照组和热浪组相比均有统计学差异(P<0.01,P<0.01)。TNF和sICAM-1标志着机体炎症反应程度,二者在经历热浪刺激后均表现出显著升高的情况,尤其是sICAM-1,热浪组与对照组相比高出84.48ng/L,增幅达到1.27倍之多,虽然温度骤降过程使得强降温组表达水平较热浪组而言均有所下降,但从表中可以看出二者强降温组的表达水平相比对照组仍处于较高的水平,差异具有显著性(P<0.01)。同样,与冠心病等缺血性疾病的发生发展密切相关的HIF-1α表达水平在经历热浪刺激后显著升高,热浪组小鼠比对照组小鼠高出23.8ng/L,两组相比具有统计学差异(P<0.01),温度骤降虽也使其缓解,但与对照组相比仍具有统计学差异(P<0.01),处于较高水平。
表3 Apo E-/-小鼠HSP60、SOD、TNF、sICAM-1、HIF-1α变化比较(,n=6)Table 3 HSP60、SOD、TNF、sICAM-1、HIF-1α changes in Apo E-/-mice(,n=6)
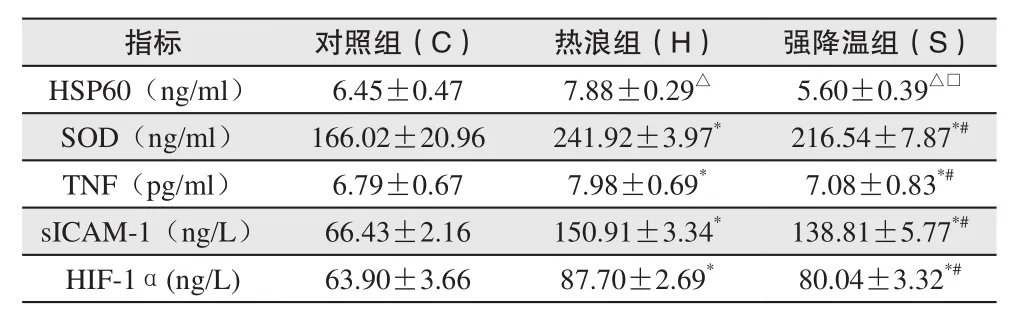
表3 Apo E-/-小鼠HSP60、SOD、TNF、sICAM-1、HIF-1α变化比较(,n=6)Table 3 HSP60、SOD、TNF、sICAM-1、HIF-1α changes in Apo E-/-mice(,n=6)
注:△为P<0.05与对照组相比;□为P<0.05与热浪组相比;*为P<0.01与对照组相比;#为P<0.01与热浪组相比。
指标 对照组(C) 热浪组(H) 强降温组(S)HSP60(ng/ml) 6.45±0.47 7.88±0.29△ 5.60±0.39△□SOD(ng/ml) 166.02±20.96 241.92±3.97* 216.54±7.87*#TNF(pg/ml) 6.79±0.67 7.98±0.69* 7.08±0.83*#sICAM-1(ng/L) 66.43±2.16 150.91±3.34* 138.81±5.77*#HIF-1α(ng/L) 63.90±3.66 87.70±2.69* 80.04±3.32*#
2.3ET-1和NO
图2中(a—c)分别显示的是此次模拟过程结束后小鼠血浆中ET-1、NO及NO/ET-1的表达水平。在热浪期间小鼠血浆ET-1表达水平有小幅下降,通过了显著性检验(P<0.01),在经历温度骤降过程后迅速升高了2.48ng/L,与热浪组相比具有统计学差异(P <0.01)。而NO的表达水平在受到热浪过程刺激后明显升高,热浪组比对照组高出2.31μmol/L,增幅高达67.77%,而温度骤降则使得NO表达水平下降,与热浪组相比具有统计学差异(P<0.01)。NO与ET-1两者的比值可以反映血管舒张水平,热浪组与对照组相比显著升高,机体血管趋于舒张散热,而温度骤降过程导致NO/ET-1显著下降与热浪组相比具有统计学差异(P<0.01),将会导致机体血管迅速收缩。

图2 Apo E-/-小鼠ET-1(a)、NO(b)和NO/ET-1(c)的变化情况Fig.2 ET-1(a)、NO(b)and NO/ET-1(c)concentration changes in Apo E-/-mice(*为P<0.01与对照组相比,#为P<0.01与热浪组相比)
3 讨论与结论
动物会采用各种生理学、行为学机制来对体温进行调节,这对其生存对策、分布模式、适应进化途径及生活史对策有深刻影响。而对体温的调节过程也正是对环境变化的适应。但无论人还是动物,对维持体温恒定的能力都有限。当发生热刺激时,小鼠的温觉感受器会产生冲动传入体温调节中枢,在神经系统作用下,机体会表现为心肌收缩增强、心排血量增加、外周血管扩张,从而增加散热,体温上升,所以,热浪会刺激小鼠体温上升[8]。而低温环境中,小鼠首先通过体温调节机制减少散热、增加产热,尽量维持体温的恒定。如皮肤血管收缩降低体表温度,缩小皮肤表面与环境间温度梯度,减少散热,体外周温度下降,其结果必然会产生热债,从而使体温降低[9]。冷刺激会导致血压升高等一系列生理反应。吴伟康等[10]通过老年鼠和青年鼠对比实验研究发现,在经历低温环境刺激后,老年鼠体温下降幅度明显高于青年鼠,而冷刺激停止后,体现自然恢复能力明显低于青年组。由此可见,在热浪过程中应提高对温度骤降过程的警惕,在对体温的影响上强降温更加明显,且更要重视对老年人的保护,特别是动脉粥样硬化、冠心病等血管功能异常的老年人。
1999年Ross提出了动脉粥样硬化是一种炎症性疾病的说法。心血管疾病患者体内炎症标志物水平较高,在受到外界刺激时,机体内部的氧化与抗氧化作用平衡会遭到破坏,产生大量氧自由基,使得机体处于氧化应激状态,因此导致了SOD表达水平的升高,而脂质代谢紊乱和细胞损伤越严重,会引起脂质过氧化、细胞毒性作用,破坏血管内皮,促进不稳定斑块形成[11-12]。HSP60的表达水平与冠心病发病风险极为相关,其高表达的群体患病的风险会提高数倍。本次实验结果表明,热浪过程可以诱导机体HSP60表达水平增加。机体在热刺激下产生过多的HSP60可以活化免疫细胞,诱导内皮细胞、巨噬细胞分泌大量TNF-α、ICAM-1等炎性细胞因子[13-14],增加炎性细胞粘附及脂质沉积,从而形成动脉粥样硬化,加速病变。而本次模拟试验通过对TNF及sICAM-1表达水平的检测结果则证明了这一理论。持续性高强度的热刺激可以导致机体过热,TNF等细胞因子表达显著上升,引发炎症损伤。sICAM-1表达升高后,可通过诱导白细胞粘附于血管内皮,形成血栓,同时,介导的激活白细胞所产生的氧自由基和血管活性物质可引起内皮损伤。缺氧诱导因子-1(HIF-1)是一种具有转录活性的核蛋白,与缺氧适应、炎症过程中的大量相关基因的表达相关。HIF-1α除了已被人们认知的在低氧环境中的功能,在热耐受性及热适应响应也有着重要作用,可在热环境下被诱发[15]。有研究表明,TNF表达上升也会上调HIF-1α活性,本次实验结果也表明,热浪刺激可通过诱导心肌组织中HIF-1α的表达,增大冠心病发病风险,所以,高温热浪使得体内炎症反应加强,TNF-α、sICAM-1等炎性细胞因子显著升高,是热浪过程增加冠心病风险的一个诱因。虽然小鼠经历热浪期间强降温刺激后HSP60、TNF、sICAM-1及HIF-1α表达水平均表现出下降的情况,但温度骤降会使得血管收缩,增强机体血液凝血功能[16]。NO与ET-1作为调节动物体内血管收缩平衡及心血管功能的重要因子,在冠心病病理机制研究中有重要地位,两者的比值可以反映血管舒张水平,能够很好地反映热浪刺激对动物血管活动的影响。本次实验对ET-1和NO的检测结果可以明显发现,在温度骤降发生后血管收缩因子显著升高,NO与ET-1的比值也反映出血管将趋于收缩。由于热浪期间机体可能存在血管内皮损伤,形成了不稳定斑块、炎性细胞粘附及脂质沉积,在温度骤降发生时血管迅速收缩将极大加速动脉粥样硬化及血栓的形成,从而导致冠心病等心血管疾病的发病和死亡。
综合上述实验结果可以得出,热浪过程会诱使机体炎症标志物水平显著升高,从而加重动脉粥样硬化疾病的发生发展,而热浪期间强降温过程将导致血管迅速收缩,将极大地加速动脉粥样硬化及血栓的形成,从而增加冠心病等心血管疾病的发病和死亡。因此,在热浪期间应提高对强降温过程的关注,在热浪过程期间尤其要重视保护已经存在脂质代谢异常的人群,提前做好预防措施以减少冠心病等心血管疾病的发病和死亡。
参考文献
[1]高霞,李素芹,张大辉.心脑血管疾病与气象条件关系分析研究.第28届中国气象学会年会:S14气候环境变化与人体健康.北京:中国气象学会,2011:135-141.
[2]陈瑗,周玫.氧化应激-炎症在动脉粥样硬化发生发展中作用研究的新进展.中国动脉硬化杂志,2008,16(10):757-762.
[3]郑春雨,张伟,梁永刚.热应激大鼠早期炎性因子水平及乌司他丁干预的效果.医学研究生学报,2011,24(1):25-28.
[4]Wang C,Zhang S,Tian Y,et al.Effects of simulated heat waves on ApoE-/-Mice.International Journal of Environmental Research and Public Health,2014,11(2):1549-1556.
[5]张晓明,杨继红.Apo E与动脉粥样硬化的关系及Apo E基因敲除小鼠在动脉粥样硬化研究中的应用.昆明医学院报,2012(Z1):169-172.
[6]Szmitko P E,Verma S.C-Reactive protein and the metabolic syndrome:Useful addition to the cardiovascular risk profile? .Journal of the Cardiometabolic Syndrome,2006,1(1):66-69.
[7]Tedgui A,Mallat Z.Cytokines in atherosclerosis:Pathogenic and regulatory pathways.Physiological Reviews,2006,86(2):515-581.
[8]张书余.医疗气象预报.北京:气象出版社,2010.
[9]徐斌,梅丹.环境温度对缺氧大鼠体温的影响.解放军预防医学杂志,2001,19(1):38-39.
[10]吴伟康,罗汉川,侯灿.冷应激对老年小鼠体温、血糖浓度和血浆MDA水平的影响.老年学杂志,1991(05):302-304,320.
[11]张志辉,周胜华,祁述善,等.氧化应激,炎症与冠心病患者冠状动脉斑块的关系.中南大学学报(医学版),2006,31(4):556-558.
[12]刘阳,张义,李英杰.冠心病患者氧化-抗氧化平衡检测及其临床意义.武警医学院学报,2010(009):717-719.
[13]王贺,卢义.热休克蛋白60与冠状动脉粥样硬化关系的研究进展.中国实验诊断学,2012,16(4):750-753.
[14]杨军,吴小庆,薄小萍,等.血清中人热休克蛋白60的检测在急性冠状动脉综合征中的价值分析.现代医学,2011,39(1):1-5.
[15]田颖.基于小鼠试验探讨热浪对冠心病的影响机理.南京:南京信息工程大学,2014.
[16]罗斌,张书余,周骥,等.探讨模拟冷空气降温过程对健康大鼠和高血压大鼠凝血功能的影响.中国应用生理学杂志,2012,28(5):390-393.
Effects of Simulated Heat Wave and Strong Cooling on Risk Factors for Coronary Heart Disease of Apo E Knockout Mice
Liu Haochen1,2,Zhang Shuyu2,Zhou Yanyan1,2,Kuang Zhengzhong1,2
(1 College of Applied Meteorology,Nanjing University of Information Science and Technology,Nanjing 210044 2 Information Engineering School in Hebei Province,Baoding 071030)
Abstract:Objective:Simulate a typical weather process and compare the levels of Apo E Knockout Mice’ HSP60,SOD,TNF,sICAM-1,HIF-1α,ET-1,NO,body weight and rectal temperature to study the effects of hot and cold stimulation in mice.In order to further investigate the impact of heat wave on cardiovascular disease,eighteen Apo E Knockout Mice were divided into the heat wave group,strong cooling group and control group.The body weight and rectal temperature of each mouse were measured every day.By use of meteorological environment simulation box,the process of heat wave was stimulated,determining HSP60,SOD,TNF,sICAM-1,HIF-1α,ET-1,NO of Apo E Knockout Mice,measured by enzyme linked immunosorbent assay(ELISA).The result is as follows,HSP60,SOD,TNF,sICAM-1,HIF-1α and rectal temperature of Apo E Knockout Mice in group of heat wave were higher than that in strong cooling and control group.Body weight showed no significant difference but risk increased after the simulation process in strong cooling group.Strong cooling will cause vasoconstriction.Conclusion:Thermal stimulation may aggravate atherosclerosis disease development.The process of Strong Cooling may greatly increase the risk of coronary heart disease.
通信作者:张书余(1958—),Email:zhangsy@cma.gov.cn
收稿日期:2014年8月18日;修回日期:2014年11月6日
DOI:10.3969/j.issn.2095-1973.2016.01.006
第一作者:刘昊辰(1989—),Email:xingchen19891228@sina.com
资助信息:国家自然基金项目(41375121)
 Advances in Meteorological Science and Technology2016年1期
Advances in Meteorological Science and Technology2016年1期
- Advances in Meteorological Science and Technology的其它文章
- FY-3C的掩星探测特点和初步结果
- 国外地球同步轨道气象卫星成像观测模式发展分析
- 媒体扫描MEDIA SCAN
- 气象风云多变换 理念创新得天下——2015年NOAA卫星大会评介
- 《无线电频谱需求增加下的主动遥感发展战略》评介
- 风云极轨卫星数据的第一“落脚地”——佳木斯气象卫星地面站采访侧记
